41.1: Osmoregulación y Equilibrio Osmótico
- Page ID
- 59366
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Habilidades para Desarrollar
- Definir ósmosis y explicar su papel dentro de las moléculas
- Explicar por qué la osmorregulación y el equilibrio osmótico son funciones corporales importantes
- Describir los mecanismos de transporte activos
- Explicar la osmolaridad y la forma en que se mide
- Describir los osmorreguladores u osmoconformadores y cómo estas herramientas permiten que los animales se adapten a diferentes ambientes
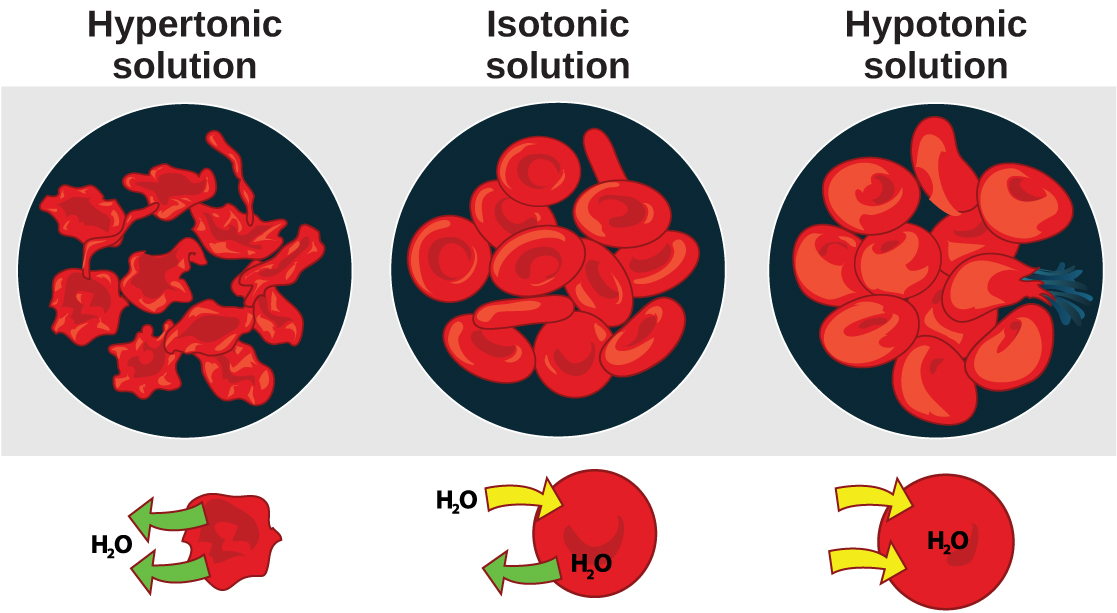
La ósmosis es la difusión del agua a través de una membrana en respuesta a la presión osmótica causada por un desequilibrio de moléculas a ambos lados de la membrana. La osmorregulación es el proceso de mantenimiento del equilibrio de sal y agua (equilibrio osmótico) a través de las membranas dentro de los fluidos corporales, los cuales están compuestos por agua, además de electrolitos y no electrolitos. Un electrolito es un soluto que se disocia en iones cuando se disuelve en agua. Un no electrolito, por el contrario, no se disocia en iones durante la disolución del agua. Tanto los electrolitos como los no electrolitos contribuyen al equilibrio osmótico. Los fluidos corporales incluyen el plasma sanguíneo, el citosol dentro de las células y el líquido intersticial, el líquido que existe en los espacios entre las células y los tejidos del cuerpo. Las membranas del cuerpo (como las membranas pleurales, serosas y celulares) son membranas semipermeables. Las membranas semipermeables son permeables (o permisivas) a ciertos tipos de solutos y agua. Las soluciones en dos lados de una membrana semipermeable tienden a igualarse en la concentración de solutos mediante el movimiento de solutos y/o agua a través de la membrana. Como se ve en la Figura\(\PageIndex{1}\), una celda colocada en el agua tiende a hincharse debido a la ganancia de agua del ambiente hipotónico o “bajo en sal”. Una célula colocada en una solución con mayor concentración de sal, por otro lado, tiende a hacer que la membrana se marchite debido a la pérdida de agua en el ambiente hipertónico o “alto en sal”. Las células isotónicas tienen una concentración igual de solutos dentro y fuera de la célula; esto iguala la presión osmótica a cada lado de la membrana celular que es una membrana semipermeable.
El cuerpo no existe aisladamente. Hay una entrada constante de agua y electrolitos en el sistema. Si bien la osmorregulación se logra a través de las membranas dentro del cuerpo, el exceso de electrolitos y desechos se transportan a los riñones y se excretan, ayudando a mantener el equilibrio osmótico.
Necesidad de Osmoregulación
Los sistemas biológicos interactúan constantemente e intercambian agua y nutrientes con el medio ambiente a través del consumo de alimentos y agua y a través de la excreción en forma de sudor, orina y heces. Sin un mecanismo para regular la presión osmótica, o cuando una enfermedad daña este mecanismo, existe una tendencia a acumular residuos tóxicos y agua, lo que puede tener consecuencias nefastas.
Los sistemas de mamíferos han evolucionado para regular no solo la presión osmótica general a través de las membranas, sino también concentraciones específicas de electrolitos importantes en los tres compartimentos principales de fluidos: plasma sanguíneo, líquido extracelular y fluido intracelular. Dado que la presión osmótica está regulada por el movimiento del agua a través de las membranas, el volumen de los compartimentos de fluido también puede cambiar temporalmente. Debido a que el plasma sanguíneo es uno de los componentes líquidos, las presiones osmóticas influyen directamente en la presión arterial.
Transporte de electrolitos a través de membranas celulares
Los electrolitos, como el cloruro de sodio, se ionizan en agua, lo que significa que se disocian en sus iones componentes. En agua, el cloruro de sodio (NaCl), se disocia en el ion sodio (Na +) y el ion cloruro (Cl —). Los iones más importantes, cuyas concentraciones están muy reguladas en los fluidos corporales, son los cationes sodio (Na +), potasio (K +), calcio (Ca +2), magnesio (Mg +2), y los aniones cloruro (Cl -), carbonato (CO 3 -2 ), bicarbonato (HCO 3 -) y fosfato (PO 3 -). Los electrolitos se pierden del cuerpo durante la micción y la transpiración. Por esta razón, se alienta a los atletas a reemplazar electrolitos y líquidos durante periodos de mayor actividad y transpiración.
La presión osmótica está influenciada por la concentración de solutos en una solución. Es directamente proporcional al número de átomos o moléculas de soluto y no depende del tamaño de las moléculas de soluto. Debido a que los electrolitos se disocian en sus iones componentes, ellos, en esencia, agregan más partículas de soluto a la solución y tienen un mayor efecto sobre la presión osmótica, por masa que los compuestos que no se disocian en el agua, como la glucosa.
El agua puede pasar a través de membranas por difusión pasiva. Si los iones electrolíticos pudieran difundirse pasivamente a través de las membranas, sería imposible mantener concentraciones específicas de iones en cada compartimento de fluido, por lo que requieren mecanismos especiales para cruzar las membranas semipermeables en el cuerpo. Este movimiento se puede lograr mediante la difusión facilitada y el transporte activo. La difusión facilitada requiere canales basados en proteínas para mover el soluto. El transporte activo requiere energía en forma de conversión de ATP, proteínas portadoras o bombas para mover iones contra el gradiente de concentración.
Concepto de Osmolalidad y Miliequivalente
Para calcular la presión osmótica, es necesario entender cómo se miden las concentraciones de soluto. La unidad para medir solutos es el mol. Un mol se define como el peso molecular gramo del soluto. Por ejemplo, el peso molecular del cloruro de sodio es 58.44. Así, un mol de cloruro de sodio pesa 58.44 gramos. La molaridad de una solución es el número de moles de soluto por litro de solución. La molalidad de una solución es el número de moles de soluto por kilogramo de disolvente. Si el solvente es agua, un kilogramo de agua equivale a un litro de agua. Si bien la molaridad y la molalidad se utilizan para expresar la concentración de soluciones, las concentraciones de electrolitos generalmente se expresan en términos de miliequivalentes por litro (mEq/L): el mEq/L es igual a la concentración de iones (en milimoles) multiplicada por el número de cargas eléctricas sobre el ión. La unidad de miliequivalente toma en consideración los iones presentes en la solución (ya que los electrolitos forman iones en soluciones acuosas) y la carga sobre los iones.
Así, para los iones que tienen una carga de uno, un miliequivalente es igual a un milimol. Para los iones que tienen una carga de dos (como el calcio), un miliequivalente es igual a 0.5 milimoles. Otra unidad para la expresión de la concentración de electrolitos es el miliosmol (MoSM), que es el número de miliequivalentes de soluto por kilogramo de disolvente. Los fluidos corporales generalmente se mantienen dentro del rango de 280 a 300 mOsm.
Osmoreguladores y Osmoconformadores
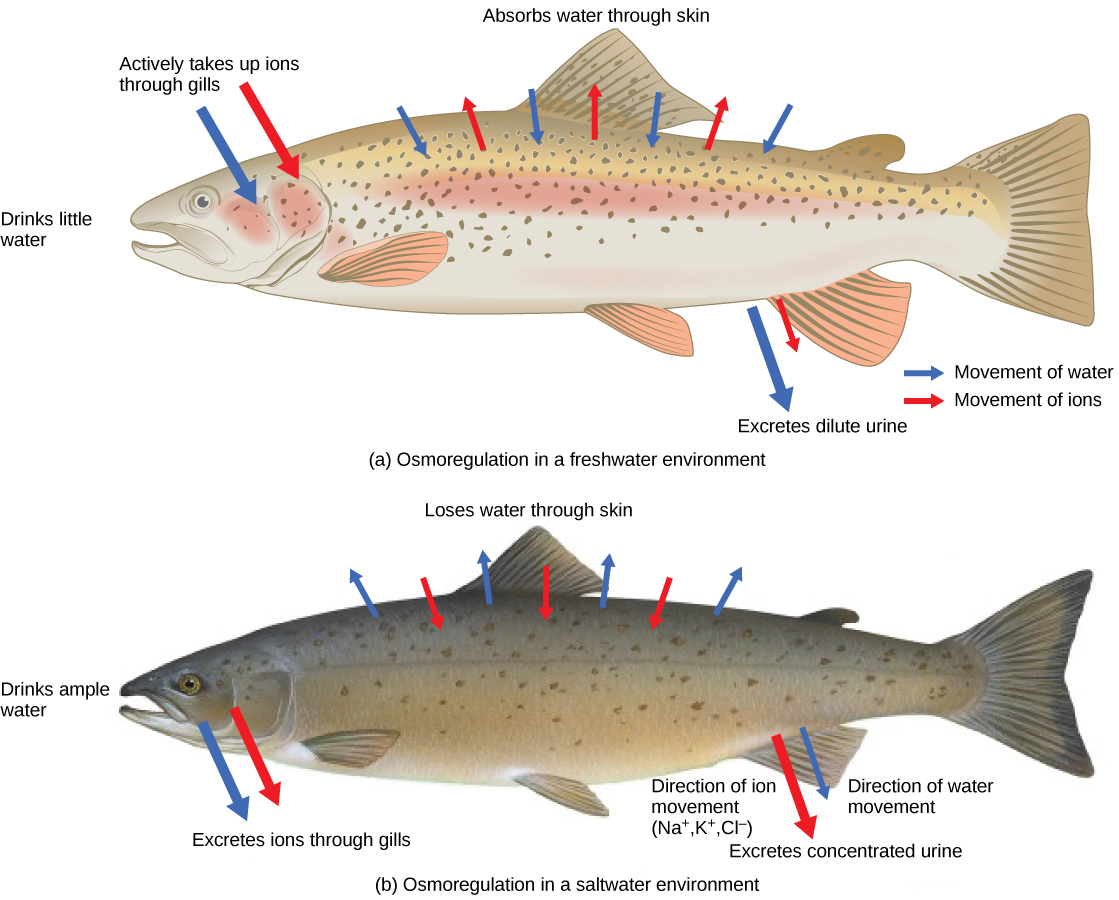
Las personas perdidas en el mar sin agua dulce para beber corren el riesgo de sufrir deshidratación severa porque el cuerpo humano no puede adaptarse al consumo de agua de mar, que es hipertónica en comparación con los fluidos corporales. Los organismos como los peces de colores que solo pueden tolerar un rango relativamente estrecho de salinidad se denominan estenohalinos. Alrededor del 90 por ciento de todos los peces óseos están restringidos a agua dulce o de mar. Son incapaces de regulación osmótica en el ambiente opuesto. Es posible, sin embargo, que algunos peces como el salmón pasen parte de su vida en agua dulce y parte en agua de mar. Los organismos como el salmón y el molly que pueden tolerar un rango relativamente amplio de salinidad se denominan organismos eurihalinos. Esto es posible porque algunos peces han desarrollado mecanismos osmorreguladores para sobrevivir en todo tipo de ambientes acuáticos. Cuando viven en agua dulce, sus cuerpos tienden a tomar agua porque el ambiente es relativamente hipotónico, como se ilustra en la Figura\(\PageIndex{2}\) a; en tales ambientes hipotónicos, estos peces no beben mucha agua. En cambio, pasan mucha orina muy diluida, y logran el equilibrio electrolítico mediante el transporte activo de sales a través de las branquias. Cuando se trasladan a un ambiente marino hipertónico, estos peces comienzan a beber agua de mar; excretan el exceso de sales a través de sus agallas y su orina, como se ilustra en la Figura\(\PageIndex{2}\) b. La mayoría de los invertebrados marinos, por otro lado, pueden ser isotónicos con el agua de mar (osmoconformadores). Sus concentraciones de fluidos corporales se ajustan a los cambios en la concentración de agua de mar. La composición salina de los peces cartilaginosos de la sangre es similar a la de los peces óseos; sin embargo, la sangre de los tiburones contiene los compuestos orgánicos urea y óxido de trimetilamina (TMAO). Esto no quiere decir que su composición electrolítica sea similar a la del agua de mar. Logran isotonicidad con el mar almacenando grandes concentraciones de urea. Estos animales que secretan urea se denominan animales ureotélicos. El TMAO estabiliza las proteínas en presencia de altos niveles de urea, evitando la alteración de los enlaces peptídicos que se producirían en otros animales expuestos a niveles similares de urea. Los tiburones son peces cartilaginosos con glándula rectal para secretar sal y ayudar en la osmorregulación.
Conexión de Carrera: Técnico en Diálisis
La diálisis es un proceso médico de eliminación de desechos y exceso de agua de la sangre por difusión y ultrafiltración. Cuando falla la función renal, se debe realizar diálisis para eliminar artificialmente los desechos del cuerpo. Este es un proceso vital para mantener vivos a los pacientes. En algunos casos, los pacientes se someten a diálisis artificial hasta que son elegibles para un trasplante de riñón. En otros que no son candidatos para trasplantes de riñón, la diálisis es una necesidad de por vida.
Los técnicos de diálisis suelen trabajar en hospitales y clínicas. Si bien algunos roles en este campo incluyen el desarrollo y mantenimiento de equipos, la mayoría de los técnicos de diálisis trabajan en la atención directa al paciente. Sus deberes en el trabajo, que generalmente ocurren bajo la supervisión directa de una enfermera registrada, se enfocan en brindar tratamientos de diálisis. Esto puede incluir revisar la historia del paciente y la condición actual, evaluar y responder a las necesidades del paciente antes y durante el tratamiento, y monitorear el proceso de diálisis. El tratamiento puede incluir tomar y reportar los signos vitales de un paciente y preparar soluciones y equipos para garantizar procedimientos precisos y estériles.
Resumen
Las concentraciones de solutos a través de membranas semipermeables influyen en el movimiento del agua y los solutos a través de la membrana. Es el número de moléculas de soluto y no el tamaño molecular lo que es importante en la ósmosis. La osmorregulación y el equilibrio osmótico son funciones corporales importantes, dando como resultado un equilibrio hídrico y salino. No todos los solutos pueden pasar a través de una membrana semipermeable. La ósmosis es el movimiento del agua a través de la membrana. La ósmosis ocurre para igualar el número de moléculas de soluto a través de una membrana semipermeable por el movimiento del agua hacia el lado de mayor concentración de soluto. La difusión facilitada utiliza canales de proteínas para mover las moléculas de soluto de áreas de mayor a menor concentración, mientras que se requieren mecanismos de transporte activos para mover solutos contra gradientes de concentración. La osmolaridad se mide en unidades de miliequivalentes o miliosmoles, los cuales toman en consideración el número de partículas de soluto y la carga sobre ellas. Los peces que viven en agua dulce o salada se adaptan al ser osmorreguladores u osmoconformadores.
Glosario
- electrolito
- soluto que se descompone en iones cuando se disuelve en agua
- molalidad
- número de moles de soluto por kilogramo de disolvente
- molaridad
- número de moles de soluto por litro de solución
- mole
- equivalente en gramos del peso molecular de una sustancia
- no electrolítico
- soluto que no se descompone en iones cuando se disuelve en agua
- osmoconformador
- organismo que cambia su tonicidad en función de su entorno
- osmorregulación
- mecanismo por el cual las concentraciones de agua y soluto se mantienen a los niveles deseados
- osmorregulador
- organismo que mantiene su tonicidad independientemente de su entorno
- equilibrio osmótico
- equilibrio de la cantidad de entrada y salida de agua y sal hacia y desde un sistema biológico sin perturbar la presión osmótica deseada y la concentración de soluto en cada compartimento
- presión osmótica
- presión ejercida sobre una membrana para igualar la concentración de soluto en ambos lados
- membrana semipermeable
- membrana que permite que solo ciertos solutos pasen


