2.1: Átomos
- Page ID
- 58484
Un átomo es el componente más pequeño de un elemento que conserva todas las propiedades químicas de ese elemento. Por ejemplo, un átomo de hidrógeno tiene todas las propiedades del elemento hidrógeno, tal como existe como gas a temperatura ambiente, y se une con el oxígeno para crear una molécula de agua. Los átomos de hidrógeno no se pueden descomponer en nada más pequeño sin dejar de conservar las propiedades del hidrógeno. Si un átomo de hidrógeno se descomponía en partículas subatómicas, ya no tendría las propiedades del hidrógeno.
Todos los átomos contienen protones, electrones y neutrones (Figura\(\PageIndex{1}\)). La única excepción es el hidrógeno (H), que está hecho de un protón y un electrón. Un protón es una partícula cargada positivamente que reside en el núcleo (el núcleo del átomo) de un átomo y tiene una masa de 1 y una carga de +1. Un electrón es una partícula cargada negativamente que viaja en el espacio alrededor del núcleo. En otras palabras, reside fuera del núcleo. Tiene una masa insignificante y tiene una carga de —1.
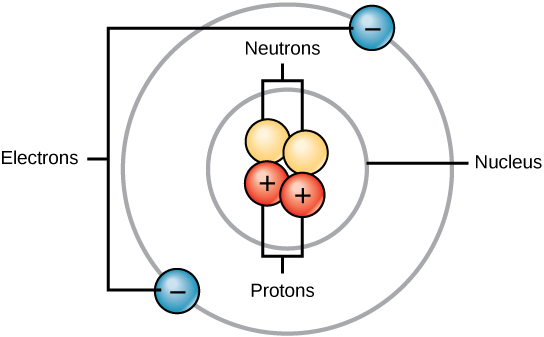
Los neutrones, al igual que los protones, residen en el núcleo de un átomo. Tienen una masa de 1 y sin cargo. Las cargas positivas (protones) y negativas (electrones) se equilibran entre sí en un átomo neutro, que tiene una carga neta cero.
Debido a que los protones y neutrones tienen cada uno una masa de 1, la masa de un átomo es igual al número de protones y neutrones de ese átomo. El número de electrones no factoriza en la masa general, porque su masa es muy pequeña.
Consulta\(\PageIndex{1}\)
En el nivel más básico, todos los organismos están hechos de una combinación de elementos. Un elemento es una sustancia cuyos átomos tienen todos el mismo número de protones. Contienen átomos que se combinan entre sí para formar moléculas. En los organismos multicelulares, como los animales, las moléculas pueden interactuar para formar células que se combinan para formar tejidos, que conforman órganos. Estas combinaciones continúan hasta que se forman organismos multicelulares enteros.
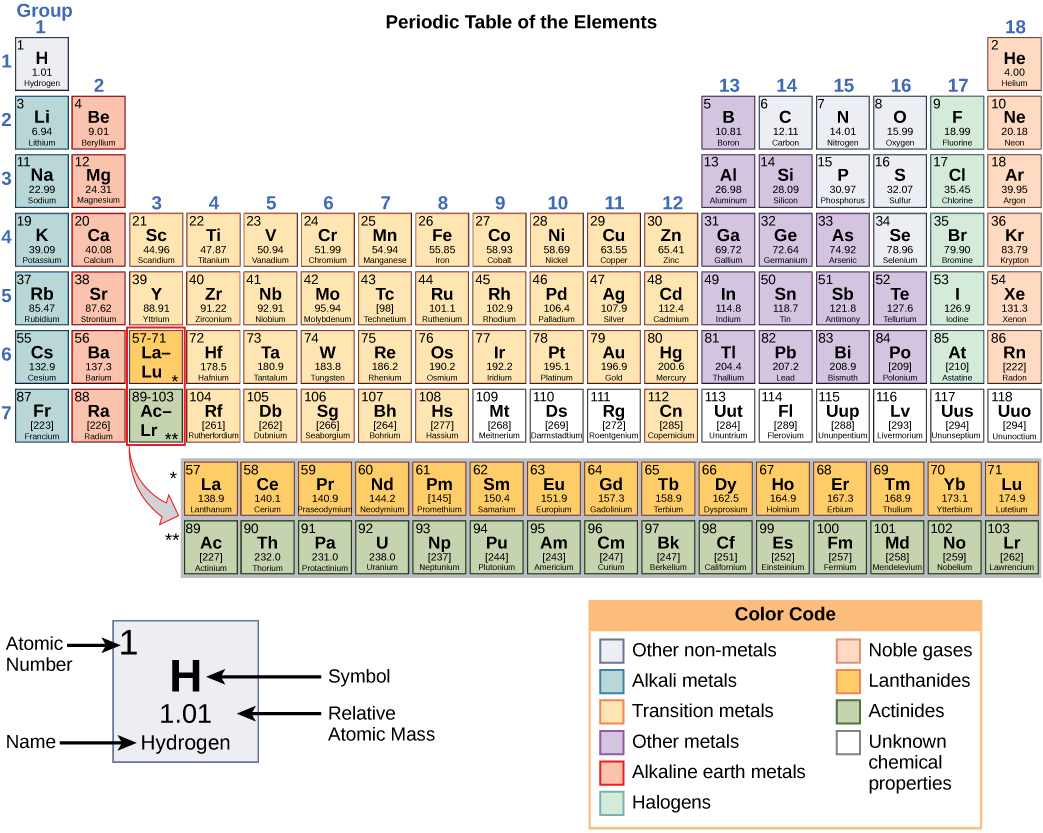
Cada elemento tiene sus propias propiedades únicas. Cada uno contiene un número diferente de protones y neutrones, dándole su propio número atómico y número másico. El número atómico de un elemento es igual al número de protones que contiene ese elemento. El número de masa, o masa atómica, es el número de protones más el número de neutrones de ese elemento. Por lo tanto, es posible determinar el número de neutrones restando el número atómico del número másico.
Estos números proporcionan información sobre los elementos y cómo reaccionarán cuando se combinen. Diferentes elementos tienen diferentes puntos de fusión y ebullición, y se encuentran en diferentes estados (líquido, sólido o gas) a temperatura ambiente. También se combinan de diferentes maneras. Algunos forman tipos específicos de bonos, mientras que otros no. La forma en que se combinan se basa en el número de electrones presentes. Debido a estas características, los elementos están dispuestos en la tabla periódica de elementos, un gráfico de los elementos que incluye el número atómico y la masa atómica relativa de cada elemento. La tabla periódica también proporciona información clave sobre las propiedades de los elementos (Figura\(\PageIndex{2}\)), a menudo indicadas por la codificación de colores. La disposición de la tabla también muestra cómo se organizan los electrones en cada elemento y proporciona detalles importantes sobre cómo reaccionarán los átomos entre sí para formar moléculas.
Los isótopos son diferentes formas del mismo elemento que tienen el mismo número de protones, pero un número diferente de neutrones. Algunos elementos, como el carbono, el potasio y el uranio, tienen isótopos naturales. El carbono-12, el isótopo más común del carbono, contiene seis protones y seis neutrones. Por lo tanto, tiene un número de masa de 12 (seis protones y seis neutrones) y un número atómico de 6 (lo que lo convierte en carbono). El Carbono-14 contiene seis protones y ocho neutrones. Por lo tanto, tiene un número de masa de 14 (seis protones y ocho neutrones) y un número atómico de 6, lo que significa que sigue siendo el elemento carbono. Estas dos formas alternas de carbono son isótopos. Algunos isótopos son inestables y perderán protones, otras partículas subatómicas o energía para formar elementos más estables. Estos se denominan isótopos radiactivos o radioisótopos.
Consulta\(\PageIndex{2}\)
Evolución en acción: Datación por carbono
El carbono-14 (14 C) es un radioisótopo natural que es creado en la atmósfera por los rayos cósmicos. Este es un proceso continuo, por lo que siempre se está creando más 14 C. A medida que se desarrolla un organismo vivo, el nivel relativo de 14 C en su cuerpo es igual a la concentración de 14 C en la atmósfera. Cuando un organismo muere, ya no está ingiriendo 14 C, por lo que la proporción disminuirá. 14 C decae a 14 N por un proceso llamado decaimiento beta; emite energía en este lento proceso.
Después de aproximadamente 5,730 años, solo la mitad de la concentración inicial de 14 C se habrá convertido a 14 N. El tiempo que tarda la mitad de la concentración original de un isótopo en descomponerse a su forma más estable se llama su vida media. Debido a que la vida media de 14 C es larga, se utiliza para envejecer objetos anteriormente vivos, como los fósiles. Utilizando la relación entre la concentración de 14 C que se encuentra en un objeto y la cantidad de 14 C detectada en la atmósfera, se puede determinar la cantidad del isótopo que aún no se ha descompuesto. Con base en esta cantidad, la edad del fósil puede calcularse a aproximadamente 50,000 años (Figura\(\PageIndex{3}\)). Los isótopos con vidas medias más largas, como el potasio-40, se utilizan para calcular las edades de los fósiles más antiguos. Mediante el uso de la datación por carbono, los científicos pueden reconstruir la ecología y biogeografía de organismos que viven en los últimos 50,000 años.

Consulta\(\PageIndex{3}\)
Referencias
A menos que se indique lo contrario, las imágenes de esta página están bajo licencia CC-BY 4.0 de OpenStax.
OpenStax, Conceptos de Biología. OpenStax CNX. marzo 22, 2017 https://cnx.org/contents/s8Hh0oOc@9....s-of-Molecules

