3.3: Proteínas
- Page ID
- 58375
Las proteínas son una de las moléculas orgánicas más abundantes en los sistemas vivos y tienen el rango de funciones más diverso de todas las macromoléculas. Las proteínas pueden ser estructurales, reguladoras, contráctiles o protectoras; pueden servir en el transporte, almacenamiento o membranas; o pueden ser toxinas o enzimas. Cada célula en un sistema vivo puede contener miles de proteínas diferentes, cada una con una función única. Sus estructuras, al igual que sus funciones, varían mucho. Todos son, sin embargo, polímeros de aminoácidos, dispuestos en una secuencia lineal y conectados entre sí por enlaces covalentes.
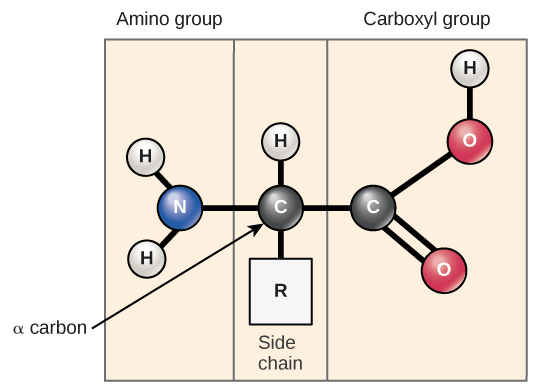
Los aminoácidos son los monómeros que componen las proteínas (Figura\(\PageIndex{1}\)). Cada aminoácido tiene la misma estructura fundamental, la cual consiste en un átomo de carbono central, también conocido como el carbono alfa (α), unido a un grupo amino (NH 2), un grupo carboxilo (COOH) y a un átomo de hidrógeno. Cada aminoácido también tiene otro átomo o grupo de átomos unidos al átomo central conocido como el grupo R.
| Función | Ejemplos | Descripción |
|---|---|---|
| Defensa | Inmunoglobulinas | Los anticuerpos se unen a partículas extrañas específicas, como virus y bacterias, para ayudar a proteger el cuerpo. |
| Enzima | Enzimas digestivas como amilasa, lipasa, pepsina, tripsina | Las enzimas llevan a cabo casi todas las miles de reacciones químicas que tienen lugar en las células. También ayudan con la formación de nuevas moléculas mediante la lectura de la información genética almacenada en el ADN. |
| Mensajero | Insulina, tiroxina | Las proteínas mensajeras, como algunos tipos de hormonas, transmiten señales para coordinar procesos biológicos entre diferentes células, tejidos y órganos. |
| Componente estructural | Actina, tubulina, queratina | Estas proteínas proporcionan estructura y soporte para las células. A mayor escala, también permiten que el cuerpo se mueva. |
| Transporte/ almacenamiento | Hemoglobina, albumina, Proteínas de almacenamiento de leguminosas, clara de huevo | Estas proteínas se unen y transportan átomos y moléculas pequeñas dentro de las células y en todo el cuerpo. Algunos proporcionan alimento en el desarrollo temprano del embrión y la plántula. |
| Contráctil | Actina, miosina | Afectar la contracción muscular. |
Es posible que hayas notado que “fuente de energía” no figuraba entre la función de las proteínas. Esto se debe a que las proteínas en nuestra dieta generalmente se descomponen en aminoácidos individuales que nuestras células luego ensamblan en nuestras propias proteínas. En realidad, los humanos son incapaces de construir algunos aminoácidos dentro de nuestras propias células —los requerimos en nuestra dieta (estos son los llamados aminoácidos “esenciales”). Nuestras células pueden digerir proteínas para liberar energía, pero generalmente solo lo harán cuando no se disponga de carbohidratos o lípidos.

Las funciones de las proteínas pueden ser muy diversas porque están compuestas por 20 aminoácidos diferentes químicamente distintos que forman cadenas largas, y los aminoácidos pueden estar en cualquier orden. La función de la proteína depende de la forma de la proteína. La forma de una proteína está determinada por el orden de los aminoácidos. Las proteínas suelen tener cientos de aminoácidos de largo y pueden tener formas muy complejas porque hay tantos órdenes posibles diferentes para los 20 aminoácidos (Figura\(\PageIndex{3}\))!
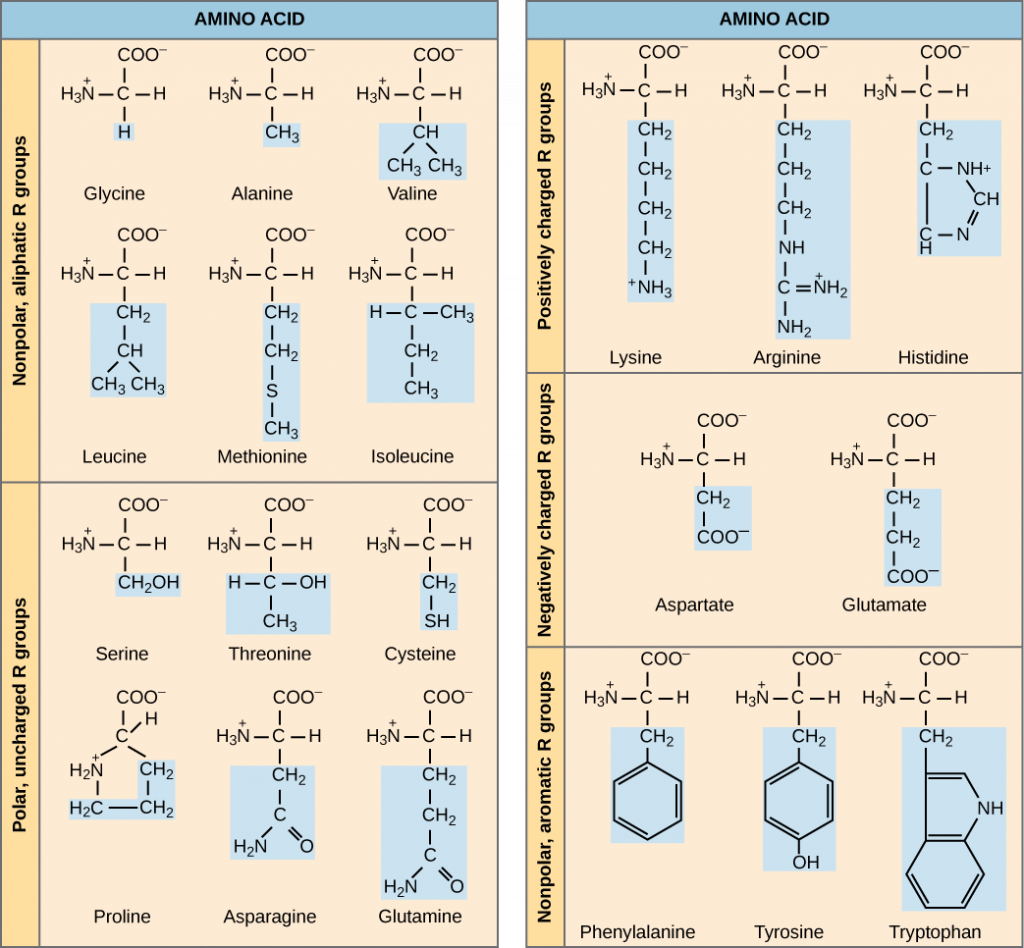
La naturaleza química de la cadena lateral determina la naturaleza del aminoácido (es decir, si es ácido, básico, polar o no polar). Por ejemplo, el aminoácido glicina tiene un átomo de hidrógeno como grupo R. Los aminoácidos como la valina, la metionina y la alanina son de naturaleza no polar o hidrófoba, mientras que los aminoácidos como la serina, la treonina y la cisteína son polares y tienen cadenas laterales hidrófilas. Las cadenas laterales de lisina y arginina están cargadas positivamente, y por lo tanto a estos aminoácidos también se les conoce como aminoácidos básicos. La prolina tiene un grupo R que está unido al grupo amino, formando una estructura similar a un anillo. La prolina es una excepción a la estructura estándar de un aminoácido ya que su grupo amino no está separado de la cadena lateral (Figura\(\PageIndex{3}\)). Los aminoácidos están representados por una sola letra mayúscula así como una abreviatura de tres letras. Por ejemplo, la valina se conoce por la letra V o el símbolo de tres letras val.
Así como algunos ácidos grasos son esenciales para una dieta, también son necesarios algunos aminoácidos. Se les conoce como aminoácidos esenciales, y en humanos incluyen isoleucina, leucina y cisteína. Los aminoácidos esenciales se refieren a los necesarios para la construcción de proteínas en el organismo, aunque no producidos por el organismo; qué aminoácidos son esenciales varía de un organismo a otro.
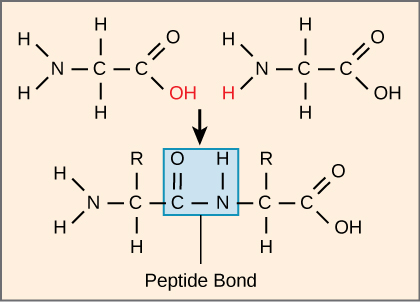
La secuencia y el número de aminoácidos determinan finalmente la forma, el tamaño y la función de la proteína. Cada aminoácido está unido a otro aminoácido por un enlace covalente, conocido como enlace peptídico, que se forma por una reacción de deshidratación. El grupo carboxilo de un aminoácido y el grupo amino del aminoácido entrante se combinan, liberando una molécula de agua. El enlace resultante es el enlace peptídico (Figura\(\PageIndex{4}\)).
Estructura proteica
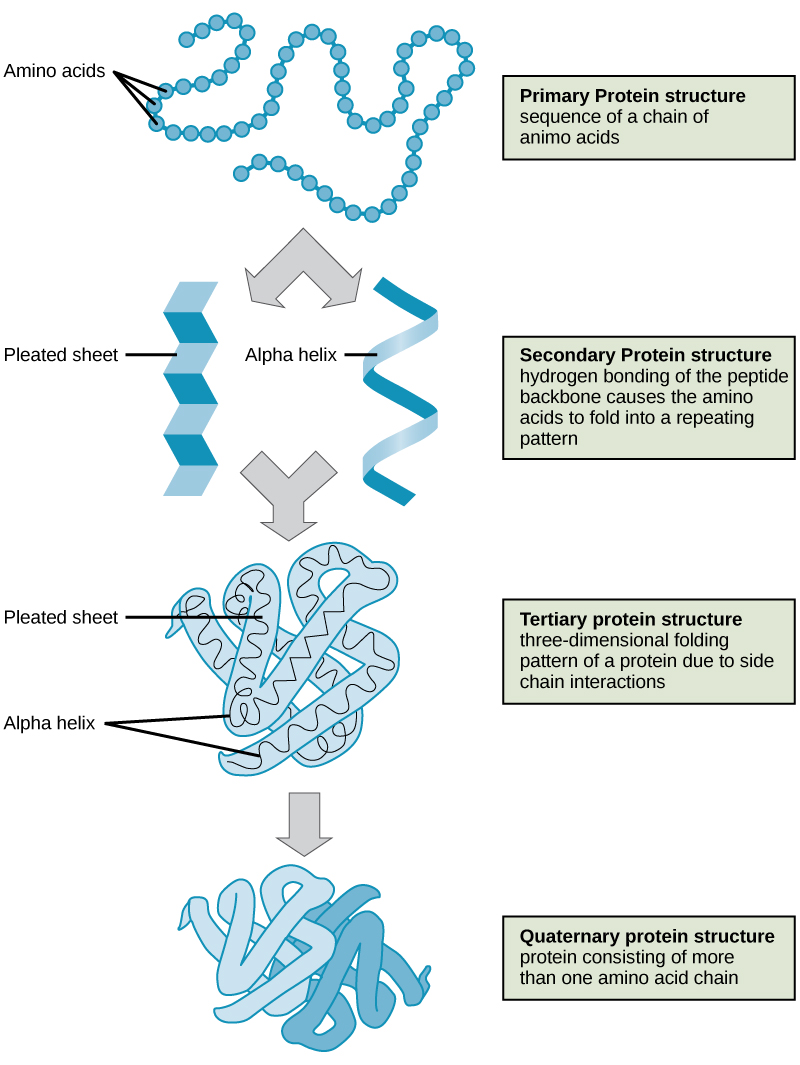
Como se discutió anteriormente, la forma de una proteína es crítica para su función. Por ejemplo, una enzima puede unirse a un sustrato específico en un sitio conocido como el sitio activo. Si este sitio activo se altera debido a cambios locales o cambios en la estructura general de la proteína, la enzima puede ser incapaz de unirse al sustrato. Para entender cómo la proteína obtiene su forma o conformación final, necesitamos comprender los cuatro niveles de estructura de la proteína: primaria, secundaria, terciaria y cuaternaria (Figura\(\PageIndex{5}\)).
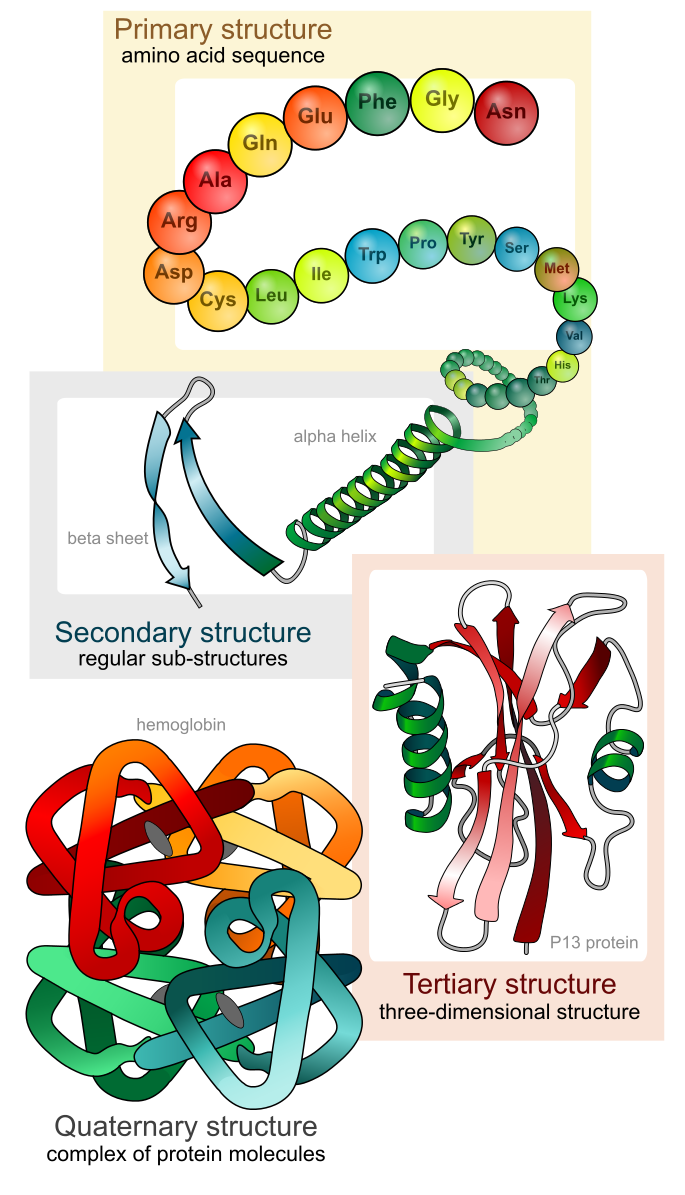
Estructura primaria
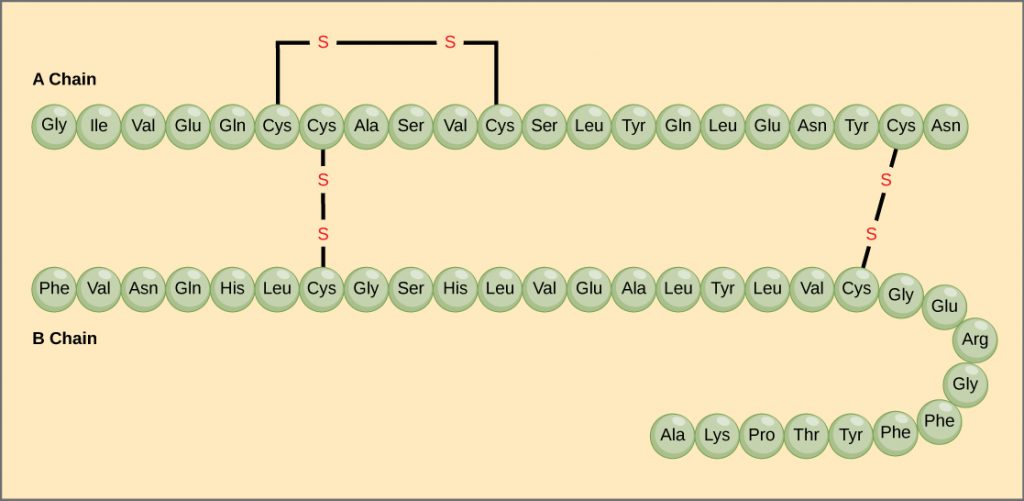
La secuencia única de aminoácidos en una cadena polipeptídica es su estructura primaria. Por ejemplo, la hormona pancreática insulina tiene dos cadenas polipeptídicas, A y B, y están unidas entre sí por enlaces disulfuro. El aminoácido N terminal de la cadena A es glicina, mientras que el aminoácido C terminal es asparagina (Figura\(\PageIndex{6}\)). Las secuencias de aminoácidos en las cadenas A y B son exclusivas de la insulina.
Estructura secundaria
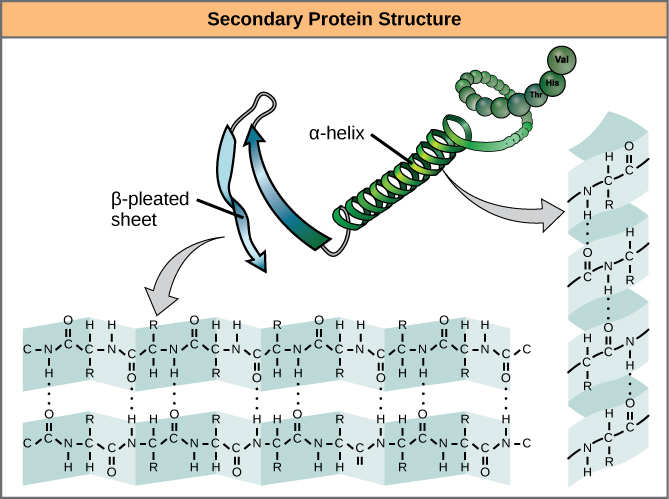
El plegamiento local del polipéptido en algunas regiones da lugar a la estructura secundaria de la proteína. Las más comunes son las estructuras de lámina α -hélice y β -plisada (Figura\(\PageIndex{7}\)). Ambas estructuras se mantienen en forma mediante enlaces de hidrógeno. Los enlaces de hidrógeno se forman entre el átomo de oxígeno en el grupo carbonilo en un aminoácido y otro aminoácido que está cuatro aminoácidos más lejos a lo largo de la cadena.
Estructura Terciaria
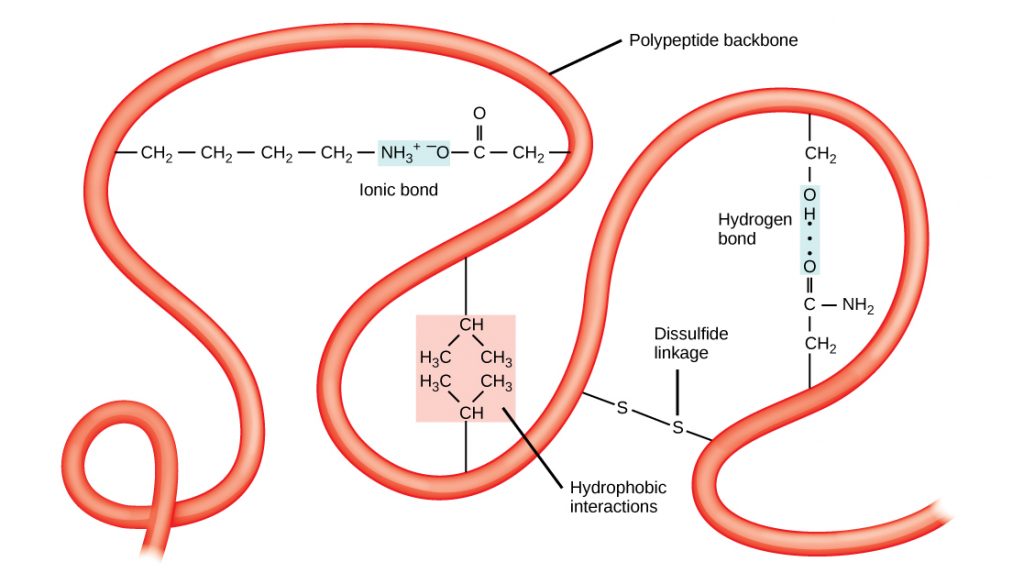
La estructura tridimensional única de un polipéptido es su estructura terciaria (Figura\(\PageIndex{8}\)). Esta estructura se debe en parte a interacciones químicas en el trabajo en la cadena polipeptídica. Principalmente, las interacciones entre los grupos R (la parte variable del aminoácido) crean la compleja estructura terciaria tridimensional de una proteína. La naturaleza de los grupos R que se encuentran en los aminoácidos involucrados puede contrarrestar la formación de los enlaces de hidrógeno descritos para las estructuras secundarias estándar. Por ejemplo, los grupos R con cargas similares son repelidos entre sí y aquellos con cargas diferentes son atraídos entre sí (enlaces iónicos). Cuando se realiza el plegamiento de proteínas, los grupos R hidrófobos de aminoácidos no polares se encuentran en el interior de la proteína, mientras que los grupos R hidrófilos se encuentran en el exterior. Los primeros tipos de interacciones también se conocen como interacciones hidrofóbicas. La interacción entre las cadenas laterales de cisteína forma enlaces disulfuro en presencia de oxígeno, el único enlace covalente que se forma durante el plegamiento de proteínas.
Estructura Cuaternaria
En la naturaleza, algunas proteínas se forman a partir de varios polipéptidos, también conocidos como subunidades, y la interacción de estas subunidades forma la estructura cuaternaria. Las interacciones débiles entre las subunidades ayudan a estabilizar la estructura general. Por ejemplo, la insulina (una proteína globular) tiene una combinación de enlaces de hidrógeno y enlaces disulfuro que hacen que se agrupe principalmente en forma de bola. La insulina comienza como un único polipéptido y pierde algunas secuencias internas en presencia de modificación postraduccional después de la formación de los enlaces disulfuro que mantienen unidas las cadenas restantes. La seda (una proteína fibrosa), sin embargo, tiene una estructura laminar plisada β que es el resultado de enlaces de hidrógeno entre diferentes cadenas.
Los cuatro niveles de estructura proteica (primaria, secundaria, terciaria y cuaternaria) se ilustran en la Figura\(\PageIndex{9}\).
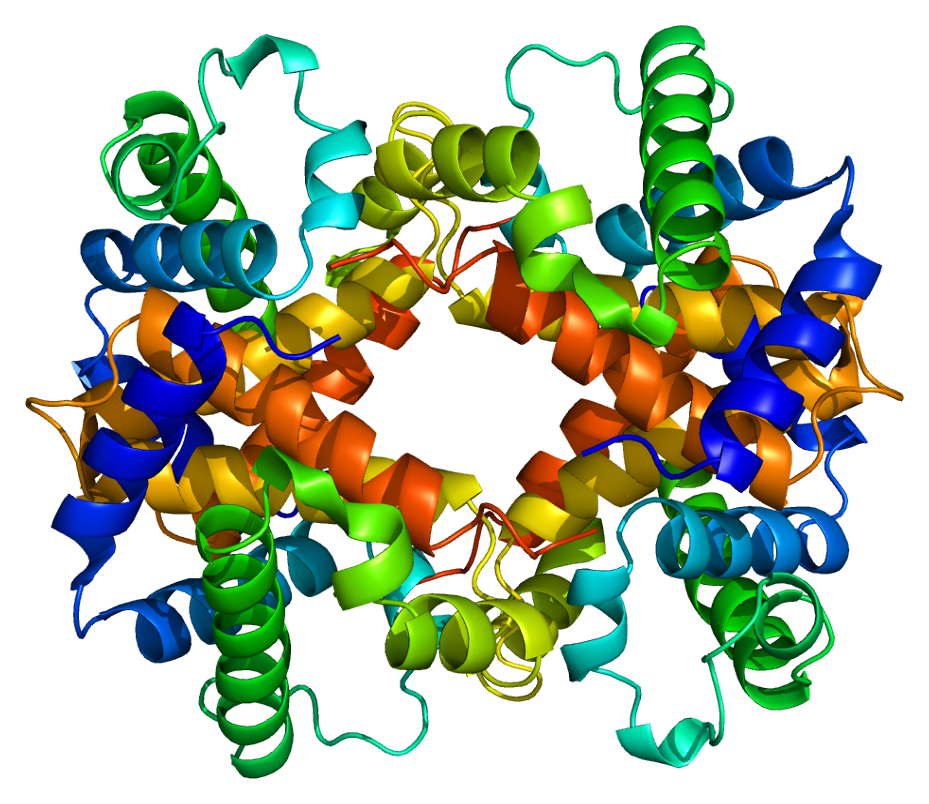
La forma única de cada proteína está determinada en última instancia por el gen que codifica la proteína. Cualquier cambio en la secuencia génica puede llevar a que se agregue un aminoácido diferente a la cadena polipeptídica, provocando un cambio en la estructura y función de la proteína. Las personas que se ven afectadas por la anemia falciforme pueden tener una variedad de problemas de salud graves, como dificultad para respirar, mareos, dolores de cabeza y dolor abdominal. En esta enfermedad, la cadena β de la hemoglobina tiene una sola sustitución de aminoácido, provocando un cambio tanto en la estructura (forma) como en la función (trabajo) de la proteína. Lo más destacable a considerar es que una molécula de hemoglobina está compuesta por unos 600 aminoácidos. La diferencia estructural entre una molécula de hemoglobina normal y una molécula de células falciformes es un solo aminoácido de los 600 (Figura\(\PageIndex{10}\)).
Desdesnaturalización y plegamiento de proteínas
Cada proteína tiene su propia secuencia y forma únicas que se mantienen unidas por interacciones químicas. Si la proteína está sujeta a cambios de temperatura, pH o exposición a productos químicos, la estructura de la proteína puede cambiar, perdiendo su forma sin perder su secuencia primaria en lo que se conoce como desnaturalización. La desnaturalización suele ser reversible porque la estructura primaria del polipéptido se conserva en el proceso si se elimina el agente desnaturalizante, permitiendo que la proteína reanude su función. A veces la desnaturalización es irreversible, lo que lleva a la pérdida de la función. Un ejemplo de desnaturalización irreversible de proteínas es cuando se fríe un huevo. La proteína de albúmina en la clara de huevo líquida se desnaturaliza cuando se coloca en una sartén caliente. No todas las proteínas se desnaturalizan a altas temperaturas; por ejemplo, las bacterias que sobreviven en las aguas termales tienen proteínas que funcionan a temperaturas cercanas a la ebullición. El estómago también es muy ácido, tiene un pH bajo y desnaturaliza las proteínas como parte del proceso de digestión; sin embargo, las enzimas digestivas del estómago retienen su actividad bajo estas condiciones.

El plegamiento de proteínas es crítico para su función. Originalmente se pensó que las propias proteínas eran las responsables del proceso de plegamiento. Solo recientemente se encontró que a menudo reciben asistencia en el proceso de plegamiento de ayudantes proteicos conocidos como chaperonas (o chaperoninas) que se asocian con la proteína diana durante el proceso de plegamiento. Actúan previniendo la agregación de polipéptidos que conforman la estructura proteica completa, y se desasocian de la proteína una vez plegada la proteína diana.
¿Cómo se relaciona la estructura proteica con la función?
Recordemos que una proteína se construye a partir de una larga cadena de aminoácidos conectados entre sí en un orden específico. El orden específico de los aminoácidos determina cómo interactuarán juntos para formar la forma 3-D de la proteína. La forma de una proteína determina su función. Por lo tanto, el orden de los aminoácidos determina la forma de la proteína, lo que determina su función.
Debido a que hay 20 aminoácidos diferentes, se pueden combinar entre sí de un número prácticamente infinito de formas. Esto significa que existe una gran cantidad de diferentes formas de proteínas que se pueden asumir en función del orden de los aminoácidos. Esto es muy importante ya que las proteínas cumplen tantas funciones diferentes dentro de las células.
Referencias
A menos que se indique lo contrario, las imágenes de esta página están bajo licencia CC-BY 4.0 de OpenStax.
OpenStax, Biología. OpenStax CNX. mayo 27, 2016 http://cnx.org/contents/s8Hh0oOc@9.10:QhGQhr4x@6/Biological-Molecules

