8.5: Receptor de tirosina quinasas (RTK)
- Page ID
- 53818
Las tirosina quinasas receptoras median las respuestas a un gran número de señales, incluyendo hormonas peptídicas como la insulina y factores de crecimiento como el factor de crecimiento epidérmico. Al igual que los GPCR, las tirosina quinasas receptoras se unen a una señal, luego pasan el mensaje a través de una serie de moléculas intracelulares, la última de las cuales actúa sobre las proteínas diana para cambiar el estado de la célula.
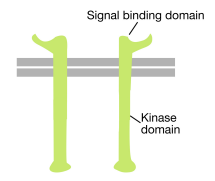
Como su nombre indica, un receptor tirosina quinasa es un receptor de superficie celular que también tiene actividad tirosina quinasa. El dominio de unión a señal del receptor tirosina quinasa está en la superficie celular, mientras que la actividad enzimática de tirosina quinasa reside en la parte citoplasmática de la proteína (ver figura anterior). Una hélice alfa transmembrana conecta estas dos regiones del receptor.
¿Qué sucede cuando las moléculas señal se unen a las tirosina quinasas receptoras?
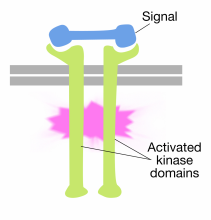
La unión de moléculas señal a los dominios extracelulares de las moléculas receptoras de tirosina quinasa provoca que dos moléculas receptoras se dimericen (se junten y se asocien). Esto acerca las colas citoplasmáticas de los receptores entre sí y provoca que se encienda la actividad tirosina quinasa de estas colas. Las colas activadas se fosforilan entre sí en varios residuos de tirosina. Esto se llama autofosforilación.
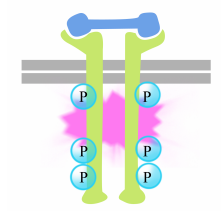
La fosforilación de tirosinas en las colas del receptor desencadena el ensamblaje de un complejo de señalización intracelular en las colas. Las tirosinas recientemente fosforiladas sirven como sitios de unión para señalizar proteínas que luego pasan el mensaje a otras proteínas. Una proteína importante que posteriormente es activada por los complejos de señalización en las tirosina quinasas receptoras se llama Ras.
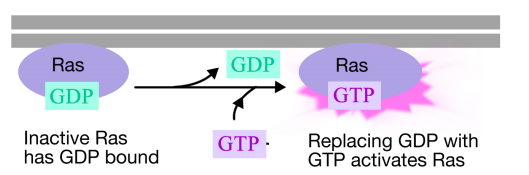
La proteína Ras es una proteína monomérica de unión a nucleótidos de guanina que se asocia con la cara citosólica de la membrana plasmática (de hecho, se parece mucho a la subunidad alfa de las proteínas G triméricas). Al igual que la subunidad alfa de una proteína G-, Ras está activo cuando GTP está unido a ella e inactivo cuando el PIB está unido a él.Además, al igual que la subunidad alfa, Ras puede hidrolizar el GTP a GDP.
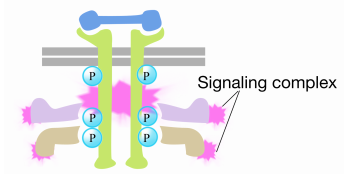
Cuando una señal llega al receptor tirosina quinasa, los monómeros del receptor se unen y fosforilan las tirosinas entre sí, desencadenando el ensamblaje de un complejo de proteínas en la cola citoplásmica del receptor. Una de las proteínas de este complejo interactúa con Ras y estimula el intercambio del PIB unido al Ras inactivo por un GTP. Esto activa el Ras.
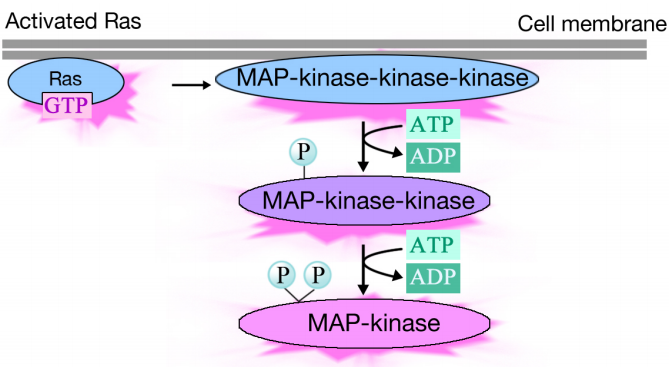
El Ras activado desencadena una cascada de fosforilación de tres proteínas quinasas, que retransmiten y distribuyen la señal. Estas proteínas quinasas son miembros de un grupo llamado MAP quinasas (Mitogen Activated Protein Kinases). La quinasa final en esta cascada fosforila diversas proteínas diana, incluyendo enzimas y activadores transcripcionales que regulan la expresión génica.
La fosforilación de diversas enzimas puede alterar sus actividades, y desencadenar nuevas reacciones químicas en la célula, mientras que la fosforilación de activadores transcripcionales puede cambiar qué genes se expresan. El efecto combinado de los cambios en la expresión génica y la actividad proteica altera el estado fisiológico de la célula.
Una vez más, al seguir la vía de transducción de señales mediada por RTK, es posible discernir el mismo patrón básico de eventos: una señal se une a los dominios extracelulares de las tirosina quinasas receptoras, dando como resultado la dimerización del receptor y la autofosforilación de las colas citosólicas, transportando así el mensaje al interior de la celda.
El mensaje se transmite a través de un complejo de señalización a Ras que luego estimula una serie de quinasas. La quinasa terminal en la cascada actúa sobre las proteínas diana y produce cambios en las actividades de las proteínas y la expresión génica.
Las descripciones anteriores proporcionan un boceto muy simple de algunas de las principales clases de receptores y tratan principalmente de los detalles mecanicistas de los pasos por los cuales las señales recibidas por diversos tipos de receptores provocan cambios en las células. Una lección importante para llevar a casa es la similitud esencial de los diferentes caminos.
Otro punto a tener en cuenta es que si bien hemos mirado cada vía individual de forma aislada, una célula, en un momento dado, recibe múltiples señales que desencadenan una variedad de respuestas diferentes a la vez. Las vías descritas anteriormente muestran un grado considerable de “conversación cruzada” y la respuesta a cualquier señal dada se ve afectada por las otras señales que recibe la célula simultáneamente. La multitud de diferentes receptores, señales y sus combinaciones son los medios por los cuales las células son capaces de responder a una enorme variedad de circunstancias diferentes.


