6.2: Cinética enzimática
- Page ID
- 57205
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Las enzimas son catalizadores proteicos, influyen en la cinética pero no en la termodinámica de una reacción
- Aumentar la velocidad de una reacción química
- No alteres el equilibrio
.png)
Figura 6.2.1: Actividad del catalizador
- Aumentan la velocidad estabilizando el estado de transición (es decir, bajando la barrera de energía para formar el estado de transición (no afectan a la energía del reactivo o reactivos o producto (s)
Derivación de Michaelis-Menten para una cinética simple en estado estacionario
La ecuación de Michaelis-Menten es un modelo matemático que se utiliza para analizar datos cinéticos simples. El modelo tiene ciertos supuestos, y siempre y cuando estos supuestos sean correctos, modelará con precisión sus datos experimentales. La derivación del modelo resaltará estos supuestos.
En una reacción catalizada por enzimas el sustrato inicialmente forma un complejo reversible con la enzima (es decir, la enzima y el sustrato tienen que interactuar para que la enzima pueda realizar su función catalítica). La expresión estándar para mostrar esto es la siguiente:
ASUNCIÓN #1:
- No hay ningún producto presente al inicio del análisis cinético
- Por lo tanto, mientras monitoreemos las velocidades de reacción iniciales podemos ignorar la reacción inversa de E+P yendo a ES
ASUNCIÓN #2:
- Durante la reacción se establece una condición de equilibrio para la unión y disociación de la Enzima y el Sustrato (supuesto Briggs-Haldane)
- Así, la tasa de formación del complejo ES es igual a la tasa de disociación más descomposición
ASUNCIÓN #3:
- [E] << [S]
- La enzima es un catalizador, no se destruye y se puede reciclar, por lo que solo se requieren pequeñas cantidades
- La cantidad de S unida a E en un momento dado es pequeña en comparación con la cantidad de S libre
- De ello se deduce que [ES] << [S] y por lo tanto [S] es constante durante el transcurso del análisis (NOTA: esta suposición requiere que la reacción sea monitoreada por un corto periodo, de manera que no se consuma mucho S y [S] no cambie efectivamente - ver siguiente suposición)
ASUNCIÓN #4:
- Solo se mide la velocidad inicial de la reacción
- [P] = 0 (se puede ignorar la reacción inversa de E + P)
- [S]” [S] inicial
ASUNCIÓN #5:
- La enzima está presente como enzima libre o como complejo ES
- [E] total = [E] + [ES]
Derivación de Michaelis-Menten usando los supuestos anteriores:
Tasa de formación de ES = k 1 [E] [S] + k -2 [E] [P]
La suposición #1 dice que podemos ignorar la reacción de k -2, por lo tanto:
Tasa de formación de ES = k 1 [E] [S]
La suposición #5 dice [E] = [E] total - [ES], por lo tanto:
Tasa de formación de ES = k 1 ([E] total - [ES]) [S]
La tasa de descomposición del ES es una combinación de la disociación y la conversión al producto:
Tasa de desglose ES = k -1 [ES] + k 2 [ES]
Tasa de desglose de ES = (k -1 + k 2) [ES]
El supuesto #2 dice que la tasa de formación de ES es igual a la tasa de desglose:
k 1 ([E] total - [ES]) [S] = (k -1 + k 2) [ES]
Reorganizar para definir en términos de constantes de tasa:
([E] total - [ES]) [S]/[ES] = (k -1 + k 2)/k 1
([E] total [S]/[ES]) - [S] = (k -1 + k 2)/k 1
Definir una nueva constante, K m = (k -1 + k 2)/k 1
([E] total [S]/[ES]) - [S] = K m
Resolver para el término [ES] (por razones que se darán en el siguiente paso):
[ES] = [E] total [S]/(K m + [S])
La velocidad de reacción real medida en cualquier momento dado viene dada por:
V = k 2 [ES]
Múltiples ambos lados de la ecuación anterior por k 2:
k 2 [ES] = k 2 [E] total [S]/(K m + [S])
por lo tanto
V = k 2 [E] total [S]/(K m + [S])
La velocidad máxima posible (Vmax) ocurre cuando todas las moléculas enzimáticas están unidas con sustrato [ES] = [E] total, así:
V máx = k 2 [E] total
Sustituir esto en la expresión anterior da:
V = V máx [S]/(K m + [S])
Esta es la expresión matemática que se utiliza para modelar sus datos cinéticos experimentales
Se conoce como la ecuación de Michaelis-Menten
Enfoque experimental
El enfoque general es agregar una concentración conocida de sustrato a la enzima y determinar la velocidad de reacción inicial para esa concentración de sustrato
- Las velocidades de reacción se dan típicamente como moles (o micromoles) de producto producido por unidad de tiempo (seg o min) por mol (o micromol) de enzima.
- El experimento se repite para una amplia gama de concentraciones de sustrato
- Se recoge una tabla de puntos de datos [S] versus V
- Estos puntos de datos se trazan (V versus S) y deben ajustarse a una curva que concuerde con la ecuación de Michaelis-Menten
Los términos V max y K m son propiedades intrínsecas de la combinación enzima/sustrato particular que está estudiando
- Se determinarán a partir de las características de la gráfica V versus S
V máx
Hay un número limitado de moléculas enzimáticas y solo pueden realizar una sola reacción a la vez. Por lo tanto, a alto [S] las enzimas pueden saturarse
- En condiciones saturantes la reacción va tan rápido como puede, y los aumentos adicionales en [S] no aumentan la velocidad de reacción.
- La tasa máxima observable es V max y los datos serán asíntotas a este valor a alta [S]
- A baja [S] la velocidad de reacción es generalmente linealmente proporcional a la [S] (es decir, a baja [S] si duplica [S] la V se duplicará)
K m
K m = (k -1 + k 2)/k 1 = (tasa de descomposición de ES)/(tasa de formación de ES)
- K m es similar, pero no exactamente igual a, una constante de disociación (K d) para el complejo ES
- Si k -1 >> k 2, entonces K m” K d
- Debido a esta similitud con la expresión para Kd, un valor bajo de Km a menudo se interpreta como una alta afinidad de la enzima por el sustrato, y un gran valor para Km a menudo se interpreta como una afinidad débil de la enzima por el sustrato.
- K m tiene unidades de concentración molar (igual que las unidades para [S])
Existe un tratamiento matemático que permite la determinación de Km a partir de los datos experimentales V versus [S]
- Considere la situación cuando el [S] que se está evaluando da como resultado un valor de V que es exactamente 1/2 de la velocidad máxima de reacción:
V = V máx [S]/(K m + [S])
1/2 V máx = V máx [S]/(K m + [S])
1/2 = [S]/(K m + [S])
K m + [S] = 2 [S]
K m = [S]
Así, K m es igual a la concentración de sustrato que da como resultado exactamente la mitad de la velocidad de reacción máxima posible
.png)
Figura 6.2.2: K m
Lineweaver-Burke (la trama del "doble recíproco")
- La ecuación de Michaelis-Menten se puede reorganizar tomando el recíproco, para producir:
.png)
- Si X = 1/ [S] e Y=1/ V entonces esta es una ecuación lineal con una pendiente de K m/V max y una intercepción Y de 1/ V max
.png)
Figura 6.2.3: 1/S y1/V
- Dado que la gráfica de 1/ [S] versus 1/v datos debe ser una línea recta, es más fácil ajustar una función lineal a los datos en esta forma, y Vmax y K m se pueden determinar fácilmente a partir de la gráfica
Inhibición Reversible
Hay dos categorías principales de inhibidores reversibles: inhibidores reversibles competitivos e inhibidores reversibles no competitivos:
Inhibidores competitivos
El inhibidor (I) compite con el sustrato (S) por el sitio activo de la enzima (también conocido como el sitio de unión a S). La unión de cualquiera de estas moléculas en el sitio activo es un evento mutuamente excluyente
- El sustrato y el inhibidor comparten un alto grado de similitud estructural. Sin embargo, el inhibidor no puede proceder a través de la reacción para producir el producto.
- Aumentar la concentración de sustrato superará al inhibidor por la unión al sitio activo de la enzima
- Un inhibidor reversible competitivo se puede identificar por sus efectos característicos sobre los datos cinéticos
La expresión de Michaelis-Menten en presencia de un inhibidor competitivo reversible es:
V = V máx [S]/(K m (1+ [I] /K i) + [S])
Donde Ki es la constante de disociación del complejo EI real
Los efectos del inhibidor competitivo reversible sobre la cinética son los siguientes:
- Si no hay inhibidor presente (es decir, si [I] = 0) entonces las ecuaciones son las mismas
- A medida que se agrega inhibidor, el efecto es modificar el valor aparente de K m. En particular, el K m aparente se incrementará en un valor igual a (1 + [I] /K I). Si se incrementa K m, la velocidad de reacción v disminuirá.
- Tenga en cuenta que como [S] se vuelve muy grande el valor del denominador es esencialmente igual a [S] y v @ v max. Por lo tanto, la velocidad de reacción puede ser conducida a vmax con una concentración de sustrato suficientemente alta
El criterio diagnóstico para la inhibición competitiva reversible es que mientras la km aparente se ve afectada por la adición del inhibidor, el valor de v max no cambia
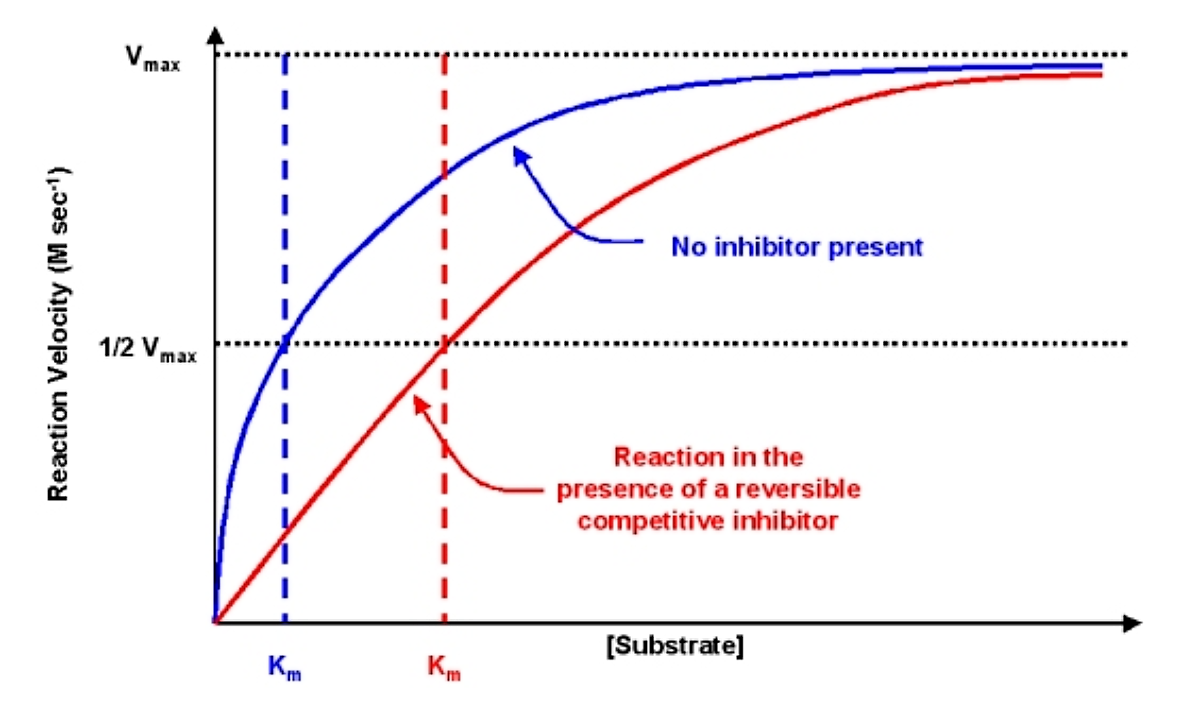.png)
Figura 6.2.4: Efecto del inhibidor competitivo reversible
¿Cómo se ve afectada la gráfica doble recíproca Lineweaver-Burke por la presencia de un inhibidor competitivo reversible?
.png)
Figura 6.2.5: Gráfica recíproca doble con inhibidor competitivo reversible
Inhibidores no competitivos
Los inhibidores no competitivos reaccionan tanto con E como con ES (esto se debe a que el inhibidor no competitivo no se une en el mismo sitio en la enzima que el sustrato)
- La inhibición no se puede superar aumentando la concentración de S
- El efecto sobre la cinética es como si la enzima fuera menos activa (v max se reduce), pero que la afinidad por el sustrato no se ve afectada (K m sigue siendo la misma) ya que el sitio de unión al sustrato no está ocupado por el inhibidor no competitivo.
.png)
Figura 6.2.6: Efecto del inhibidor reversible no competitivo
.png)
Figura 6.2.7: Gráfica recíproca doble con inhibidor no competitivo


