3.2: Enzimas
- Page ID
- 56346
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Energía y Catalizadores
En los sistemas biológicos, la energía se define aproximadamente como la capacidad de hacer trabajo. Las moléculas se mantienen unidas por electrones. Romper y construir estos vínculos requiere un aporte de energía. La energía necesaria para iniciar tales reacciones se denomina energía de activación (E A). A veces la energía necesaria para iniciar una reacción es tan grande que limita en gran medida la probabilidad de que la reacción ocurra alguna vez. Los catalizadores son sustancias químicas que participan en la facilitación de reacciones al reducir la energía de activación. Si se reduce la energía de activación, la probabilidad de que ocurra una reacción aumenta enormemente. En las células, los catalizadores suelen estar hechos de proteínas y se denominan enzimas.

Coordenada de reacción de una reacción exotérmica con y sin enzima. La enzima redujo el E A para facilitar la probabilidad de que se produzca la reacción. Esta reacción catabólica descompone las cosas complejas, aumentando así la entropía y liberando energía al sistema.
Enzimas
Los reactivos en las reacciones enzimáticas se denominan sustratos. Tienen un ajuste imperfecto a un dominio de unión de la enzima llamado sitio activo. La unión del sustrato a este sitio activo induce un cambio en la forma de la proteína que coordina el sustrato a un estado de transición que reducirá la cantidad de E A requerida para que la reacción llegue a su finalización. El ajuste inducido de la proteína también ayuda a coordinar otros cofactores o coenzimas que ayuden en la reacción.
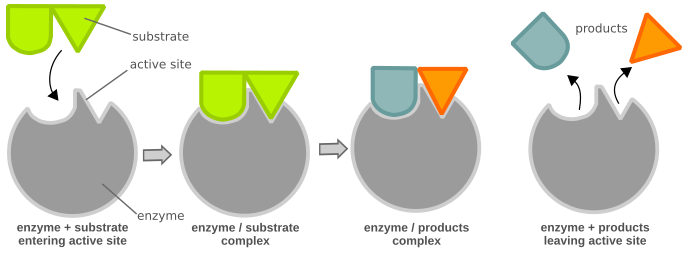
Modelo de ajuste inducido de enzimas y sustratos. El sitio activo de la proteína es una coincidencia imperfecta para el sustrato. Las interacciones intermoleculares entre la enzima y el sustrato inducen un nuevo ajuste que facilita la formación de un estado de transición y da como resultado la catálisis de la reacción.
La reacción sigue el flujo estándar donde la Enzima (E) y el Sustrato (S) interactúan para formar un Complejo Enzima-Sustrato (ES). El ES luego se disocia en Enzima y el Producto resultante (P).
E + S ⇒ ES ⇒ E + P
El ajuste inducido del complejo enzima-sustrato coordina el estado de transición para facilitar la reacción. Este ajuste inducido se produce a través de medios no covalentes que resultan en un tirón de las moléculas (una aplicación de energía) mientras que las moléculas son coaxed en las reacciones.
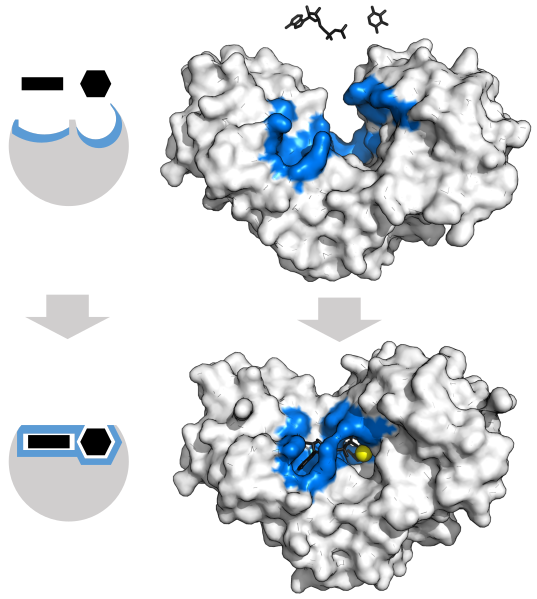
La enzima hexoquinasa interactúa con un ATP y una hexosa. Estas interacciones alteran ligeramente la estructura de la enzima (ajuste inducido). Esta atracción sobre la enzima y los sustratos ayuda a catalizar la reacción a través de la coordinación de las moléculas, a veces con la ayuda de cofactores y coenzimas. La esfera amarilla representa el cofactor Mg 2+.
Las coenzimas pueden unirse covalentemente a las cadenas laterales de aminoácidos de la enzima y también se denominan grupos protésicos. Si bien los grupos protésicos son de naturaleza orgánica, también pueden implicar la coordinación de iones metálicos, como el grupo hemo que se une al hierro. Estos grupos protésicos potencian el repertorio de los aminoácidos para proporcionar un funcionamiento adicional a toda la proteína. Las coenzimas tempranas se describieron como vitales para el funcionamiento normal y se caracterizaron como moléculas orgánicas con grupos amina. Debido a esta coincidencia, fueron referidas como vitaminas (para aminas vitales) aunque no todas las vitaminas tienen grupos amina. También se requieren los iones de metales traza que trabajan con estos grupos y representan los minerales en los alimentos.


