1.15: SDS-PAGE
- Page ID
- 55078
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivos de aprendizaje
Metas:
- Preparar muestras de proteínas a partir de células bacterianas transformadas y realizar una PAGE.
- Analizar los productos de PAGE e identificar proteínas por peso molecular.
Resultados de aprendizaje de los estudiantes:
Al finalizar este laboratorio, los estudiantes serán capaces de:
- Explique cómo funciona SDS-PAGE.
- Ejecutar y analizar los resultados de una SDS-PAGE.
Introducción
Electroforesis en gel de poliacrilamida
La electroforesis en gel de poliacrilamida (PAGE) es probablemente la técnica analítica más común utilizada para separar y caracterizar proteínas. Se polimeriza una solución de acrilamida y bisacrylamida. La acrilamida sola forma polímeros lineales. La bisacrylamida introduce entrecruzamientos entre cadenas de poliacrilamida. El 'tamaño de poro' está determinado por la relación de acrilamida a bisacrilamida, y por la concentración de acrilamida. Una alta proporción de bisacrilamida a acrilamida y una alta concentración de acrilamida causan baja movilidad electroforética. La polimerización de monómeros de acrilamida y bisacrilamida es inducida por persulfato amónico (APS), que se descompone espontáneamente para formar radicales libres. TEMED, un estabilizador de radicales libres, se incluye generalmente para promover la polimerización.
Los geles generalmente se preparan con la porción superior del gel debajo de los pocillos de muestra hecha menos densa que el resto del gel debajo que se hace intencionalmente más denso. “La parte superior se denomina “" gel apilable "” y la parte inferior se denomina “" gel corriente "” o “" gel separador "”.” El propósito del gel de apilamiento es concentrar todas las proteínas de diferentes tamaños en una zona horizontal compacta intercalándolas entre un gradiente de moléculas de glicina arriba y iones cloruro por debajo. De esta manera, la mayoría de las proteínas ingresarán al gel de resolución más denso simultáneamente antes de que comiencen a migrar hacia abajo a diferentes velocidades en función de su tamaño. De esta manera, las bandas son mucho más claras y mejor separadas para su visualización y análisis. Sin el gel apilable, las proteínas producirán un largo frotis a través del gel de resolución en lugar de bandas estrechas y distintas para que las analicemos.
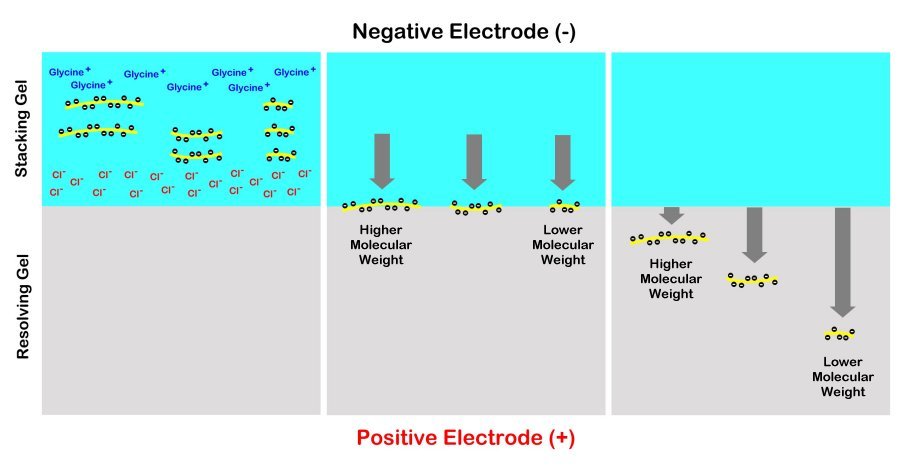
SDS-PAGE
El dodecil sulfato de sodio (SDS) es un detergente anfipático. Tiene un grupo de cabeza aniónica y una cola lipofílica. Se une no covalentemente a proteínas, donde aproximadamente una molécula de SDS es atraída por cada dos aminoácidos. El SDS hace que las proteínas se desnaturalicen y se desasocien entre sí (excluyendo la reticulación covalente) y esencialmente se desentrañen en moléculas lineales. También confiere carga negativa. En presencia de SDS, se enmasca la carga intrínseca de una proteína. Durante la SDS-PAGE, todas las proteínas migran hacia el ánodo (el electrodo cargado positivamente). Las proteínas tratadas con SDS tienen relaciones de carga a masa muy similares y formas similares. Durante la PAGE, la tasa de migración de las proteínas tratadas con SDS se determina de manera efectiva por su longitud desplegada, la cual está relacionada con su peso molecular.

Parte I: SDS-PAGE
Materiales
- Cámaras verticales de electroforesis en gel y montaje de casete de gel (Bio-Rad Mini PROTEAN)
- Buffer de funcionamiento Tris/glicina/SDS
- Fuente de alimentación
- Bio-Rad 10% prefabricados de poliacrilamida Mini PROTEAN TGX geles libres de manchas (8.6 X 6.7 cm)
- Guía de carga de gel
- Micropipetas con puntas de carga de gel
- Muestras de proteínas
- Bio-Rad 2X Laemmli Sample Buffer (contiene SDS y sacarosa o glicerol)
y 2-mercaptoetanol (reduce los enlaces disulfuro, interrumpe las reticulaciones de proteínas)
y carga de colorante - Estándares de peso molecular de proteína preteñidos (ya preparados en tampón de muestra)
Procedimiento
Preparación de Muestras
- Asegúrese de usar guantes.
- Preparar un baño de agua caliente (100°C). Colocar un poco de agua en un vaso de precipitados de 600 mL o más grande y microondas o dejar hervir en un plato caliente. (Esto puede tomar 15 minutos o más).
- Combine 10 µL de cada muestra de proteína con 20 µL de tampón de muestra Laemmli/colorante de carga en tubos de microcentrífuga etiquetados con tapa de rosca.
- Hervir las muestras por no más de 5 minutos para desnaturalizar completamente las proteínas.
- Después de hervir, dejar los tubos de muestra a temperatura ambiente hasta que estén listos para cargarlos sobre el gel.
Preparación de la Cámara de Gel y Electroforesis
- Asegúrese de usar guantes.
- Retire el gel premoldeado del empaque. Retire con cuidado la tira verde de la parte inferior del gel.
- Abra las dos abrazaderas laterales verdes en el conjunto de casete de gel vertical.
- Coloque el gel prefundido en un lado del casete y use la presa de amortiguación transparente en el otro lado del casete. Luego cierre con cuidado las abrazaderas laterales verdes.
- Inserte el casete en la cámara de gel vertical haciendo coincidir el color de los electrodos (rojo y negro) con las guías de color a los lados de la cámara.
- Llene el interior del casete con tampón 1X Tris Glycine SDS PAGE hasta que los pocillos estén sumergidos.
- Llene el fondo de la cámara de gel vertical con tampón 1X Tris Glycine SDS PAGE hasta la marca en el costado para 1 a 2 geles.
Cargando las muestras en el Gel
- Coloque la guía de carga de gel amarilla en la parte superior del casete.
- Usando puntas de carga de gel, micropipeta 10 µL de proteína preparada MW estándar en el primer (#1), quinto (#5) y último (#10) carriles
- Usando puntas de carga de gel, micropipeta 10 µL de cada muestra de proteína en cada uno de los pocillos restantes (2-4; 6-9) del gel. Anote qué muestra está en qué carril en su cuaderno.
Electroforesis
- Colocar la tapa en la cámara de gel vertical
- Inserte los cables rojo y negro en los terminales de colores que coincidan correctamente en la fuente de alimentación
- Enchufe la fuente de alimentación y encienda el interruptor de alimentación
- Seleccione “Voltaje constante” y luego ajuste el voltaje a 300 voltios
- Presiona el botón de ejecución
- Establecer un temporizador para 10 minutos
- Si la banda más pequeña del marcador proteico ha descendido hasta 1 cm desde el borde inferior del gel, apague la alimentación y detenga la carrera, de lo contrario continúe la carrera hasta que este sea el caso
- Desenchufe la fuente de alimentación y los cables de la cámara de gel
- Desmontar la cámara de gel y retirar cuidadosamente el gel
- Vierte el tampón usado en un recipiente de tampón usado — ¡No vierta por el fregadero!
- El gel ahora puede ser fotografiado en un sistema de cámara de documentación de gel o tiene que pasar por mancha/deshuesado.
Preguntas de Estudio
- ¿Qué es la SDS y por qué se agrega a una muestra de proteína antes de ejecutar una PAGE?
- ¿Por qué la proteína se calienta durante 5 minutos antes de cargarse en un gel?
- ¿Hacia qué electrodo corre una proteína en una SDS-PAGE y por qué?
- ¿Cuál es la diferencia entre un gel apilable y un gel separador?
- Dado un gel, ¿ser capaz de analizarlo usando el estándar de peso molecular?


