3.3: Introducción de ADN recombinante en la célula y replicación: Vectores
- Page ID
- 58673
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
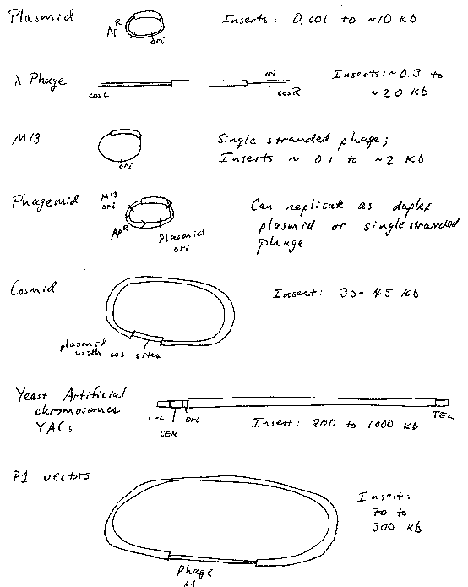
Los vectores utilizados para mover el ADN entre especies, o del banco de laboratorio a una célula viva, deben cumplir tres requisitos (Figura\(\PageIndex{1}\)):
- Deben ser moléculas de ADN replicantes autónomamente en la célula hospedadora. Los vectores más comunes están diseñados para replicarse en bacterias o levaduras, pero hay vectores para plantas, animales y otras especies.
- Deben contener un marcador seleccionable para que las células que contengan el ADN recombinante puedan distinguirse de las que no lo hacen. Un ejemplo es la farmacorresistencia en bacterias.
- Deben tener un sitio de inserción para dar cabida al ADN extraño. Por lo general, un sitio de escisión de restricción único en una región no esencial del ADN del vector. Los vectores de generación posterior tienen un conjunto de aproximadamente 15 o más sitios de escisión por restricción únicos.
Vectores plasmídicos
Los plásmidos son moléculas de ADN circulares que replican autónomamente que se encuentran en bacterias. Tienen su propio origen de replicación, y se replican independientemente de los orígenes en el cromosoma “huésped”. La replicación suele depender de las funciones del huésped, tales como las ADN polimerasas, pero la regulación de la replicación plasmídica es distinta de la del cromosoma huésped. Los plámidos, como el factor de sexo F, pueden ser muy grandes (94 kb), pero otros pueden ser pequeños (2‑4 kb). Los plásmidos no codifican una función esencial para la bacteria, lo que los distingue de los cromosomas. Los plásmidos pueden estar presentes en una sola copia, tal como F, o en múltiples copias, como los utilizados como la mayoría de los vectores de clonación, tales como pBR322, pUC y pBluescript.
En la naturaleza, los plásmidos proporcionan llevar alguna función útil, como la transferencia (F), o resistencia a antibióticos. Esto es lo que mantiene los plásmidos en una población. En ausencia de selección, los plásmidos se pierden de bacterias. Los genes de resistencia a antibióticos en los plásmidos a menudo se transportan dentro de, o se derivan de, transposones, un tipo de elemento transponible. Se trata de segmentos de ADN que son capaces de “saltar” o trasladarse a nuevas ubicaciones (Capítulo 9).
Un plásmido que fue ampliamente utilizado en muchos proyectos de ADN recombinante es pBR322 (Figura\(\PageIndex{2}\)). Se replica a partir de un origen derivado de un plásmido de resistencia a la colicina (ColE1). Este origen permite un número de copias bastante alto, alrededor de 100 copias del plásmido por célula. El plásmido pBR322 porta dos genes de resistencia a antibióticos, cada uno derivado de diferentes transposones. Estos transposones se encontraron inicialmente en factores R, los cuales son plásmidos más grandes que confieren resistencia a los antibióticos.

El uso de los genes TcR y ApR permite el cribado fácil de recombinantes que portan insertos de ADN extraño. Por ejemplo, la inserción de un fragmento de restricción en el sitio BamHI del gen TcR inactiva ese gen. Todavía se pueden seleccionar colonias ApR, y luego seleccionar para ver cuáles han perdido TcR.
Ejercicio\(\PageIndex{1}\)
¿Qué efectos sobre la farmacorresistencia se ven cuando se utilizan los sitios Eco RI o Pst I en pBR322 para insertar ADN extraño?
Una generación de vectores desarrollados después de pBR322 están diseñados para un cribado aún más eficiente para plásmidos recombinantes, es decir, aquellos que tienen ADN extraño insertado. Los plásmidos pUC (llamados para p lasmid u niversal c loning) y plásmidos derivados de ellos utilizan un cribado rápido para la inactivación del gen de la b-galactosidasa para identificar recombinantes (Figura\(\PageIndex{3}\)).
Se puede seleccionar la producción de b -galactosidasa funcional en una célula mediante el uso del sustrato cromogénico X‑gal (un indoil b -galactósido halogenado). Cuando se escinde por b‑galactosidasa, el compuesto de indoilo halogenado se libera y forma un precipitado azul. El vector pUC tiene el gen b‑galactosidasa {en realidad solo parte de él, pero suficiente para formar una enzima funcional con el resto del gen que está codificado ya sea en el cromosoma de E. coli o en un factor F'}. Cuando se introducen en E. coli, las colonias son azules en placas que contienen X‑gal.
Los múltiples sitios de clonación (sitios de restricción únicos) se encuentran en el gen de la b -galactosidasa (lacZ). Cuando se introduce un fragmento de restricción en uno o más de estos sitios, la actividad b -galactosidasa se pierde por esta mutación insercional. Así, las células que contienen plásmidos recombinantes forman colonias blancas (no azules) en placas que contienen X‑gal.
El origen de replicación es un origen de replicación ColE1 modificado que ha sido mutado para eliminar una región de control negativo. De ahí que el número de copias sea muy alto (varios cientos o más moléculas plasmídicas por célula), y se obtiene un rendimiento muy alto de ADN plasmídico a partir de cultivos de bacterias transformadas. El plásmido tiene ApR como marcador seleccionable.



