19.1: Polipéptidos y Proteínas
- Page ID
- 55468
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Defina o describa lo siguiente:
- aminoácido
- Grupo “R”
- enlace peptídico
- péptido
- polipéptido
- estructura proteica primaria
- estructura proteica secundaria
- estructura de proteína terciaria
- estructura de proteína cuaternaria
- gen
- Describir cómo la estructura primaria de una proteína o polipéptido finalmente detemina su forma tridimensional final.
- Describir cómo el orden de las bases nucleotídicas en el ADN determina finalmente la forma tridimensional final de una proteína o polipéptido.
Los aminoácidos son los bloques de construcción de las proteínas. Todos los aminoácidos contienen un grupo amino o NH 2 y un grupo carboxilo (ácido) o COOH. Hay 20 aminoácidos diferentes que se encuentran comúnmente en las proteínas y, a menudo, 300 o más aminoácidos por molécula de proteína. Cada aminoácido difiere en términos de su grupo “R”. El grupo “R” de un aminoácido es el r emainder de la molécula, es decir, la porción que no sea el grupo amino, el grupo ácido y el carbono central. Cada aminoácido diferente tiene un grupo “R” único y las propiedades químicas únicas de un aminoácido dependen de las de su grupo “R” (Figura\(\PageIndex{1}\)).

Para formar polipéptidos y proteínas, los aminoácidos se unen entre sí mediante enlaces peptídicos, en los que el amino o NH 2 de un aminoácido se une al grupo carboxilo (ácido) o COOH de otro aminoácido como se muestra en (Figura\(\PageIndex{2}\) y Figura\(\PageIndex{3}\)).

Un péptido es dos o más aminoácidos unidos entre sí por enlaces peptídicos, y un polipéptido es una cadena de muchos aminoácidos. Una proteína contiene uno o más polipéptidos. Por lo tanto, las proteínas son cadenas largas de aminoácidos que se mantienen unidas por enlaces peptídicos.
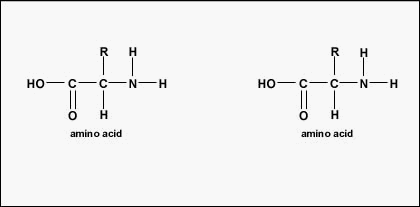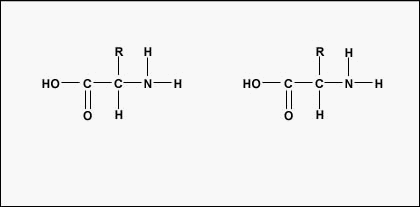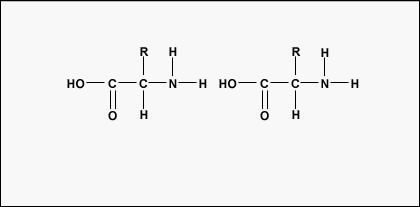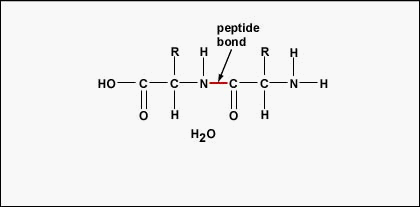
El orden real de los aminoácidos en la proteína se llama su estructura primaria (Figura\(\PageIndex{4}\)) y se determina por el ADN. Como se verá más adelante en esta unidad, el ADN se divide en unidades funcionales llamadas genes. Un gen es una secuencia de bases desoxirribonucleotídicas a lo largo de una cadena de ADN que codifica un producto funcional: una molécula específica de ARN mensajero, ARN de transferencia o ARN ribosómico. El producto suele ser ARN mensajero (ARNm) y el ARNm finalmente da como resultado la síntesis de un polipéptido o una proteína. Por lo tanto, comúnmente se dice que el orden de las bases de desoxirribonucleótidos en un gen determina la secuencia de aminoácidos de una proteína particular. Dado que ciertos aminoácidos pueden interactuar con otros aminoácidos de la misma proteína, esta estructura primaria determina en última instancia la forma final y por lo tanto las propiedades químicas y físicas de la proteína.

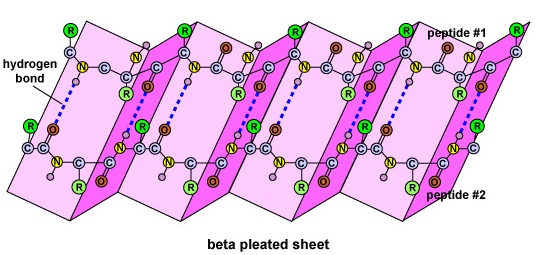
La estructura secundaria de la proteína se debe a los enlaces de hidrógeno que se forman entre el átomo de oxígeno de un aminoácido y el átomo de nitrógeno de otro. Esto le da a la proteína o polipéptido la forma bidimensional de una hélice alfa o una lámina plegada beta (Figura\(\PageIndex{5}\)).
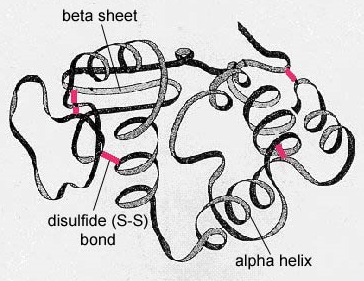
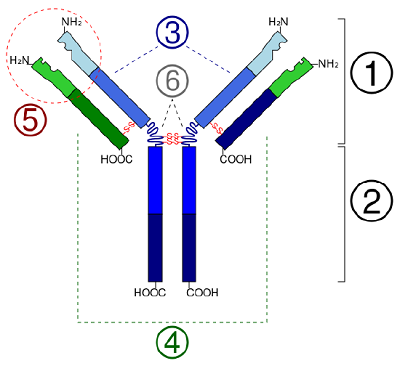
En las proteínas globulares como las enzimas, la cadena larga de aminoácidos se pliega en una forma funcional tridimensional o estructura terciaria. Esto se debe a que ciertos aminoácidos con grupos sulfhidrilo o SH forman enlaces disulfuro (S-S) con otros aminoácidos de la misma cadena. Otras interacciones entre grupos R de aminoácidos como enlaces de hidrógeno, enlaces iónicos, enlaces covalentes e interacciones hidrófobas también contribuyen a la estructura terciaria (Figura\(\PageIndex{6}\)). En algunas proteínas, como las moléculas de anticuerpos y la hemoglobina, varios polipéptidos pueden unirse entre sí para formar una estructura cuaternaria (Figura\(\PageIndex{7}\)).
Como se verá más adelante en esta unidad, durante la síntesis de proteínas, el orden de las bases nucleotídicas a lo largo de un gen se transcribe en una cadena complementaria de ARNm que luego es traducida por el ARNt al orden correcto de aminoácidos para ese polipéptido o proteína. Por lo tanto, el orden de las bases de desoxirribonucleótidos a lo largo del ADN determina el orden de los aminoácidos en las proteínas. Debido a que ciertos aminoácidos pueden interactuar con otros aminoácidos, el orden de los aminoácidos para cada proteína determina su forma tridimensional final, lo que a su vez determina la función de esa proteína (por ejemplo, con qué sustrato reaccionará una enzima, con qué epítopos se combinará el Fab de un anticuerpo, a qué receptores se unirá una citocina).
Resumen
- Los aminoácidos son los bloques de construcción de las proteínas. Hay 20 aminoácidos diferentes que se encuentran comúnmente en las proteínas y, a menudo, 300 o más aminoácidos por molécula de proteína.
- Todos los aminoácidos contienen un grupo amino o NH 2 y un grupo carboxilo (ácido) o COOH.
- Para formar polipéptidos y proteínas, los aminoácidos se unen entre sí mediante enlaces peptídicos, en los que el amino o NH 2 de un aminoácido se une al grupo carboxilo (ácido) o COOH de otro aminoácido.
- Un péptido es dos o más aminoácidos unidos entre sí por enlaces peptídicos; un polipéptido es una cadena de muchos aminoácidos; y una proteína contiene uno o más polipéptidos. Por lo tanto, las proteínas son cadenas largas de aminoácidos que se mantienen unidas por enlaces peptídicos.
- El orden real de los aminoácidos en la proteína se llama su estructura primaria y está determinado por el ADN.
- El orden de las bases de desoxirribonucleótidos en un gen determina la secuencia de aminoácidos de una proteína particular. Dado que ciertos aminoácidos pueden interactuar con otros aminoácidos de la misma proteína, esta estructura primaria determina en última instancia la forma final y por lo tanto las propiedades químicas y físicas de la proteína.
- La estructura secundaria de la proteína se debe a los enlaces de hidrógeno que se forman entre el átomo de oxígeno de un aminoácido y el átomo de nitrógeno de otro y le da a la proteína o polipéptido la forma bidimensional de una hélice alfa o una lámina plegada beta.
- En las proteínas globulares como las enzimas, la cadena larga de aminoácidos se pliega en una forma funcional tridimensional o estructura terciaria. Esto se debe a que ciertos aminoácidos con grupos sulfhidrilo o SH forman enlaces disulfuro (S-S) con otros aminoácidos de la misma cadena. Otras interacciones entre grupos R de aminoácidos como enlaces de hidrógeno, enlaces iónicos, enlaces covalentes e interacciones hidrófobas también contribuyen a la estructura terciaria.
- En algunas proteínas, como las moléculas de anticuerpos, varios polipéptidos pueden unirse entre sí para formar una estructura cuaternaria.


