13.3: Uso de Productos Químicos para Controlar Microorganismos
- Page ID
- 54372
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Comprender y comparar diversos productos químicos utilizados para controlar el crecimiento microbiano, incluidos sus usos, ventajas y desventajas, estructura química y modo de acción
Además de los métodos físicos de control microbiano, también se utilizan químicos para controlar el crecimiento microbiano. Una amplia variedad de productos químicos pueden ser utilizados como desinfectantes o antisépticos. Al elegir cuál usar, es importante considerar el tipo de microbio al que se dirige; qué tan limpio debe estar el artículo; el efecto del desinfectante en la integridad del artículo; su seguridad para los animales, los humanos y el medio ambiente; su gasto; y su facilidad de uso. En esta sección se describe la variedad de químicos utilizados como desinfectantes y antisépticos, incluyendo sus mecanismos de acción y usos comunes.
Fenólicos
En la década de 1800, los científicos comenzaron a experimentar con una variedad de productos químicos para la desinfección. En la década de 1860, el cirujano británico Joseph Lister (1827—1912) comenzó a utilizar el ácido carbólico, conocido como fenol, como desinfectante para el tratamiento de heridas quirúrgicas (ver Fundamentos de la Teoría Celular Moderna). En 1879, la obra de Lister inspiró al químico estadounidense Joseph Lawrence (1836—1909) a desarrollar Listerine, una mezcla a base de alcohol de varios compuestos relacionados que todavía se usa hoy en día como antiséptico oral. Hoy en día, el ácido carbólico ya no se usa como desinfectante quirúrgico porque es un irritante de la piel, sino que los compuestos químicos que se encuentran en los enjuagues bucales antisépticos y las pastillas para la garganta se llaman fenólicos.
Químicamente, el fenol consiste en un anillo de benceno con un grupo —OH, y los fenólicos son compuestos que tienen este grupo como parte de su estructura química (Figura\(\PageIndex{1}\)). Fenólicos como el timol y el eucaliptol se presentan de forma natural en las plantas. Otros fenólicos pueden derivarse de la creosota, un componente del alquitrán de hulla. Los fenólicos tienden a ser estables, persistentes en las superficies y menos tóxicos que el fenol. Inhiben el crecimiento microbiano desnaturalizando proteínas y alterando membranas.
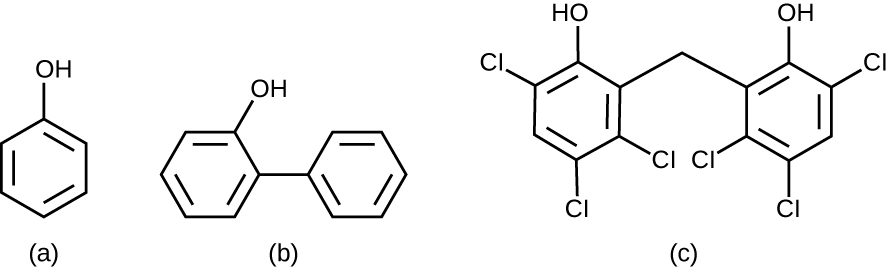
Desde la época de Lister, se han utilizado varios compuestos fenólicos para controlar el crecimiento microbiano. Fenólicos como cresoles (fenoles metilados) y o-fenilfenol fueron ingredientes activos en diversas formulaciones de Lysol desde su invención en 1889. El o-fenilfenol también se usó comúnmente en la agricultura para controlar el crecimiento bacteriano y fúngico en cultivos cosechados, especialmente cítricos, pero su uso en los Estados Unidos Estados es ahora mucho más limitado. El bisfenol hexaclorofeno, un desinfectante, es el ingrediente activo de PhisoHex, un detergente limpiador tópico ampliamente utilizado para el lavado de manos en entornos hospitalarios. PhisoHex es particularmente efectivo contra bacterias grampositivas, incluidas las que causan infecciones cutáneas estafilocócicas y estreptocócicas. PhisoHex antiguamente se usaba para bañar bebés, pero esta práctica ha sido discontinuada porque se ha demostrado que la exposición al hexaclorofeno puede conducir a problemas neurológicos.
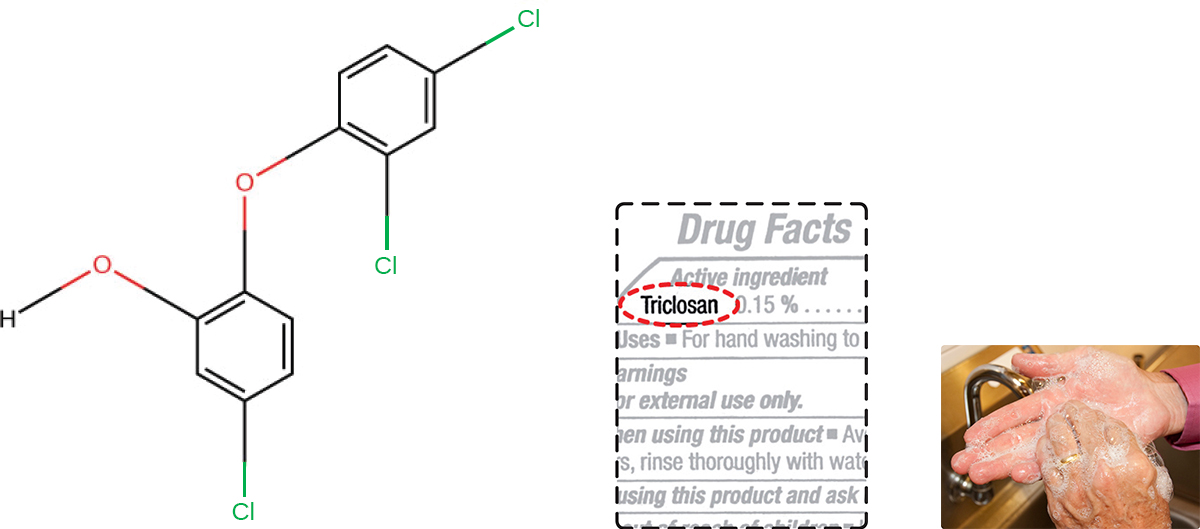
El triclosán es otro compuesto de bisfenol que ha tenido una amplia aplicación en productos antibacterianos en las últimas décadas. Inicialmente utilizado en pastas dentales, el triclosán ahora se usa comúnmente en jabones de mano y con frecuencia se impregna en una amplia variedad de otros productos, incluyendo tablas de cortar, cuchillos, cortinas de ducha, ropa y concreto, para hacerlos antimicrobianos. Es particularmente eficaz contra bacterias grampositivas en la piel, así como ciertas bacterias gramnegativas y levaduras. 1
Triclosán: ¿Overkill antibacteriano?
Los jabones de mano y otros productos de limpieza a menudo se comercializan como “antibacterianos”, lo que sugiere que proporcionan un nivel de limpieza superior al de los jabones y limpiadores convencionales. Pero, ¿los ingredientes antibacterianos en estos productos son realmente seguros y efectivos?
Alrededor del 75% de los jabones líquidos antibacterianos para manos y el 30% de los jabones en barra contienen el triclosán químico, un fenólico, (Figura\(\PageIndex{2}\)). 2 El triclosán bloquea una enzima en la vía de biosíntesis de ácidos grasos bacterianos que no se encuentra en la vía humana comparable. Aunque el uso de triclosán en el hogar aumentó dramáticamente durante la década de 1990, más de 40 años de investigación por parte de la FDA no han arrojado evidencia concluyente de que el lavado con productos que contienen triclosán brinde mayores beneficios para la salud en comparación con el lavado con jabón tradicional. Aunque algunos estudios indican que pueden quedar menos bacterias en las manos de una persona después de lavarse con jabón a base de triclosán, en comparación con el jabón tradicional, ninguna evidencia apunta a ninguna reducción en la transmisión de bacterias que causan enfermedades respiratorias y gastrointestinales. En definitiva, los jabones con triclosán pueden eliminar o matar algunos gérmenes más pero no lo suficiente para reducir la propagación de la enfermedad.
Quizás más inquietante, han salido a la luz algunos riesgos claros asociados con los jabones a base de triclosán. El uso generalizado de triclosán ha llevado a un aumento de cepas bacterianas resistentes al triclosán, incluyendo las de importancia clínica, como la Salmonella enterica; esta resistencia puede hacer que el triclosán sea inútil como antibacteriano a largo plazo. 3 4 Las bacterias pueden ganar fácilmente resistencia al triclosán a través de un cambio en un solo gen que codifica la enzima diana en la ruta de síntesis de ácidos grasos bacterianos. Otros desinfectantes con un modo de acción menos específico son mucho menos propensos a generar resistencia porque requeriría mucho más que un solo cambio genético.
El uso de triclosán en las últimas décadas también ha llevado a una acumulación de la sustancia química en el medio ambiente. El triclosán en jabón de manos se introduce directamente en los sistemas de aguas residuales y alcantarillado como resultado del proceso de lavado de manos. Allí, sus propiedades antibacterianas pueden inhibir o matar a las bacterias responsables de la descomposición de las aguas residuales, haciendo que los sistemas sépticos se obstruyan y vuelvan a funcionar. Finalmente, el triclosán en las aguas residuales encuentra su camino en aguas superficiales, arroyos, lagos, sedimentos y suelos, alterando las poblaciones naturales de bacterias que llevan a cabo importantes funciones ambientales, como la inhibición de algas. El triclosán también encuentra su camino en los cuerpos de anfibios y peces, donde puede actuar como un disruptor endocrino. También se han encontrado niveles detectables de triclosán en diversos fluidos corporales humanos, incluyendo la leche materna, el plasma y la orina. 5 De hecho, un estudio realizado por los CDC encontró niveles detectables de triclosán en la orina del 75% de las 2 mil 517 personas evaluadas en 2003-2004. 6 Este hallazgo es aún más preocupante dada la evidencia de que el triclosán puede afectar la función inmune en humanos. 7
En diciembre de 2013, la FDA entregó a los fabricantes de jabón hasta 2016 para demostrar que los jabones antibacterianos brindan un beneficio significativo sobre los jabones tradicionales; si no pueden hacerlo, los fabricantes se verán obligados a retirar estos productos del mercado.
Ejercicio\(\PageIndex{1}\)
¿Por qué el triclosán se parece más a un antibiótico que a un desinfectante tradicional?
Metales Pesados
Algunos de los primeros desinfectantes químicos y antisépticos que se utilizaron fueron los metales pesados. Los metales pesados matan microbios al unirse a proteínas, inhibiendo así la actividad enzimática (Figura\(\PageIndex{3}\)). Los metales pesados son oligodinámicos, lo que significa que concentraciones muy pequeñas muestran una actividad antimicrobiana significativa. Los iones de metales pesados se unen fuertemente a los aminoácidos que contienen azufre y se bioacumulan dentro de las células, permitiendo que estos metales alcancen altas concentraciones localizadas. Esto hace que las proteínas se desnaturalizen.
Los metales pesados no son selectivamente tóxicos para las células microbianas. También pueden bioacumularse en células humanas o animales, y concentraciones excesivas pueden tener efectos tóxicos en los humanos. Si se acumula demasiada plata en el cuerpo, por ejemplo, puede resultar en una condición llamada argiria, en la que la piel se vuelve irreversiblemente azul-gris. Una forma de reducir la toxicidad potencial de los metales pesados es controlando cuidadosamente la duración de la exposición y la concentración del metal pesado.

Mercurio
El mercurio es un ejemplo de un metal pesado que se ha utilizado durante muchos años para controlar el crecimiento microbiano. Se utilizó durante muchos siglos para tratar la sífilis. Los compuestos de mercurio como el cloruro mercúrico son principalmente bacteriostáticos y tienen un espectro de actividad muy amplio. Diversas formas de mercurio se unen a aminoácidos que contienen azufre dentro de las proteínas, inhibiendo sus funciones.
En las últimas décadas, el uso de dichos compuestos ha disminuido debido a la toxicidad del mercurio. Es tóxico para los sistemas nervioso central, digestivo y renal a altas concentraciones, y tiene efectos ambientales negativos, incluida la bioacumulación en peces. Los antisépticos tópicos como el mercurocromo, que contiene mercurio en bajas concentraciones, y el mertiolato, una tintura (una solución de mercurio disuelto en alcohol) alguna vez fueron utilizados comúnmente. Sin embargo, debido a las preocupaciones sobre el uso de compuestos de mercurio, estos antisépticos ya no se venden en Estados Unidos.
Plata
La plata se ha utilizado durante mucho tiempo como antiséptico. En la antigüedad, el agua potable se almacenaba en jarras de plata. 8 La crema Silvadene se usa comúnmente para tratar heridas tópicas y es particularmente útil para prevenir infecciones en heridas por quemaduras. Las gotas de nitrato de plata alguna vez se aplicaron rutinariamente en los ojos de los recién nacidos para proteger contra la oftalmia neonatoria, infecciones oculares que pueden ocurrir debido a la exposición a patógenos en el canal de parto, pero las cremas antibióticas se usan con mayor frecuencia en la actualidad. La plata a menudo se combina con antibióticos, lo que hace que los antibióticos sean miles de veces más efectivos. 9 La plata también se incorpora comúnmente a catéteres y vendajes, haciéndolos antimicrobianos; sin embargo, hay evidencia de que los metales pesados también pueden mejorar la selección de resistencia a antibióticos. 10
Cobre, Níquel y Zinc
Varios otros metales pesados también exhiben actividad antimicrobiana. El sulfato de cobre es un algicida común utilizado para controlar el crecimiento de algas en piscinas y peceras. El uso de cobre metálico para minimizar el crecimiento microbiano también se está extendiendo. Los forros de cobre en las incubadoras ayudan a reducir la contaminación de los cultivos celulares. Se está investigando el uso de macetas de cobre para el almacenamiento de agua en países subdesarrollados como una forma de combatir las enfermedades diarreicas. Los recubrimientos de cobre también se están volviendo populares para objetos que se manejan con frecuencia, como pomos de puertas, herrajes de gabinetes y otros accesorios en instalaciones de atención médica en un intento de reducir la propagación de microbios.
Los recubrimientos de níquel y zinc ahora se están utilizando de manera similar. Otras formas de zinc, incluyendo el cloruro de zinc y el óxido de zinc, también se utilizan comercialmente. El cloruro de zinc es bastante seguro para los humanos y se encuentra comúnmente en los enjuagues bucales, aumentando sustancialmente su duración de efectividad. El óxido de zinc se encuentra en una variedad de productos, incluyendo cremas antisépticas tópicas como loción de calamina, ungüentos para pañales, polvos para bebés y champús para la caspa.
Ejercicio\(\PageIndex{2}\)
¿Por qué muchos metales pesados son antimicrobianos y tóxicos para los humanos?
Halogenos
Otros productos químicos comúnmente utilizados para la desinfección son los halógenos yodo, cloro y flúor. El yodo actúa oxidando componentes celulares, incluyendo aminoácidos, nucleótidos y ácidos grasos que contienen azufre, y desestabilizando las macromoléculas que contienen estas moléculas. A menudo se usa como tintura tópica, pero puede causar manchas o irritación de la piel. Un yodóforo es un compuesto de yodo complejado con una molécula orgánica, aumentando así la estabilidad del yodo y, a su vez, su eficacia. Un yodóforo común es la povidona-yodo, que incluye un agente humectante que libera yodo de manera relativamente lenta. Betadine es una marca de povidona-yodo comúnmente utilizada como exfoliante de manos por el personal médico antes de la cirugía y para la antisepsia tópica de la piel de un paciente antes de la incisión (Figura\(\PageIndex{4}\)).
El cloro es otro halógeno comúnmente utilizado para la desinfección. Cuando el gas cloro se mezcla con agua, produce un oxidante fuerte llamado ácido hipocloroso, el cual se descarga y entra en las celdas fácilmente. El gas cloro se usa comúnmente en plantas municipales de agua potable y tratamiento de aguas residuales, con el ácido hipocloroso resultante produciendo el efecto antimicrobiano real. Quienes trabajan en instalaciones de tratamiento de agua deben tener mucho cuidado para minimizar la exposición personal al gas cloro. El hipoclorito de sodio es el componente químico del blanqueador doméstico común, y también se usa para una amplia variedad de propósitos desinfectantes. Las sales de hipoclorito, incluidos los hipocloritos de sodio y calcio, se utilizan para desinfectar las piscinas. El gas cloro, el hipoclorito de sodio y el hipoclorito de calcio también son desinfectantes de uso común en las industrias de procesamiento de alimentos y restaurantes para reducir la propagación de enfermedades transmitidas por los alimentos. Los trabajadores de estas industrias también deben tener cuidado de usar estos productos correctamente para garantizar su propia seguridad así como la seguridad de los consumidores. Una reciente declaración conjunta publicada por la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) y la OMS indicó que ninguno de los muchos usos benéficos de los productos de cloro en la elaboración de alimentos para reducir la propagación de enfermedades transmitidas por los alimentos planteaba riesgos para los consumidores. 11
Otra clase de compuestos clorados llamados cloraminas son ampliamente utilizados como desinfectantes. Las cloraminas son relativamente estables, liberando cloro durante largos periodos de tiempo. Las cloraminas son derivados del amoníaco por sustitución de uno, dos o los tres átomos de hidrógeno por átomos de cloro (Figura\(\PageIndex{5}\)).
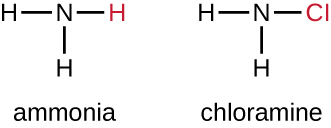
Las cloraminas y otros compuestos de colorina pueden usarse para la desinfección del agua potable, y las tabletas de cloramina son utilizadas frecuentemente por los militares para este propósito. Después de un desastre natural u otro evento que comprometa el suministro público de agua, los CDC recomiendan desinfectar el agua del grifo agregando pequeñas cantidades de lejía doméstica regular. Investigaciones recientes sugieren que el dicloroisocianurato de sodio (NaDCC) también puede ser una buena alternativa para la desinfección del agua potable. Actualmente, las tabletas NaDCC están disponibles para uso general y para uso por militares, campistas, o aquellos con necesidades de emergencia; para estos usos, el NaDCC es preferible a las tabletas de cloramina. El dióxido de cloro, un agente gaseoso utilizado para la fumigación y esterilización de áreas cerradas, también se usa comúnmente para la desinfección del agua.
Aunque los compuestos clorados son desinfectantes relativamente efectivos, tienen sus desventajas. Algunos pueden irritar la piel, la nariz u ojos de algunos individuos, y es posible que no eliminen por completo ciertos organismos resistentes del agua potable contaminada. El hongo Cryptosporidium, por ejemplo, tiene una capa exterior protectora que lo hace resistente a desinfectantes clorados. Por lo tanto, se recomienda hervir el agua potable en situaciones de emergencia cuando sea posible.
También se sabe que el flúor halógeno tiene propiedades antimicrobianas que contribuyen a la prevención de la caries dental (caries). 12 El fluoruro es el principal ingrediente activo de la pasta dental y también se agrega comúnmente al agua del grifo para ayudar a las comunidades a mantener la salud bucal. Químicamente, el fluoruro puede incorporarse a la hidroxiapatita del esmalte dental, haciéndola más resistente a los ácidos corrosivos producidos por la fermentación de microbios orales. El fluoruro también mejora la absorción de iones calcio y fosfato en el esmalte dental, promoviendo la remineralización. Además de fortalecer el esmalte, el fluoruro también parece ser bacteriostático. Se acumula en bacterias formadoras de placas, interfiriendo con su metabolismo y reduciendo su producción de los ácidos que contribuyen a la caries dental.
Ejercicio\(\PageIndex{3}\)
¿Cuál es el beneficio de una cloramina sobre hipoclorito para desinfectar?
Alcoholes
Los alcoholes constituyen otro grupo de químicos comúnmente utilizados como desinfectantes y antisépticos. Funcionan desnaturalizando rápidamente las proteínas, lo que inhibe el metabolismo celular, y al alterar las membranas, lo que conduce a la lisis celular. Una vez desnaturalizadas, las proteínas pueden replegarse potencialmente si hay suficiente agua en la solución. Los alcoholes se utilizan típicamente a concentraciones de aproximadamente 70% de solución acuosa y, de hecho, funcionan mejor en soluciones acuosas que en soluciones de alcohol al 100%. Esto se debe a que los alcoholes coagulan las proteínas. En concentraciones mayores de alcohol, la rápida coagulación de las proteínas superficiales impide la penetración efectiva de las células. Los alcoholes más utilizados para la desinfección son el alcohol etílico (etanol) y el alcohol isopropílico (isopropanol, alcohol para frotar) (Figura\(\PageIndex{6}\)).
Los alcoholes tienden a ser bactericidas y fungicidas, pero también pueden ser viricidas solo para virus envueltos. Aunque los alcoholes no son esporicidas, sí inhiben los procesos de esporulación y germinación. Los alcoholes son volátiles y se secan rápidamente, pero también pueden causar irritación de la piel porque deshidratan la piel en el sitio de aplicación. Un uso clínico común de los alcoholes es limpiar la piel para desgerminar antes de la inyección con aguja. Los alcoholes también son los ingredientes activos de los desinfectantes de manos instantáneos, que han ganado popularidad en los últimos años. El alcohol en estos desinfectantes de manos funciona tanto al desnaturalizar las proteínas como al alterar la membrana celular microbiana, pero no funcionará de manera efectiva en presencia de suciedad visible.
Por último, los alcoholes se utilizan para hacer tinturas con otros antisépticos, como las tinturas de yodo discutidas anteriormente en este capítulo. Con todo, los alcoholes son económicos y bastante efectivos para la desinfección de una amplia gama de microbios vegetativos. Sin embargo, una desventaja de los alcoholes es su alta volatilidad, limitando su efectividad a inmediatamente después de la aplicación.

Ejercicio\(\PageIndex{4}\)
- Nombrar al menos tres ventajas de los alcoholes como desinfectantes.
- Describir varias aplicaciones específicas de alcoholes utilizados en productos desinfectantes.
Tensioactivos
Los agentes tensioactivos, o surfactantes, son un grupo de compuestos químicos que disminuyen la tensión superficial del agua. Los surfactantes son los principales ingredientes en jabones y detergentes. Los jabones son sales de ácidos grasos de cadena larga y tienen regiones tanto polares como no polares, lo que les permite interactuar con regiones polares y no polares en otras moléculas (Figura\(\PageIndex{7}\)). Pueden interactuar con aceites y grasas no polares para crear emulsiones en el agua, aflojando y levantando la suciedad y los microbios de las superficies y la piel. Los jabones no matan ni inhiben el crecimiento microbiano y por lo tanto no se consideran antisépticos o desinfectantes. Sin embargo, el uso adecuado de los jabones arrastra mecánicamente microorganismos, desgermando efectivamente una superficie. Algunos jabones contienen agentes bacteriostáticos añadidos como el triclocarbán o el cloflucarbán, compuestos estructuralmente relacionados con el triclosán, que introducen propiedades antisépticas o desinfectantes a los jabones.
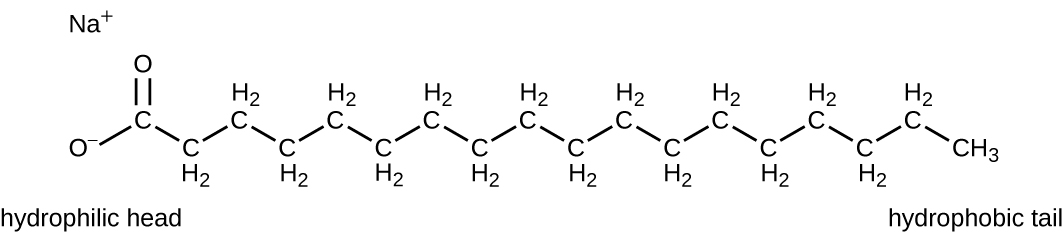
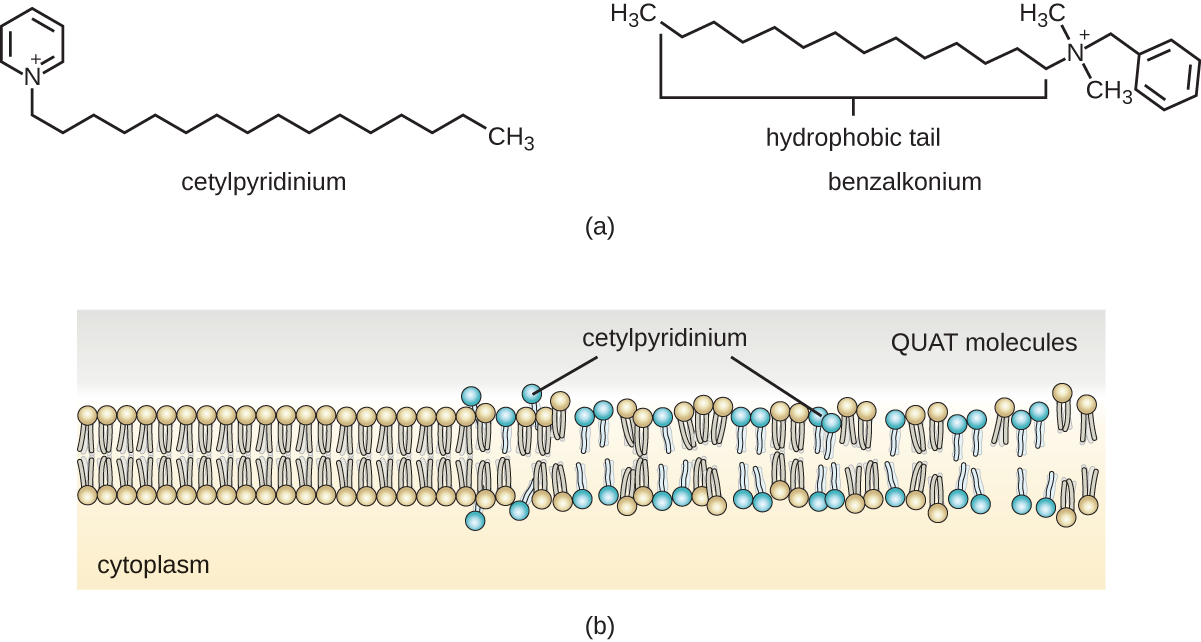
Los jabones, sin embargo, a menudo forman películas que son difíciles de enjuagar, especialmente en agua dura, que contiene altas concentraciones de sales minerales de calcio y magnesio. Los detergentes contienen moléculas de surfactantes sintéticos con regiones tanto polares como no polares que tienen una fuerte actividad limpiadora pero son más solubles, incluso en agua dura, y, por lo tanto, no dejan depósitos jabonosos. Los detergentes aniónicos, como los que se usan para lavar ropa, tienen un anión cargado negativamente en un extremo unido a una cadena hidrófoba larga, mientras que los detergentes catiónicos tienen un catión cargado positivamente en su lugar. Los detergentes catiónicos incluyen una importante clase de desinfectantes y antisépticos llamados sales de amonio cuaternario (quats), llamadas así por el átomo de nitrógeno cuaternario característico que confiere la carga positiva (Figura\(\PageIndex{8}\)). En general, los quats tienen propiedades similares a los fosfolípidos, teniendo extremos hidrófilos e hidrófobos. Como tal, los quats tienen la capacidad de insertarse en la bicapa de fosfolípidos bacterianos e interrumpir la integridad de la membrana. La carga catiónica de los quats parece conferir sus propiedades antimicrobianas, las cuales disminuyen cuando se neutralizan. Los quats tienen varias propiedades útiles. Son estables, no tóxicos, económicos, incoloros, inodoros e insípidos. Suelen ser bactericidas al alterar las membranas. También son activos contra hongos, protozoos y virus envueltos, pero las endosporas no se ven afectadas. En entornos clínicos, pueden ser utilizados como antisépticos o para desinfectar superficies. Las mezclas de quats también se encuentran comúnmente en limpiadores y desinfectantes domésticos, incluyendo muchas formulaciones actuales de productos de la marca Lysol, que contienen cloruros de benzalconio como ingredientes activos. Los cloruros de benzalconio, junto con el cloruro de quat cetilpirimidina, también se encuentran en productos como antisépticos para la piel, enjuagues bucales y enjuagues bucales.
Ejercicio\(\PageIndex{5}\)
¿Por qué los jabones no se consideran desinfectantes?
Lavarse las manos de la manera correcta
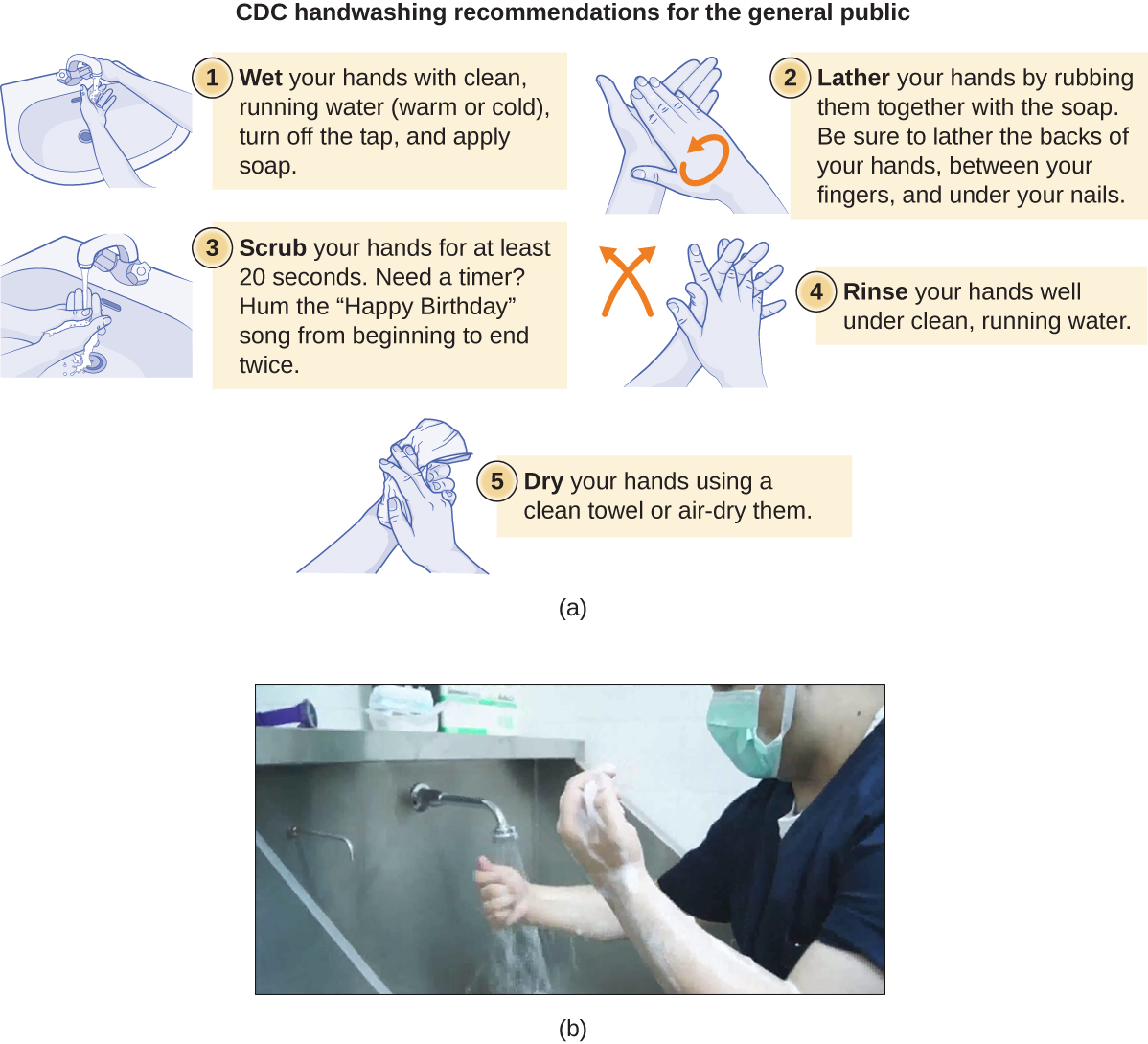
El lavado de manos es crítico para la salud pública y debe enfatizarse en un entorno clínico. Para el público en general, los CDC recomiendan lavarse las manos antes, durante y después de manipular los alimentos; antes de comer; antes y después de interactuar con alguien que está enfermo; antes y después de tratar una herida; después de usar el baño o cambiarse pañales; después de toser, estornudar o sonarse la nariz; después de manipular basura; y después de interactuar con un animal, su alimento o sus desechos. La figura\(\PageIndex{9}\) ilustra los cinco pasos de lavado adecuado de manos recomendados por los CDC.
El lavado de manos es aún más importante para los trabajadores de la salud, quienes deben lavarse bien las manos entre cada contacto con el paciente, después de quitarse los guantes, después del contacto con fluidos corporales y fomites potencialmente infecciosos, y antes y después de asistir a un cirujano con procedimientos invasivos. Incluso con el uso de vestimenta quirúrgica adecuada, incluidos guantes, el lavado para la cirugía es más complicado que el lavado de manos de rutina. El objetivo del lavado quirúrgico es reducir la microbiota normal en la superficie de la piel para evitar la introducción de estos microbios en las heridas quirúrgicas de un paciente.
No existe un protocolo único ampliamente aceptado para el lavado quirúrgico. Los protocolos de duración del lavado pueden depender del antimicrobiano utilizado; los trabajadores de la salud siempre deben verificar las recomendaciones del fabricante. De acuerdo con la Asociación de Tecnólogos Quirúrgicos (AST), los exfoliantes quirúrgicos se pueden realizar con o sin el uso de cepillos (Figura\(\PageIndex{9}\)).
Para obtener más información sobre el lavado de manos adecuado, visite el sitio web de los CDC.
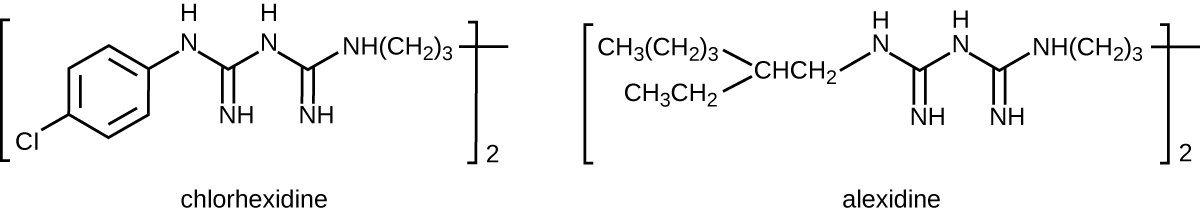
Bisbiguanidas
Las bisbiguanidas se sintetizaron por primera vez en el siglo XX y son moléculas catiónicas (cargadas positivamente) conocidas por sus propiedades antisépticas (Figura\(\PageIndex{10}\)). Un antiséptico importante de bisbiguanida es la clorhexidina. Tiene actividad de amplio espectro contra levaduras, bacterias grampositivas y bacterias gramnegativas, con la excepción de Pseudomonas aeruginosa, que puede desarrollar resistencia en la exposición repetida. La clorhexidina altera las membranas celulares y es bacteriostática a concentraciones más bajas o bactericida a concentraciones más altas, en las que en realidad hace que el contenido citoplásmico de las células se congele. También tiene actividad contra virus envueltos. Sin embargo, la clorhexidina es poco efectiva contra Mycobacterium tuberculosis y virus sin envoltura, y no es esporicida. La clorhexidina se usa típicamente en el entorno clínico como un exfoliante quirúrgico y para otras necesidades de lavado de manos para el personal médico, así como para la antisepsia tópica para pacientes antes de la cirugía o la inyección con aguja. Es más persistente que los yodóforos, proporcionando una actividad antimicrobiana de larga duración. Las soluciones de clorhexidina también se pueden usar como enjuagues orales después de procedimientos orales o para tratar la gingivitis. Otra bisbiguanida, la alexidina, está ganando popularidad como exfoliante quirúrgico y enjuague oral porque actúa más rápido que la clorhexidina.
Ejercicio\(\PageIndex{6}\)
¿Qué dos efectos tiene la clorhexidina en las células bacterianas?
Agentes alquilantes
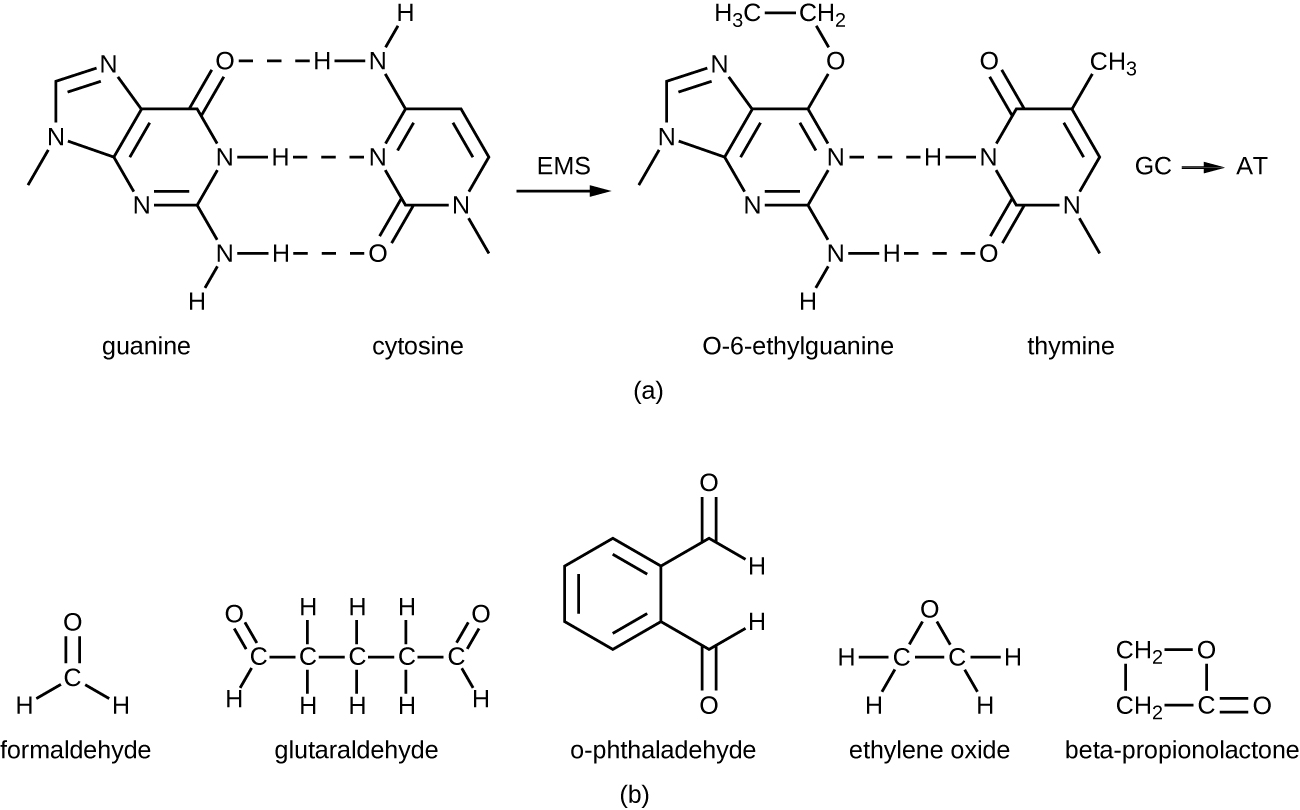
Los agentes alquilantes son un grupo de químicos desinfectantes fuertes que actúan reemplazando un átomo de hidrógeno dentro de una molécula por un grupo alquilo (C n H 2n+1), inactivando así enzimas y ácidos nucleicos (Figura\(\PageIndex{11}\)). El agente alquilante formaldehído (CH 2 OH) se usa comúnmente en solución a una concentración de 37% (conocida como formalina) o como desinfectante gaseoso y biocida. Es un desinfectante y biocida fuerte de amplio espectro que tiene la capacidad de matar bacterias, virus, hongos y endosporas, lo que lleva a la esterilización a bajas temperaturas, lo que a veces es una alternativa conveniente a los métodos de esterilización por calor más intensivos en mano de obra. También entrecruza proteínas y ha sido ampliamente utilizado como fijador químico. Debido a esto, se utiliza para el almacenamiento de especímenes de tejido y como líquido de embalsamamiento. También se ha utilizado para inactivar agentes infecciosos en la preparación de vacunas. El formaldehído es muy irritante para los tejidos vivos y además es cancerígeno; por lo tanto, no se usa como antiséptico.
El glutaraldehído es estructuralmente similar al formaldehído pero tiene dos grupos aldehído reactivos, lo que le permite actuar más rápidamente que el formaldehído. Se usa comúnmente como una solución al 2% para esterilización y se comercializa bajo la marca Cidex. Se utiliza para desinfectar una variedad de superficies y equipos quirúrgicos y médicos. Sin embargo, similar al formaldehído, el glutaraldehído irrita la piel y no se usa como antiséptico.
Un nuevo tipo de desinfectante que está ganando popularidad para la desinfección de equipos médicos es el o-ftalaldehído (OPA), que se encuentra en algunas formulaciones más nuevas de Cidex y productos similares, reemplazando al glutaraldehído. o-ftalaldehído también tiene dos grupos aldehído reactivos, pero están unidos por un puente aromático. o -Se cree que el ftalaldehído funciona de manera similar al glutaraldehído y al formaldehído, pero es mucho menos irritante para la piel y las fosas nasales, produce un olor mínimo, no requiere procesamiento antes de su uso y es más efectivo contra las micobacterias.
El óxido de etileno es un tipo de agente alquilante que se utiliza para la esterilización gaseosa. Es altamente penetrante y puede esterilizar artículos dentro de bolsas de plástico como catéteres, artículos desechables en laboratorios y entornos clínicos (como cajas Petri empaquetadas) y otros equipos. La exposición al óxido de etileno es una forma de esterilización en frío, lo que la hace útil para la esterilización de artículos sensibles al calor. Sin embargo, se debe tener mucho cuidado con el uso del óxido de etileno; es cancerígeno, al igual que los otros agentes alquilantes, y también es altamente explosivo. Con un uso cuidadoso y una aireación adecuada de los productos después del tratamiento, el óxido de etileno es altamente efectivo, y los esterilizadores de óxido de etileno se encuentran comúnmente en entornos médicos para esterilizar materiales envasados.
La β-propionolactona es un agente alquilante con una estructura química diferente a los otros ya discutidos. Al igual que otros agentes alquilantes, la β-propionolactona se une al ADN, inactivándolo con ello (Figura\(\PageIndex{11}\)). Es un líquido transparente con un olor fuerte y tiene la capacidad de matar endosporas. Como tal, se ha utilizado ya sea en forma líquida o como vapor para la esterilización de instrumentos médicos e injertos de tejido, y es un componente común de las vacunas, utilizadas para mantener su esterilidad. También se ha utilizado para la esterilización de caldo nutritivo, así como plasma sanguíneo, leche y agua. Es rápidamente metabolizado por animales y humanos a ácido láctico. También es irritante, sin embargo, y puede provocar daños permanentes en los ojos, los riñones o el hígado. Adicionalmente, se ha demostrado que es cancerígeno en animales; por lo tanto, son necesarias precauciones para minimizar la exposición humana a β-propionolactona. 14
Ejercicio\(\PageIndex{7}\)
- ¿En qué reacción química participan los agentes alquilantes?
- ¿Por qué los agentes alquilantes no se utilizan como antisépticos?
Priones acérrimos
Los priones, las proteínas acelulares mal plegadas responsables de enfermedades incurables y fatales como el kuru y la enfermedad de Creutzfeldt-Jakob (ver Viroides, Virusoides y Priones), son notoriamente difíciles de destruir. Los priones son extremadamente resistentes al calor, a los productos químicos y a la radiación. También son extremadamente infecciosos y mortales; por lo tanto, el manejo y eliminación de artículos infectados por priones requiere un entrenamiento extenso y extrema precaución.
Los métodos típicos de desinfección pueden reducir pero no eliminar la infectividad de los priones. El autoclave no es completamente efectivo, ni los químicos como fenol, alcoholes, formalina y β-propiolactona. Incluso cuando se fija en formalina, los tejidos cerebrales y de la médula espinal afectados siguen siendo infecciosos.
El personal que maneja especímenes o equipos contaminados o trabaja con pacientes infectados debe usar una capa protectora, protección facial y guantes resistentes a cortes. Cualquier contacto con la piel debe lavarse inmediatamente con detergente y agua tibia sin restregar. Después, la piel debe lavarse con NaOH 1 N o una dilución 1:10 de lejía por 1 minuto. Los desechos contaminados deben incinerarse o esterilizarse en autoclave en una solución básica fuerte, y los instrumentos deben limpiarse y empaparse en una solución básica fuerte.
Peroxígenos
Los peroxígenos son agentes oxidantes fuertes que pueden ser utilizados como desinfectantes o antisépticos. El peroxígeno más utilizado es el peróxido de hidrógeno (H 2 O 2), que a menudo se usa en solución para desinfectar superficies y también puede usarse como agente gaseoso. Las soluciones de peróxido de hidrógeno son antisépticos para la piel económicos que se descomponen en agua y gas oxígeno, los cuales son seguros para el medio ambiente. Esta descomposición se acelera en presencia de luz, por lo que las soluciones de peróxido de hidrógeno normalmente se venden en botellas marrones u opacas. Una desventaja de usar peróxido de hidrógeno como antiséptico es que también causa daños en la piel que pueden retrasar la cicatrización o provocar cicatrices. Los limpiadores de lentes de contacto a menudo incluyen peróxido de hidrógeno como desinfectante.
El peróxido de hidrógeno actúa produciendo radicales libres que dañan las macromoléculas celulares. El peróxido de hidrógeno tiene actividad de amplio espectro, trabajando contra bacterias grampositivas y gramnegativas (con una eficacia ligeramente mayor contra bacterias grampositivas), hongos, virus y endosporas. Sin embargo, las bacterias que producen las enzimas desintoxicantes de oxígeno catalasa o peroxidasa pueden tener tolerancia inherente a bajas concentraciones de peróxido de hidrógeno (Figura\(\PageIndex{12}\)). Para matar las endosporas, se debe aumentar la duración de exposición o concentración de soluciones de peróxido de hidrógeno. El peróxido de hidrógeno gaseoso tiene mayor eficacia y puede ser utilizado como esterilizante para habitaciones o equipos.

El plasma, un gas ionizado caliente, descrito como el cuarto estado de la materia, es útil para esterilizar equipos porque penetra en las superficies y mata células vegetativas y endosporas. El peróxido de hidrógeno y el ácido peracético, otro peroxígeno de uso común, pueden introducirse cada uno como plasma. El ácido peracético se puede utilizar como esterilizante líquido o plasmático en la medida en que mata fácilmente las endosporas, es más efectivo que el peróxido de hidrógeno incluso a concentraciones bastante bajas, y es inmune a la inactivación por catalasas y peroxidasas. También se descompone en compuestos ambientalmente inocuos; en este caso, ácido acético y oxígeno.
Otros ejemplos de peroxígenos incluyen peróxido de benzoílo y peróxido de carbamida. El peróxido de benzoilo es un peroxígeno que se utiliza en soluciones de medicamentos para el acné. Mata a la bacteria Propionibacterium acnes, la cual se asocia con el acné. El peróxido de carbamida, un ingrediente utilizado en la pasta de dientes, es un peroxígeno que combate las biopelículas orales que causan decoloración dental y halitosis (mal aliento). 15 Por último, el gas ozono es un peroxígeno con cualidades desinfectantes y se utiliza para limpiar los suministros de aire o agua. En general, los peroxígenos son altamente efectivos y de uso común, sin riesgo ambiental asociado.
Ejercicio\(\PageIndex{8}\)
¿Cómo matan los peróxidos a las células?
Fluidos Supercríticos
En los últimos 15 años, el uso de fluidos supercríticos, especialmente dióxido de carbono supercrítico (SCCo 2), ha ganado popularidad para ciertas aplicaciones de esterilización. Cuando el dióxido de carbono se lleva a aproximadamente 10 veces la presión atmosférica, alcanza un estado supercrítico que tiene propiedades físicas entre las de líquidos y gases. Los materiales puestos en una cámara en la que el dióxido de carbono se presuriza de esta manera pueden esterilizarse debido a la capacidad del SCCo 2 para penetrar en las superficies.
El dióxido de carbono supercrítico funciona penetrando las células y formando ácido carbónico, disminuyendo así considerablemente el pH celular. Esta técnica es efectiva contra las células vegetativas y también se utiliza en combinación con ácido peracético para matar endosporas. Su eficacia también se puede aumentar con el aumento de la temperatura o mediante ciclos rápidos de presurización y despresurización, que más probablemente produzcan lisis celular.
Los beneficios del SCCo 2 incluyen las propiedades no reactivas, no tóxicas y no inflamables del dióxido de carbono, y este protocolo es efectivo a bajas temperaturas. A diferencia de otros métodos, como el calor y la irradiación, que pueden degradar el objeto que se esteriliza, el uso de SCCo 2 preserva la integridad del objeto y se usa comúnmente para tratar alimentos (incluyendo especias y jugos) y dispositivos médicos como endoscopios. También está ganando popularidad para desinfectar tejidos como piel, huesos, tendones y ligamentos antes del trasplante. scCo 2 también se puede usar para el control de plagas porque puede matar huevos de insectos y larvas dentro de los productos.
Ejercicio\(\PageIndex{9}\)
¿Por qué el uso del dióxido de carbono supercrítico está ganando popularidad para usos comerciales y médicos?
Conservantes Químicos de Alimentos
Los conservantes químicos se utilizan para inhibir el crecimiento microbiano y minimizar el deterioro en algunos alimentos. Los conservantes químicos comúnmente utilizados incluyen ácido sórbico, ácido benzoico y ácido propiónico, y sus sales más solubles sorbato de potasio, benzoato de sodio y propionato de calcio, todos los cuales se utilizan para controlar el crecimiento de mohos en alimentos ácidos. Cada uno de estos conservantes es no tóxico y fácilmente metabolizado por los humanos. También son sin sabor, por lo que no comprometen el sabor de los alimentos que conservan.
Los ácidos sórbico y benzoico presentan mayor eficacia a medida que disminuye el pH. Se cree que el ácido sórbico funciona inhibiendo diversas enzimas celulares, incluidas las del ciclo del ácido cítrico, así como catalasas y peroxidasas. Se agrega como conservante en una amplia variedad de alimentos, incluyendo productos lácteos, pan, frutas y vegetales. El ácido benzoico se encuentra naturalmente en muchos tipos de frutas y bayas, especias y productos fermentados. Se cree que funciona disminuyendo el pH intracelular, interfiriendo con mecanismos como la fosforilación oxidativa y la captación de moléculas como los aminoácidos en las células. Los alimentos conservados con ácido benzoico o benzoato de sodio incluyen zumos de frutas, mermeladas, helados, pasteles, refrescos, chicles y encurtidos.
Se cree que el ácido propiónico inhibe las enzimas y disminuye el pH intracelular, funcionando de manera similar al ácido benzoico. Sin embargo, el ácido propiónico es un conservante más efectivo a un pH más alto que el ácido sórbico o el ácido benzoico. El ácido propiónico es producido naturalmente por algunos quesos durante su maduración y se agrega a otros tipos de queso y productos horneados para evitar la contaminación por moho. También se agrega a la masa cruda para evitar la contaminación por la bacteria Bacillus mesentericus, lo que provoca que el pan se vuelva ropy.
Otros conservantes químicos de uso común incluyen dióxido de azufre y nitritos. El dióxido de azufre evita el dorado de los alimentos y se utiliza para la conservación de frutos secos; se ha utilizado en la elaboración del vino desde la antigüedad. El gas dióxido de azufre se disuelve fácilmente en agua, formando sulfitos. Aunque los sulfitos pueden ser metabolizados por el organismo, algunas personas tienen alergias al sulfito, incluyendo reacciones asmáticas. Adicionalmente, los sulfitos degradan la tiamina, un nutriente importante en algunos alimentos. El modo de acción de los sulfitos no está del todo claro, pero pueden interferir con la formación del enlace disulfuro (ver Figura 7.4.5) en las proteínas, inhibiendo la actividad enzimática. Alternativamente, pueden reducir el pH intracelular de la célula, interfiriendo con los mecanismos impulsados por la fuerza motriz de protones.
Se agregan nitritos a las carnes procesadas para mantener el color y detener la germinación de las endosporas de Clostridium botulinum. Los nitritos se reducen a óxido nítrico, el cual reacciona con grupos hemo y grupos hierro-azufre. Cuando el óxido nítrico reacciona con el grupo hemo dentro de la mioglobina de las carnes, se forma un producto rojo, dando a la carne su color rojo. Alternativamente, se piensa que cuando el ácido nítrico reacciona con la enzima hierro-azufre ferredoxina dentro de las bacterias, este portador de cadena de transporte de electrones se destruye, impidiendo la síntesis de ATP. Las nitrosaminas, sin embargo, son cancerígenas y pueden producirse a través de la exposición de carnes conservadas con nitritos (por ejemplo, perritos calientes, carne de almuerzo, salchicha de desayuno, tocino, carne en sopas enlatadas) a calentar durante la cocción.
Conservantes de Alimentos Químicos Naturales
El descubrimiento de sustancias antimicrobianas naturales producidas por otros microbios se ha sumado al arsenal de conservantes utilizados en los alimentos. La nisina es un péptido antimicrobiano producido por la bacteria Lactococcus lactis y es particularmente eficaz contra organismos grampositivos. La nisina funciona interrumpiendo la producción de la pared celular, dejando las células más propensas a la lisis. Se utiliza para conservar quesos, carnes y bebidas.
La natamicina es un antibiótico macrólido antifúngico producido por la bacteria Streptomyces natalensis. Fue aprobado por la FDA en 1982 y se utiliza para prevenir el crecimiento de hongos en varios tipos de productos lácteos, incluyendo requesón, queso rebanado y queso rallado. La natamicina también se utiliza para la conservación de la carne en países fuera de Estados Unidos.
Ejercicio\(\PageIndex{10}\)
¿Cuáles son las ventajas e inconvenientes del uso de sulfitos y nitritos como conservantes de alimentos?
Conceptos clave y resumen
- Los metales pesados, como el mercurio, la plata, el cobre y el zinc, se han utilizado durante mucho tiempo para la desinfección y preservación, aunque algunos tienen toxicidad y riesgos ambientales asociados con ellos.
- Los halógenos, incluyendo cloro, flúor y yodo, también se usan comúnmente para la desinfección. Los compuestos de cloro, incluyendo hipoclorito de sodio, cloraminas y dióxido de cloro, se usan comúnmente para la desinfección del agua. El yodo, tanto en forma de tintura como de yodóforo, es un antiséptico eficaz.
- Los alcoholes, entre ellos el alcohol etílico y el alcohol isopropílico, son comúnmente utilizados antisépticos que actúan desnaturalizando proteínas y rompiendo membranas.
- Los fenólicos son desinfectantes estables de acción prolongada que desnaturalizan las proteínas e interrumpen las membranas. Se encuentran comúnmente en limpiadores domésticos, enjuagues bucales y desinfectantes hospitalarios, y también se utilizan para preservar los cultivos cosechados.
- El compuesto fenólico triclosán, que se encuentra en jabones antibacterianos, plásticos y textiles, es técnicamente un antibiótico debido a su modo específico de acción de inhibir la síntesis bacteriana de ácidos grasos.
- Los tensioactivos, incluidos los jabones y detergentes, disminuyen la tensión superficial del agua para crear emulsiones que arrastran mecánicamente los microbios. Los jabones son ácidos grasos de cadena larga, mientras que los detergentes son tensioactivos sintéticos.
- Los compuestos de amonio cuaternario (quats) son detergentes catiónicos que alteran las membranas. Se utilizan en limpiadores domésticos, desinfectantes de la piel, enjuagues bucales y enjuagues bucales.
- Las bisbiguanidas alteran las membranas celulares, provocando que el contenido celular se gelifique. La clorhexidina y la alexidina se utilizan comúnmente para exfoliantes quirúrgicos, para el lavado de manos en entornos clínicos y en enjuagues orales recetados.
- Los agentes alquilantes esterilizan eficazmente los materiales a bajas temperaturas pero son cancerígenos y también pueden irritar los tejidos. El glutaraldehído y el o-ftalaldehído se utilizan como desinfectantes hospitalarios pero no como antisépticos. El formaldehído se utiliza para el almacenamiento de especímenes de tejido, como líquido de embalsamamiento, y en la preparación de vacunas para inactivar agentes infecciosos. El óxido de etileno es un esterilizante gaseoso que puede permear materiales envasados sensibles al calor, pero también es explosivo y cancerígeno.
- Los peroxígenos, incluidos el peróxido de hidrógeno, el ácido peracético, el peróxido de benzoilo y el gas ozono, son agentes oxidantes fuertes que producen radicales libres en las células, dañando sus macromoléculas. Son seguros para el medio ambiente y son desinfectantes y antisépticos altamente efectivos.
- El dióxido de carbono presurizado en forma de fluido supercrítico penetra fácilmente los materiales envasados y las células, formando ácido carbónico y disminuyendo el pH intracelular. El dióxido de carbono supercrítico no es reactivo, no tóxico, no inflamable y eficaz a bajas temperaturas para la esterilización de dispositivos médicos, implantes y tejidos trasplantados.
- Los conservantes químicos se agregan a una variedad de alimentos. El ácido sórbico, el ácido benzoico, el ácido propiónico y sus sales más solubles inhiben las enzimas o reducen el pH intracelular.
- Los sulfitos se utilizan en la elaboración del vino y procesamiento de alimentos para evitar el dorado de los alimentos.
- Los nitritos se utilizan para conservar las carnes y mantener el color, pero cocinar carnes conservadas con nitritos puede producir nitrosaminas cancerígenas.
- La nisina y la natamicina son conservantes producidos naturalmente utilizados en quesos y carnes. La nisina es efectiva contra bacterias grampositivas y la natamicina contra hongos.
Notas al pie
- 1 Administración de Alimentos y Medicamentos de Estados Unidos. “Triclosán: Lo que los consumidores deben saber”. 2015. www.fda.gov/forconsumers/cons... /ucm205999.htm. Consultado el 9 de junio de 2016.
- 2 J. Stromberg. “Cinco razones por las que probablemente deberías dejar de usar jabón antibacteriano”. Smithsonian.com enero 3, 2014. www.smithsonianmag.com/scienc... 948078/? no-ist. Consultado el 9 de junio de 2016.
- 3 SP Yazdankhah et al. “Triclosán y resistencia antimicrobiana en bacterias: una visión general”. Farmacorresistencia microbiana 12 núm. 2 (2006) :83—90.
- 4 L. Birošová, M. Mikulášová. “Desarrollo de Triclosán y Resistencia Antibiótica en Salmonella enterica serovar Typhimurium.” Revista de Microbiología Médica 58 núm. 4 (2009) :436—441.
- 5 AB Dann, A. Hontela. “Triclosán: Exposición Ambiental, Toxicidad y Mecanismos de Acción”. Revista de Toxicología Aplicada 31 núm. 4 (2011) :285—311.
- 6 Centros para el Control y la Prevención de Enfermedades de Estados Unidos. “Triclosán Hoja Informativa.” 2013. www.CDC.gov/Biomonitoring/tri... FactSheet.html. Consultado el 9 de junio de 2016.
- 7 EM Clayton et al. “El impacto del bisfenol A y el triclosán en los parámetros inmunitarios en la población estadounidense, NHANES 2003-2006”. Perspectivas de salud ambiental 119 núm. 3 (2011) :390.
- 8 N. Silvestry-Rodríguez et al. “La plata como desinfectante”. En Revisiones de Contaminación Ambiental y Toxicología, pp. 23-45. Editado por GW Ware y DM Whitacre. Nueva York: Springer, 2007.
- 9 B. Owens. “La plata hace que los antibióticos sean miles de veces más efectivos”. Naturaleza 19 de junio de 2013. http://www.nature.com/news/silver-ma...ective-1.13232
- 10 C. Seiler, TU Berendonk. “Co-selección impulsada por metales pesados de resistencia a antibióticos en suelos y cuerpos de agua impactados por la agricultura y la acuicultura”. Fronteras en Microbiología 3 (2012) :399.
- 11 Organización Mundial de la Salud. “Beneficios y riesgos del uso de desinfectantes que contienen cloro en la producción de alimentos y procesamiento de alimentos: Informe de una reunión conjunta de expertos FAO/OMS”. Ginebra, Suiza: Organización Mundial de la Salud, 2009.
- 12 RE Marqués. “Acciones antimicrobianas del fluoruro para bacterias orales”. Revista Canadiense de Microbiología 41 núm. 11 (1995) :955—964.
- 13 L. Thomas et al. “Desarrollo de Resistencia al Diacetato de Clorhexidina en Pseudomonas aeruginosa y el Efecto de una Concentración 'Residual'”. Revista de Infección Hospitalaria 46 núm. 4 (2000) :297—303.
- 14 Instituto de Medicina. “Efectos a Largo Plazo en la Salud de la Participación en el Proyecto SHAD (Peligro y Defensa a Bordo)”. Washington, DC: The National Academies Press, 2007.
- 15 Yao, C.S. et al. “Efecto antibacteriano in vitro del peróxido de carbamida sobre la biopelícula oral”. Revista de Microbiología Oral Jun 12, 2013. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3682087/. doi: 10.3402/jom.v5i0.20392.


