20.1: Aplicaciones prácticas de anticuerpos monoclonales y policlonales
- Page ID
- 54786
Objetivos de aprendizaje
- Comparar el método de desarrollo, uso y características de anticuerpos monoclonales y policlonales
- Explicar la naturaleza de la reactividad cruzada de anticuerpos y por qué esto es un problema menor con los anticuerpos monoclonales
Enfoque Clínico: Parte 1
En un lamentable incidente, un trabajador de la salud que luchaba con la adicción fue sorprendido robando jeringas de analgésicos y reemplazándolos por jeringas llenas de sustancias desconocidas. El hospital inmediatamente despidió al empleado y lo detuvieron; sin embargo, dos pacientes con los que había trabajado posteriormente dieron positivo por VIH.
Si bien no había pruebas de que las infecciones se originaran a partir de las jeringas contaminadas, el médico de salud pública del hospital tomó medidas inmediatas para determinar si algún otro paciente había sido puesto en riesgo. Si bien el trabajador sólo había estado empleado por poco tiempo, se determinó que había entrado en contacto con más de 1300 pacientes. El hospital decidió ponerse en contacto con todos estos pacientes y hacerles la prueba del VIH.
Ejercicio\(\PageIndex{1}\)
- ¿Por qué el hospital siente que es necesario hacer una prueba de VIH a cada paciente?
- ¿Qué tipos de pruebas se pueden utilizar para determinar si un paciente tiene VIH?
Además de ser cruciales para nuestra respuesta inmune normal, los anticuerpos proporcionan poderosas herramientas para fines de investigación y diagnóstico. La alta especificidad de los anticuerpos los convierte en una excelente herramienta para detectar y cuantificar una amplia gama de dianas, desde fármacos hasta proteínas séricas y microorganismos. Con ensayos in vitro, los anticuerpos pueden ser utilizados para precipitar antígenos solubles, aglutinar (aglutinar) células, opsonizar y matar bacterias con la ayuda del complemento, y neutralizar fármacos, toxinas y virus.
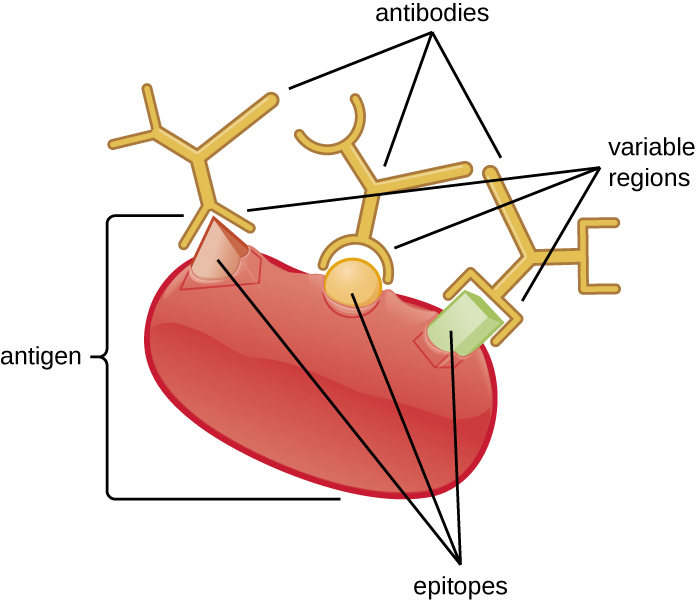
La especificidad de un anticuerpo resulta del sitio de unión al antígeno formado dentro de las regiones variables, regiones del anticuerpo que tienen patrones únicos de aminoácidos que solo pueden unirse a antígenos diana con una secuencia molecular que proporciona cargas complementarias y enlaces no covalentes. Sin embargo, existen limitaciones en cuanto a la especificidad de anticuerpos. Algunos antígenos son tan químicamente similares que se produce reactividad cruzada; en otras palabras, los anticuerpos producidos contra un antígeno se unen a un antígeno químicamente similar pero diferente. Considera un antígeno que consiste en una sola proteína con múltiples epítopos (Figura\(\PageIndex{1}\)). Esta única proteína puede estimular la producción de muchos anticuerpos diferentes, algunos de los cuales pueden unirse a epítopos químicamente idénticos en otras proteínas.
Es más probable que se produzca reactividad cruzada entre anticuerpos y antígenos que tienen baja afinidad o avidez. La afinidad, que puede determinarse experimentalmente, es una medida de la fuerza de unión entre el sitio de unión de un anticuerpo y un epítopo, mientras que la avidez es la fuerza total de todas las interacciones en un complejo anticuerpo-antígeno (que puede tener más de un sitio de unión). La avidez está influenciada por la afinidad, así como las disposiciones estructurales del epítopo y las regiones variables del anticuerpo. Si un anticuerpo tiene una alta afinidad/avidez por un antígeno específico, es menos probable que reaccione de manera cruzada con un antígeno por el que tiene una afinidad/avidez menor.
Ejercicio\(\PageIndex{2}\)
- ¿Qué propiedad hace que los anticuerpos sean útiles para la investigación y el diagnóstico clínico?
- ¿Qué es la reactividad cruzada y por qué ocurre?
Producción de Anticuerpos Policlonales
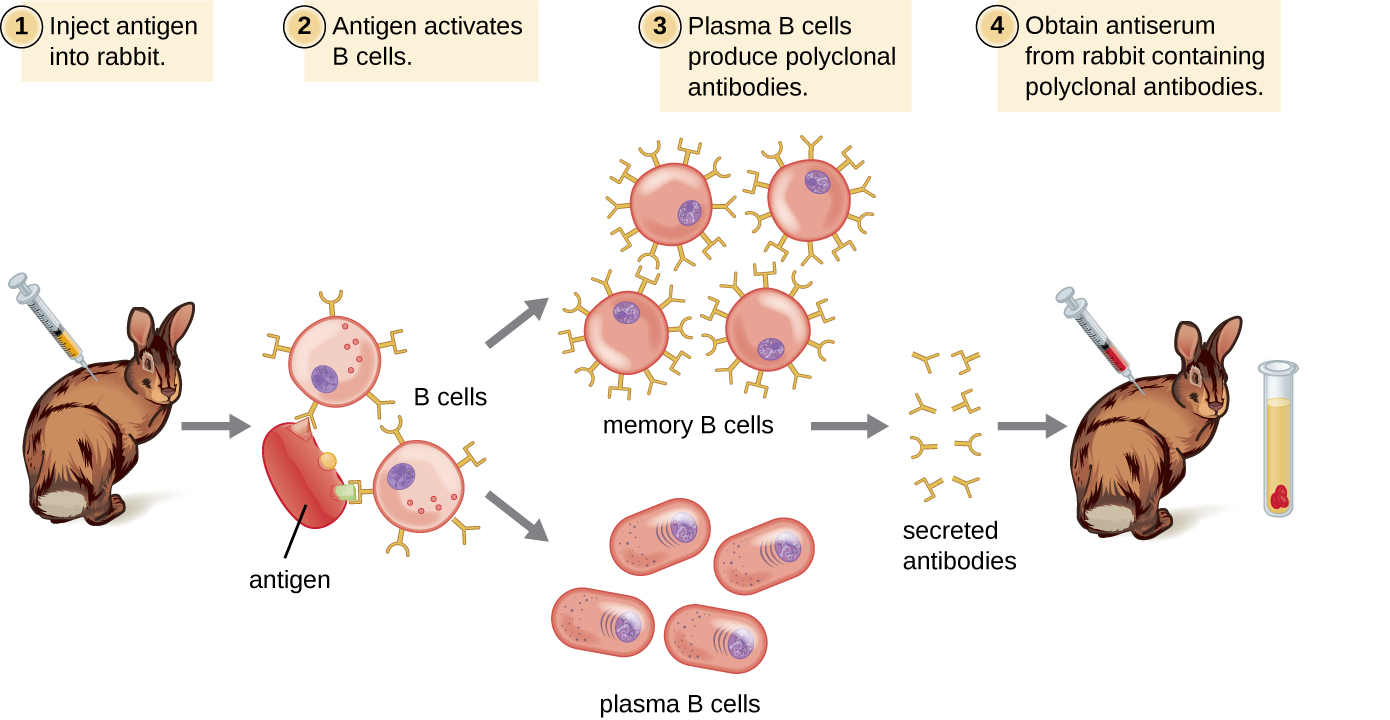
Los anticuerpos utilizados con fines de investigación y diagnóstico a menudo se obtienen inyectando un antígeno específico a un animal de laboratorio como un conejo o una cabra. En pocas semanas, el sistema inmunitario del animal producirá altos niveles de anticuerpos específicos para el antígeno. Estos anticuerpos se pueden recolectar en un antisuero, que es suero completo recolectado de un animal después de la exposición a un antígeno. Debido a que la mayoría de los antígenos son estructuras complejas con múltiples epítopos, resultan en la producción de múltiples anticuerpos en el animal de laboratorio. Esta llamada respuesta de anticuerpos policlonales también es típica de la respuesta a la infección por el sistema inmune humano. El antisuero extraído de un animal contendrá así anticuerpos de múltiples clones de células B, respondiendo cada célula B a un epítopo específico en el antígeno (Figura\(\PageIndex{2}\)).
Los animales de laboratorio generalmente se inyectan al menos dos veces con antígeno cuando se usan para producir antisuero. La segunda inyección activará las células de memoria que producen anticuerpos de clase IgG contra el antígeno. Las células de memoria también experimentan maduración por afinidad, lo que resulta en un conjunto de anticuerpos con mayor afinidad promedio. La maduración por afinidad ocurre debido a mutaciones en las regiones variables del gen de la inmunoglobulina, dando como resultado células B con sitios de unión a antígeno ligeramente alterados. En la reexposición al antígeno, aquellos linfocitos B capaces de producir anticuerpos con sitios de unión a antígeno de mayor afinidad serán estimulados para proliferar y producir más anticuerpos que sus pares de menor afinidad. Un adyuvante, que es un químico que provoca una activación generalizada del sistema inmune que estimula una mayor producción de anticuerpos, a menudo se mezcla con el antígeno antes de la inyección.
El antisuero obtenido de animales no solo contendrá anticuerpos contra el antígeno introducido artificialmente en el laboratorio, sino que también contendrá anticuerpos contra cualquier otro antígeno al que el animal haya estado expuesto durante su vida útil. Por esta razón, los antisueros deben primero ser “purificados” para eliminar otros anticuerpos antes de usar los anticuerpos para investigación o ensayos de diagnóstico.
Usos clínicos de los antisueros policlonales
Los antisueros policlonales se utilizan en muchas pruebas clínicas que están diseñadas para determinar si un paciente está produciendo anticuerpos en respuesta a un patógeno en particular. Si bien estas pruebas son ciertamente poderosas herramientas de diagnóstico, tienen sus limitaciones, porque son un medio indirecto para determinar si un patógeno en particular está presente. Las pruebas basadas en una respuesta policlonal a veces pueden conducir a un resultado falso positivo, es decir, una prueba que confirma la presencia de un antígeno que, de hecho, no está presente. Las pruebas basadas en anticuerpos también pueden dar como resultado un resultado falso negativo, que ocurre cuando la prueba no detecta un anticuerpo que, de hecho, está presente.
La precisión de las pruebas de anticuerpos se puede describir en términos de sensibilidad y especificidad de prueba. La sensibilidad de la prueba es la probabilidad de obtener un resultado positivo de la prueba cuando el paciente está efectivamente infectado. Si una prueba tiene alta sensibilidad, la probabilidad de un falso negativo es baja. La especificidad de la prueba, por otro lado, es la probabilidad de obtener un resultado negativo de la prueba cuando el paciente no está infectado. Si una prueba tiene alta especificidad, la probabilidad de un falso positivo es baja.
Los falsos positivos a menudo ocurren debido a la reactividad cruzada, que puede ocurrir cuando los epítopos de un patógeno diferente son similares a los encontrados en el patógeno que se está probando. Por esta razón, las pruebas basadas en anticuerpos a menudo se utilizan solo como pruebas de tamizaje; si los resultados son positivos, se utilizan otras pruebas confirmatorias para asegurarse de que los resultados no fueron falsos positivos.
Por ejemplo, una muestra de sangre de un paciente sospechoso de tener hepatitis C puede ser examinada para detectar el virus usando anticuerpos que se unen a antígenos en el virus de la hepatitis C. Si el paciente está efectivamente infectado con el virus de la hepatitis C, los anticuerpos se unirán a los antígenos, produciendo un resultado positivo en la prueba. Si el paciente no está infectado con el virus C hepático, los anticuerpos generalmente no se unirán a nada y la prueba debe ser negativa; sin embargo, puede ocurrir un falso positivo si el paciente ha sido previamente infectado por cualquiera de una variedad de patógenos que provocan anticuerpos que reaccionan de manera cruzada con la hepatitis C antígenos de virus. Las pruebas de anticuerpos para hepatitis C tienen alta sensibilidad (una baja probabilidad de un falso negativo) pero baja especificidad (una alta probabilidad de un falso positivo). Así, los pacientes que den positivo deben tener una segunda prueba confirmatoria para descartar la posibilidad de un falso positivo. La prueba confirmatoria es una prueba más costosa y laboriosa que analiza directamente la presencia de ARN viral de la hepatitis C en la sangre. Solo después de que la prueba confirmatoria sea positiva, el paciente puede ser diagnosticado definitivamente con una infección por hepatitis C. Las pruebas basadas en anticuerpos pueden dar como resultado un falso negativo si, por alguna razón, el sistema inmunitario del paciente no ha producido niveles detectables de anticuerpos. Para algunas enfermedades, pueden pasar varias semanas después de la infección antes de que el sistema inmunitario produzca suficientes anticuerpos para cruzar el umbral de detección del ensayo. En pacientes inmunocomprometidos, el sistema inmunitario puede no ser capaz de producir un nivel detectable de anticuerpos.
Otra limitación del uso de la producción de anticuerpos como indicador de enfermedad es que los anticuerpos en la sangre persistirán mucho después de que se haya aclarado la infección. Dependiendo del tipo de infección, los anticuerpos estarán presentes por muchos meses; en ocasiones, pueden estar presentes por el resto de la vida del paciente. Por lo tanto, una prueba positiva basada en anticuerpos solo significa que el paciente estuvo infectado en algún momento; no prueba que la infección esté activa.
Además de su papel en el diagnóstico, los antisueros policlonales pueden activar el complemento, detectar la presencia de bacterias en entornos clínicos y de la industria alimentaria, y realizar una amplia gama de reacciones de precipitación que pueden detectar y cuantificar proteínas séricas, virus u otros antígenos. Sin embargo, con las muchas especificidades de anticuerpos presentes en un antisuero policlonal, existe una probabilidad significativa de que el antisuero reaccione de manera cruzada con antígenos a los que el individuo nunca estuvo expuesto. Por lo tanto, siempre debemos tener en cuenta la posibilidad de resultados falsos positivos cuando se trabaja con un antisuero policlonal.
Ejercicio\(\PageIndex{3}\)
- ¿Qué es un falso positivo y cuáles son algunas razones por las que ocurren falsos positivos?
- ¿Qué es un falso negativo y cuáles son algunas razones por las que ocurren falsos positivos?
- Si un paciente da negativo en una prueba altamente sensible, ¿cuál es la probabilidad de que la persona esté infectada con el patógeno?
Producir anticuerpos monoclonales
Algunos tipos de ensayos requieren una mejor especificidad y afinidad de anticuerpos que los que se pueden obtener usando un antisuero policlonal. Para lograr esta alta especificidad, todos los anticuerpos deben unirse con alta afinidad a un único epítopo. Esta alta especificidad puede ser proporcionada por anticuerpos monoclonales (mAbs). En el cuadro\(\PageIndex{1}\) se comparan algunas de las características importantes de los anticuerpos monoclonales y policlonales.
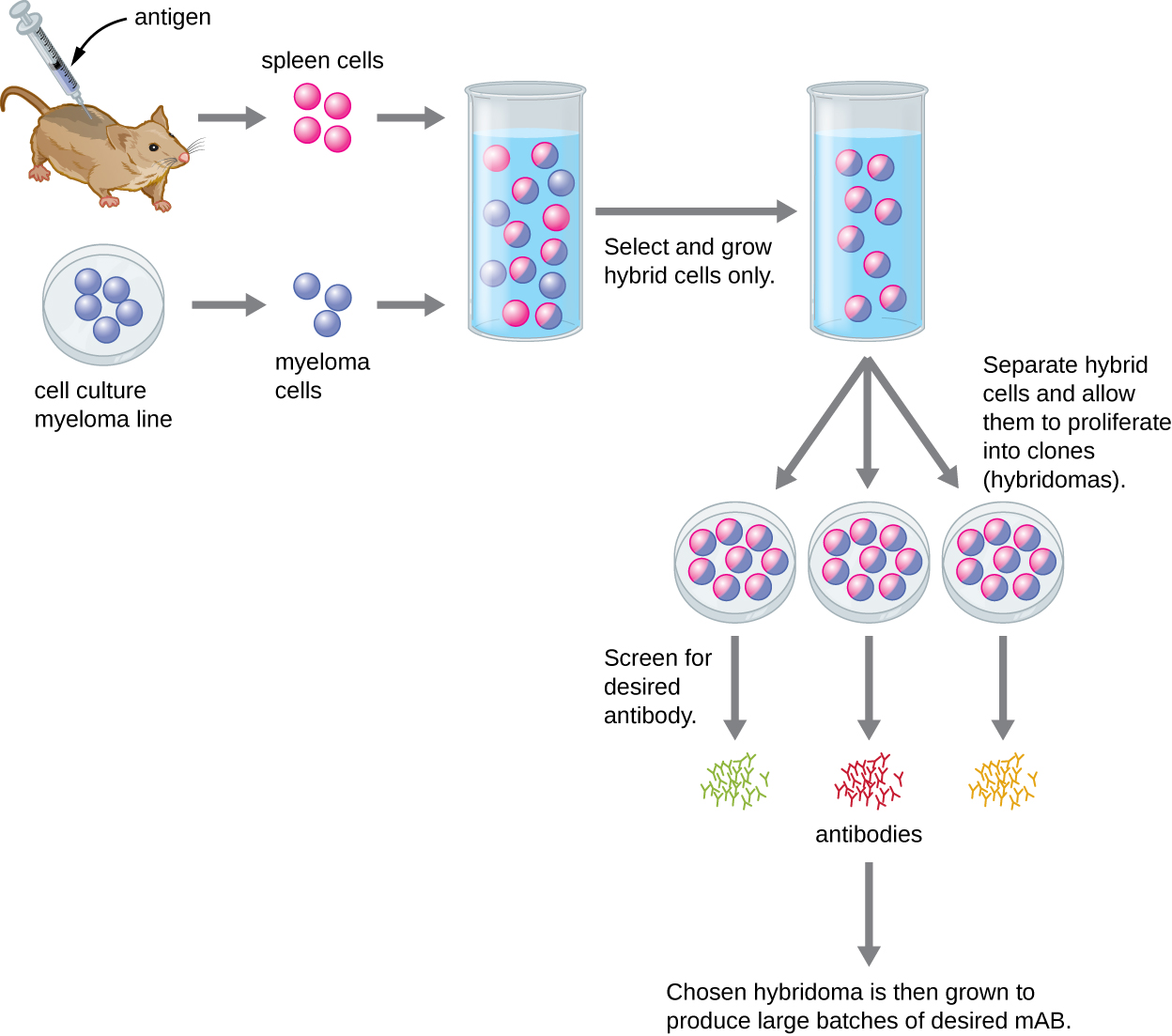
A diferencia de los anticuerpos policlonales, que se producen en animales vivos, los anticuerpos monoclonales se producen in vitro mediante técnicas de cultivo de tejidos. Los mAbs se producen inmunizando a un animal, a menudo un ratón, múltiples veces con un antígeno específico. A continuación, se extraen las células B del bazo del animal inmunizado. Dado que las células B normales son incapaces de proliferar para siempre, se fusionan con células B inmortales y cancerosas llamadas células de mieloma, para producir células de hibridoma. Todas las células se colocan luego en un medio selectivo que permite que solo los hibridomas crezcan; las células de mieloma no fusionadas no pueden crecer y cualquier célula B no fusionada muere. Los hibridomas, que son capaces de crecer continuamente en cultivo mientras producen anticuerpos, luego se criban para detectar el mAB deseado. Aquellos que producen el mAB deseado se cultivan en cultivo tisular; el medio de cultivo se recoge periódicamente y los mAbs se purifican del medio. Este es un proceso muy costoso y que consume mucho tiempo. Puede tomar semanas de cultivo y muchos litros de medio para proporcionar suficientes mAbs para un experimento o para tratar a un solo paciente. Los mAbs son caros (Figura\(\PageIndex{3}\)).
| Anticuerpos Monoclonales | Anticuerpos policlonales |
|---|---|
| Producción costosa | Producción económica |
| Largo tiempo de producción | Producción rápida |
| Grandes cantidades de anticuerpos específicos | Grandes cantidades de anticuerpos inespecíficos |
| Reconocer un único epítopo en un antígeno | Reconocer múltiples epítopos en un antígeno |
| La producción es continua y uniforme una vez hecho el hibridoma | Diferentes lotes varían en composición |
Usos Clínicos de Anticuerpos Monoclonales
Dado que los métodos más comunes para producir anticuerpos monoclonales utilizan células de ratón, es necesario crear anticuerpos monoclonales humanizados para uso clínico humano. Los anticuerpos de ratón no pueden inyectarse repetidamente en humanos, porque el sistema inmunitario los reconocerá como extraños y responderá a ellos con anticuerpos neutralizantes. Este problema puede minimizarse mediante ingeniería genética del anticuerpo en la célula B de ratón. Las regiones variables de los genes de cadena ligera y pesada de ratón se ligan a regiones constantes humanas, y el gen quimérico se transfiere luego a una célula huésped. Esto permite la producción de un mAB que es principalmente “humano” con solo el sitio de unión al antígeno siendo de origen ratón.
Los mAbs humanizados se han usado con éxito para tratar el cáncer con efectos secundarios mínimos. Por ejemplo, el fármaco de anticuerpos monoclonales humanizados Herceptin ha sido útil para el tratamiento de algunos tipos de cáncer de mama. También se han realizado algunos ensayos preliminares de mAB humanizado para el tratamiento de enfermedades infecciosas, pero ninguno de estos tratamientos se encuentra actualmente en uso. En algunos casos, los mAbs han demostrado ser demasiado específicos para tratar enfermedades infecciosas, porque reconocen algunos serovares de un patógeno pero no otros. El uso de un cóctel de mAbs múltiples que se dirigen a diferentes cepas del patógeno puede abordar este problema. Sin embargo, el gran costo asociado con la producción de AcM es otro desafío que ha impedido que los MAbs se vuelvan prácticos para su uso en el tratamiento de infecciones microbianas 1
Una tecnología prometedora para los mAbs económicos es el uso de plantas modificadas genéticamente para producir anticuerpos (o planticuerpos). Esta tecnología transforma las células vegetales en fábricas de anticuerpos en lugar de depender de células de cultivo de tejidos, que son costosas y técnicamente exigentes. En algunos casos, incluso puede ser posible administrar estos anticuerpos haciendo que los pacientes se coman las plantas en lugar de extrayendo e inyectando los anticuerpos. Por ejemplo, en 2013, un grupo de investigación clonó genes de anticuerpos en plantas que tenían la capacidad de neutralizar una toxina importante de bacterias que pueden causar enfermedad gastrointestinal grave. 2 Comer las plantas podría potencialmente entregar los anticuerpos directamente a la toxina.
Ejercicio\(\PageIndex{4}\)
- ¿Cómo se producen los anticuerpos monoclonales humanizados?
- ¿Qué significa el “monoclonal” de los anticuerpos monoclonales?
Uso de anticuerpos monoclonales para combatir el ébola
Durante el brote de ébola 2014-2015 en África Occidental, algunos pacientes infectados por ébola fueron tratados con ZMAPp, un medicamento que había demostrado ser efectivo en ensayos realizados en macacos rhesus solo unos meses antes. 3 ZMAPp es una combinación de tres mAbs producidos mediante la incorporación de los genes de anticuerpos en plantas de tabaco usando un vector viral. Mediante el uso de tres mAbs, el fármaco es efectivo en múltiples cepas del virus. Desafortunadamente, solo había suficiente ZMApp para tratar a un pequeño número de pacientes.
Si bien la tecnología actual no es adecuada para producir grandes cantidades de ZMApp, sí muestra que los plantibodies, los MABs producidos por plantas, son factibles para uso clínico, potencialmente rentables y merecen un mayor desarrollo. En los últimos años se ha visto una explosión en el número de nuevos medicamentos a base de Mab para el tratamiento del cáncer y las enfermedades infecciosas; sin embargo, el uso generalizado de dichos medicamentos se ve inhibido actualmente por su costo exorbitante, especialmente en partes subdesarrolladas del mundo, donde una sola dosis podría costar más que los ingresos de por vida del paciente. El desarrollo de métodos para clonar genes de anticuerpos en plantas podría reducir drásticamente los costos.
Conceptos clave y resumen
- Los anticuerpos se unen con alta especificidad a antígenos utilizados para desafiar al sistema inmune, pero también pueden mostrar reactividad cruzada al unirse a otros antígenos que comparten propiedades químicas con el antígeno original.
- La inyección de un antígeno en un animal dará como resultado una respuesta de anticuerpos policlonales en la que se producen diferentes anticuerpos que reaccionan con los diversos epítopos en el antígeno.
- Los antisueros policlonales son útiles para algunos tipos de ensayos de laboratorio, pero otros requieren más especificidad. Las pruebas diagnósticas que utilizan antisueros policlonales generalmente solo se utilizan para el tamizaje debido a la posibilidad de resultados falsos positivos y falsos negativos.
- Los anticuerpos monoclonales proporcionan mayor especificidad que los antisueros policlonales porque se unen a un único epítopo y suelen tener alta afinidad.
- Los anticuerpos monoclonales se producen típicamente cultivando hibridomas secretores de anticuerpos derivados de ratones. Los mAbs se utilizan actualmente para tratar el cáncer, pero su costo exorbitante ha impedido que se usen más ampliamente para tratar enfermedades infecciosas. Aún así, su potencial para el uso clínico y de laboratorio está impulsando el desarrollo de nuevas soluciones rentables como planticuerpos.
Notas al pie
- 1 Saylor, Carolyn, Ekaterina Dadachova y Arturo Casadevall, “Terapias Monoclonales Basadas en Anticuerpos para Enfermedades Microbianas”, Vacuna 27 (2009): G38-G46.
- 2 Nakanishi, Katsuhiro et al., “Producción de Planticuerpos Híbrido-IgG/IgA con Actividad Neutralizante contra la Toxina Shiga 1”, PLoS One 8, núm. 11 (2013): e80712.
- 3 Qiu, Xiangguo et al., “Reversión de la enfermedad avanzada por el virus del Ébola en primates no humanos con ZMAPp”, Nature 514 (2014): 47—53.


