25.2: Infecciones Bacterianas de los Sistemas Circulatorio y Linfático
- Page ID
- 54869
Objetivos de aprendizaje
- Identificar y comparar las bacterias que más comúnmente causan infecciones de los sistemas circulatorio y linfático
- Comparar las principales características de enfermedades bacterianas específicas que afectan a los sistemas circulatorio y linfático
Las bacterias pueden ingresar a los sistemas circulatorio y linfático a través de infecciones agudas o brechas de la barrera cutánea o mucosa. Las brechas pueden ocurrir a través de ocurrencias bastante comunes, como picaduras de insectos o pequeñas heridas. Incluso el acto de cepillarse los dientes, que puede provocar pequeñas rupturas en las encías, puede introducir bacterias en el sistema circulatorio. En la mayoría de los casos, la bacteriemia que resulta de tales exposiciones comunes es transitoria y permanece por debajo del umbral de detección. En casos severos, la bacteriemia puede llevar a septicemia con complicaciones peligrosas como toxemia, sepsis y shock séptico. En estas situaciones, a menudo es la respuesta inmune a la infección la que da como resultado los signos y síntomas clínicos más que los propios microbios.
Sepsis bacteriana, choque séptico y tóxico
A bajas concentraciones, las citocinas proinflamatorias como la interleucina 1 (IL-1) y el factor de necrosis tumoral α (TNF-α) juegan un papel importante en las defensas inmunitarias del huésped. Sin embargo, cuando circulan sistémicamente en mayores cantidades, la respuesta inmune resultante puede poner en peligro la vida. La IL-1 induce la vasodilatación (ensanchamiento de los vasos sanguíneos) y reduce las uniones estrechas entre las células endoteliales vasculares, lo que lleva a un edema generalizado. A medida que los fluidos salen de la circulación hacia los tejidos, la presión arterial comienza a bajar. Si no se controla, la presión arterial puede caer por debajo del nivel necesario para mantener las funciones renales y respiratorias adecuadas, condición conocida como shock séptico. Además, la liberación excesiva de citocinas durante la respuesta inflamatoria puede conducir a la formación de coágulos sanguíneos. La pérdida de presión arterial y la aparición de coágulos sanguíneos pueden resultar en insuficiencia orgánica múltiple y la muerte.
Las bacterias son los patógenos más comunes asociados con el desarrollo de sepsis y choque séptico. 1 La infección más común asociada a la sepsis es la neumonía bacteriana (ver Infecciones Bacterianas del Tracto Respiratorio), que representa aproximadamente la mitad de todos los casos, seguida de infecciones intraabdominales (Infecciones Bacterianas del Tracto Gastrointestinal) y urinarias infecciones del tracto (Infecciones Bacterianas del Sistema Urinario). 2 Las infecciones asociadas con heridas superficiales, mordeduras de animales y catéteres permanentes también pueden conducir a sepsis y choque séptico.
Estas infecciones localizadas inicialmente menores pueden ser causadas por una amplia gama de bacterias diferentes, incluyendo Staphylococcus, Streptococcus, Pseudomonas, Pasteurella, Acinetobacter y miembros de las Enterobacteriaceae. Sin embargo, si no se trata, las infecciones por estos patógenos grampositivos y gramnegativos pueden progresar potencialmente a sepsis, shock y muerte.
Síndrome de choque tóxico y síndrome de choque tóxico estreptocócico
La toxemia asociada a infecciones causadas por Staphylococcus aureus puede causar síndrome de choque tóxico estafilocócico (SST). Algunas cepas de S. aureus producen un superantígeno llamado síndrome de choque tóxico toxina-1 (TSST-1). El SST puede ocurrir como una complicación de otras infecciones localizadas o sistémicas como neumonía, osteomielitis, sinusitis y heridas cutáneas (quirúrgicas, traumáticas o quemaduras). Las que tienen mayor riesgo de SST estafilocócica son las mujeres con colonización vaginal preexistente por S. aureus que dejan tampones, esponjas anticonceptivas, diafragmas u otros dispositivos en la vagina por más tiempo que el recomendado.
La SST estafilocócica se caracteriza por la aparición repentina de vómitos, diarrea, mialgia, temperatura corporal superior a 38.9 °C (102.0 °F) e hipotensión de inicio rápido con una presión arterial sistólica inferior a 90 mm Hg para adultos; una erupción eritematosa difusa que provoca descamación y desprendimiento de la piel 1 a 2 semanas después inicio; y afectación adicional de tres o más sistemas de órganos. 3 La tasa de mortalidad asociada al SST estafilocócica es menor al 3% de los casos.
El diagnóstico de SST estafilocócica se basa en signos clínicos, síntomas, pruebas serológicas para confirmar especies bacterianas y la detección de producción de toxinas a partir de aislados estafilocócicos. Los cultivos de piel y sangre suelen ser negativos; menos del 5% son positivos en los casos de SST estafilocócica. El tratamiento para la SST estafilocócica incluye descontaminación, desbridamiento, vasopresores para elevar la presión arterial y terapia antibiótica con clindamicina más vancomicina o daptomicina en espera de resultados de susceptibilidad.
Un síndrome con signos y síntomas similares al TSS estafilocócico puede ser causado por Streptococcus pyogenes. Este padecimiento, denominado síndrome de choque tóxico estreptocócico (STSS), se caracteriza por una fisiopatología más severa que el TSS estafilocócico, 4 con alrededor del 50% de los pacientes que desarrollan bacteriemia por S. pyogenes y fascitis necrotizante. A diferencia del TSS estafilocócico, el STSS es más probable que cause el síndrome de distrés respiratorio agudo (SDRA), una enfermedad rápidamente progresiva caracterizada por la acumulación de líquido en los pulmones que inhibe la respiración y causa hipoxemia (bajos niveles de oxígeno en la sangre). El STSS se asocia con una mayor tasa de mortalidad (20% — 60%), incluso con terapia agresiva. El STSS generalmente se desarrolla en pacientes con una infección estreptocócica de tejidos blandos como celulitis bacteriana, fascitis necrotizante, piomiositis (formación de pus en el músculo causada por infección), una infección reciente por influenza A o varicela.
Ejercicio\(\PageIndex{1}\)
¿Cómo pueden conducir grandes cantidades de citocinas proinflamatorias al choque séptico?
A pesar de la terapia con oxacilina, la condición de Bárbara siguió empeorando en los siguientes días. Su fiebre aumentó a 40.1 °C (104.2 °F) y comenzó a experimentar escalofríos, respiración rápida y confusión. Su médico sospechó bacteriemia por una bacteria farmacorresistente e ingresó a Bárbara en el hospital. Cultivos del sitio quirúrgico y sangre revelaron Staphylococcus aureus. Las pruebas de susceptibilidad a antibióticos confirmaron que el aislado era S. aureus resistente a meticilina (SARM). En respuesta, la doctora de Bárbara cambió su terapia antibiótica a vancomicina y dispuso que le quitaran el puerto y el catéter venoso.
Ejercicio\(\PageIndex{2}\)
- ¿Por qué la infección de Barbara no respondió a la terapia con oxacilina?
- ¿Por qué le quitaron el puerto y el catéter al médico?
- Con base en los signos y síntomas descritos, ¿cuáles son algunos posibles diagnósticos para el padecimiento de Bárbara?
Sepsis Puerperal
Un tipo de sepsis llamada sepsis puerperal, también conocida como infección puerperal, fiebre puerperal o fiebre de la cama infantil, es una infección nosocomial asociada al período de puerperio—el tiempo posterior al parto durante el cual el sistema reproductivo de la madre regresa a un estado no embarazada. Dichas infecciones pueden originarse en el tracto genital, mama, tracto urinario o una herida quirúrgica. Inicialmente, la infección puede estar limitada al útero u otro sitio local de infección, pero puede propagarse rápidamente, resultando en peritonitis, septicemia y muerte. Antes de la obra del siglo XIX de Ignaz Semmelweis y la aceptación generalizada de la teoría germinal (ver Fundamentos modernos de la teoría celular), la sepsis puerperal fue una de las principales causas de mortalidad entre las nuevas madres en los primeros días posteriores al parto.
La sepsis puerperal a menudo se asocia con Streptococcus pyogenes, pero muchas otras bacterias también pueden ser responsables. Los ejemplos incluyen bacterias grampositivas (por ejemplo, Streptococcus spp., Staphylococcus spp., y Enterococcus spp.), bacterias gramnegativas (por ejemplo, Chlamydia spp., Escherichia coli, Klebsiella spp., y Proteus spp.), como así como anaerobios como Peptostreptococcus spp., Bacteroides spp., y Clostridium spp. En los casos causados por S. pyogenes, la bacteria se adhiere a los tejidos del huésped utilizando la proteína M y produce una cápsula de carbohidratos para evitar la fagocitosis. S. pyogenes también produce una variedad de exotoxinas, como las exotoxinas pirogénicas estreptocócicas A y B, que se asocian con virulencia y pueden funcionar como superantígenos.
El diagnóstico de fiebre puerperal se basa en el momento y la extensión de la fiebre y el aislamiento, y la identificación del agente etiológico en muestras de sangre, herida u orina. Debido a que existen numerosas causas posibles, se deben utilizar pruebas de susceptibilidad antimicrobiana para determinar el mejor antibiótico para el tratamiento. La incidencia nosocomial de fiebre puerperal se puede reducir considerablemente mediante el uso de antisépticos durante el parto y el estricto cumplimiento de los protocolos de lavado de manos por parte de médicos, parteras y enfermeras.
Artritis Infecciosa
También llamada artritis séptica, la artritis infecciosa puede ser una afección aguda o crónica. La artritis infecciosa se caracteriza por la inflamación de los tejidos articulares y la mayoría de las veces es causada por patógenos bacterianos. La mayoría de los casos de artritis infecciosa aguda son secundarios a bacteriemia, con un inicio rápido de dolor articular moderado a severo e hinchazón que limita el movimiento de la articulación afectada. En adultos y niños pequeños, el patógeno infeccioso con mayor frecuencia se introduce directamente a través de una lesión, como una herida o un sitio quirúrgico, y se lleva a la articulación a través del sistema circulatorio. Las infecciones agudas también pueden ocurrir después de la cirugía de reemplazo articular. La artritis infecciosa aguda a menudo ocurre en pacientes con un sistema inmunitario deteriorado por otras infecciones virales y bacterianas. S. aureus es la causa más común de artritis séptica aguda en la población general de adultos y niños pequeños. Neisseria gonorrhoeae es una causa importante de artritis infecciosa aguda en individuos sexualmente activos.
La artritis infecciosa crónica es responsable del 5% de todos los casos de artritis infecciosa y es más probable que ocurra en pacientes con otras enfermedades o afecciones. Los pacientes en riesgo incluyen aquellos que tienen una infección por VIH, una infección bacteriana o fúngica, articulaciones protésicas, artritis reumatoide (AR) o que están sometidos a quimioterapia inmunosupresora. El inicio suele ser en una sola articulación; puede haber poco o ningún dolor, dolor que puede ser leve, hinchazón gradual, calor leve y enrojecimiento mínimo o nulo de la zona articular.
El diagnóstico de artritis infecciosa requiere la aspiración de una pequeña cantidad de líquido sinovial de la articulación afectada. La evaluación microscópica directa, cultivo, pruebas de susceptibilidad antimicrobiana y análisis de reacción en cadena de la polimerasa (PCR) del líquido sinovial se utilizan para identificar el patógeno potencial. El tratamiento típico incluye la administración de medicamentos antimicrobianos apropiados basados en pruebas de susceptibilidad antimicrobiana. Para cepas bacterianas no resistentes a medicamentos, las β-lactamas como la oxacilina y la cefazolina a menudo se recetan para las infecciones estafilocócicas. Las cefalosporinas de tercera generación (e.g., ceftriaxona) se utilizan para infecciones de Neisseria resistentes a β-lactamas cada vez más prevalentes. Las infecciones por Mycobacterium spp. u hongos se tratan con una terapia antimicrobiana adecuada a largo plazo. Incluso con tratamiento, el pronóstico suele ser malo para los infectados. Alrededor del 40% de los pacientes con artritis infecciosa nongonnocócica sufrirán daño articular permanente y las tasas de mortalidad oscilan entre 5% y 20%. 5 Las tasas de mortalidad son mayores entre los adultos mayores. 6
Osteomielitis
La osteomielitis es una inflamación de los tejidos óseos causada más comúnmente por una infección. Estas infecciones pueden ser agudas o crónicas y pueden involucrar a una variedad de bacterias diferentes. El agente causante más común de la osteomielitis es S. aureus. Sin embargo, M. tuberculosis, Pseudomonas aeruginosa, Streptococcus pyogenes, S. agalactiae, especies de las Enterobacteriaceae y otros microorganismos también pueden causar osteomielitis, dependiendo de qué huesos estén involucrados. En los adultos, las bacterias generalmente obtienen acceso directo a los tejidos óseos a través de un trauma o un procedimiento quirúrgico que involucra articulaciones protésicas. En los niños, las bacterias a menudo se introducen desde el torrente sanguíneo, posiblemente propagándose a partir de infecciones focales. Los huesos largos, como el fémur, son más comúnmente afectados en los niños debido a la vascularización más extensa de los huesos en los jóvenes. 7
Los signos y síntomas de la osteomielitis incluyen fiebre, dolor localizado, hinchazón por edema y úlceras en tejidos blandos cerca del sitio de infección. La inflamación resultante puede provocar daño tisular y pérdida ósea. Además, la infección puede extenderse a las articulaciones, dando como resultado artritis infecciosa, o diseminarse a la sangre, resultando en sepsis y trombosis (formación de coágulos sanguíneos). Al igual que la artritis séptica, la osteomielitis generalmente se diagnostica mediante una combinación de radiografía, imágenes e identificación de bacterias de hemocultivos, o de cultivos óseos si los cultivos de sangre son negativos. La terapia antibiótica parenteral se usa típicamente para tratar la osteomielitis. Sin embargo, debido a la cantidad de diferentes agentes etiológicos posibles, se podrían usar diversos fármacos. Los fármacos antibacterianos de amplio espectro como nafcilina, oxacilina o cefalosporina se suelen recetar para la osteomielitis aguda, y ampicilina y piperacilina/tazobactama para la osteomielitis crónica. En casos de resistencia a antibióticos, a veces se requiere tratamiento con vancomicina para controlar la infección. En casos graves, es posible que se requiera cirugía para extirpar el sitio de infección. Otras formas de tratamiento incluyen la oxigenoterapia hiperbárica (ver Uso de métodos físicos para controlar microorganismos) y la implantación de perlas o bombas antibióticas.
Ejercicio\(\PageIndex{3}\)
¿Cuál bacteria es la causa más común tanto de artritis séptica como de osteomielitis?
Fiebre Reumática
Las infecciones con S. pyogenes tienen una variedad de manifestaciones y complicaciones generalmente llamadas secuelas. Como se mencionó, la bacteria puede causar infecciones supurativas como fiebre puerperal. Sin embargo, este microbio también puede causar secuelas no supurativas en forma de fiebre reumática aguda (IRA), lo que puede conducir a cardiopatía reumática, impactando así el sistema circulatorio. La fiebre reumática ocurre principalmente en niños un mínimo de 2—3 semanas después de un episodio de faringitis no tratada o inadecuadamente tratada (ver Infecciones Bacterianas del Tracto Respiratorio). En un momento, la fiebre reumática fue un asesino importante de niños en EU; hoy, sin embargo, es poco frecuente en EU debido al diagnóstico precoz y tratamiento de la faringitis estreptocócica con antibióticos. En partes del mundo donde el diagnóstico y el tratamiento no están fácilmente disponibles, la fiebre reumática aguda y la cardiopatía reumática siguen siendo las principales causas de mortalidad en los niños. 8
La fiebre reumática se caracteriza por una variedad de signos y síntomas diagnósticos causados por daño no supurativo, mediado por el sistema inmune, resultante de una reacción cruzada entre los anticuerpos del paciente contra las proteínas de la superficie bacteriana y proteínas similares que se encuentran en los tejidos cardíacos, neuronales y sinoviales. El daño al tejido nervioso o las articulaciones, lo que provoca dolor e hinchazón en las articulaciones, es reversible. Sin embargo, el daño a las válvulas cardíacas puede ser irreversible y se ve agravado por episodios repetidos de fiebre reumática aguda, particularmente durante los primeros 3—5 años después del primer ataque de fiebre reumática. La inflamación de las válvulas cardíacas causada por anticuerpos de reacción cruzada conduce a la cicatrización y rigidez de las valvas valvulares. Esto, a su vez, produce un soplo cardíaco característico. Los pacientes que han desarrollado previamente fiebre reumática y que posteriormente desarrollan faringitis recurrente por S. pyogenes tienen un alto riesgo de sufrir ataques recurrentes de fiebre reumática.
La American Heart Association recomienda 9 un régimen de tratamiento que consiste en benzatina bencilpenicilina cada 3 o 4 semanas, dependiendo del riesgo del paciente de reinfección. Se puede recomendar un tratamiento antibiótico profiláctico adicional según la edad del paciente y el riesgo de reinfección.
Endocarditis bacteriana y pericarditis
El endocardio es una capa de tejido que recubre los músculos y las válvulas del corazón. Este tejido puede infectarse por una variedad de bacterias, incluyendo cocos grampositivos como Staphylococcus aureus, estreptococos viridans y Enterococcus faecalis, y los llamados bacilos gramnegativos HACEK: Haemophilus spp., Actinobacillus actinomicetemcomitans, Cardiobacterium hominis, Eikenella corrodens y Kingella kingae. La inflamación resultante se llama endocarditis, que puede describirse como aguda o subaguda. Los agentes causantes generalmente ingresan al torrente sanguíneo durante brechas accidentales o intencionales en las defensas de barrera normales (por ejemplo, procedimientos dentales, perforaciones corporales, cateterismo, heridas). Los individuos con daño cardíaco preexistente, válvulas protésicas y otros dispositivos cardíacos, y aquellos con antecedentes de fiebre reumática tienen un mayor riesgo de endocarditis. Esta enfermedad puede destruir rápidamente las válvulas cardíacas y, si no se trata, llevar a la muerte en tan solo unos días.
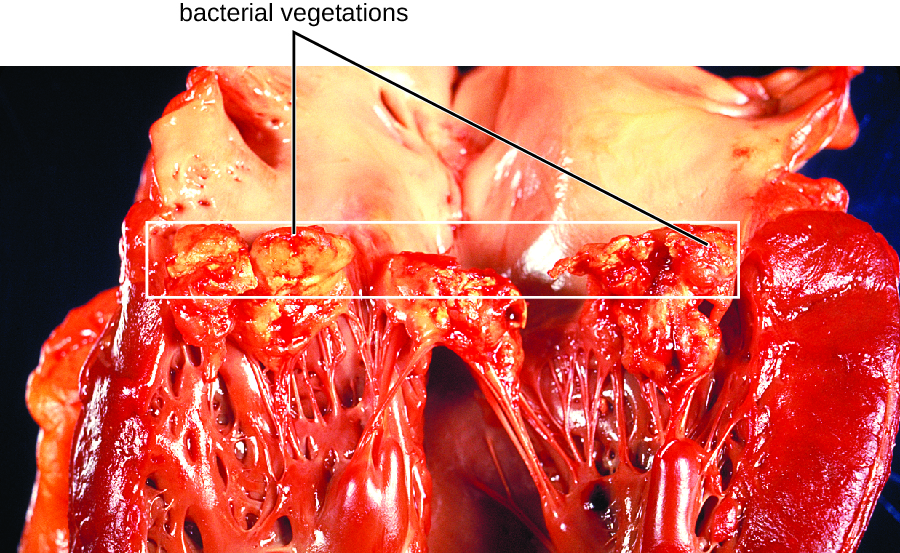
En la endocarditis bacteriana subaguda, el daño valvular cardíaco ocurre lentamente durante un periodo de meses. Durante este tiempo, se forman coágulos de sangre en el corazón, y estos protegen a las bacterias de los fagocitos. Estos parches de bacterias asociadas a tejidos se llaman vegetaciones. El daño resultante al corazón, en parte resultante de la respuesta inmune que causa fibrosis de las válvulas cardíacas, puede requerir un reemplazo valvular cardíaco (Figura\(\PageIndex{1}\)). Los signos exteriores de endocarditis subaguda pueden incluir fiebre.
El diagnóstico de endocarditis infecciosa se determina mediante la combinación de hemocultivos, ecocardiograma y síntomas clínicos. Tanto en la endocarditis aguda como en la subaguda, el tratamiento generalmente implica dosis relativamente altas de antibióticos intravenosos según lo determinado por pruebas de susceptibilidad antimicrobiana. La endocarditis aguda a menudo se trata con una combinación de ampicilina, nafcilina y gentamicina para una cobertura sinérgica de Staphylococcus spp. y Streptococcus spp. La endocarditis valvular protésica a menudo se trata con una combinación de vancomicina, rifampina y gentamicina. La rifampina es necesaria para tratar individuos con infección de válvulas protésicas u otros cuerpos extraños porque la rifampina puede penetrar en la biopelícula de la mayoría de los patógenos que infectan estos dispositivos.
Staphylcoccus spp. y Streptococcus spp. también pueden infectar y causar inflamación en los tejidos que rodean el corazón, una afección llamada pericarditis aguda. La pericarditis está marcada por dolor torácico, dificultad para respirar y tos seca. En la mayoría de los casos, la pericarditis es autolimitante y no es necesaria la intervención clínica. El diagnóstico se realiza con la ayuda de una radiografía de tórax, electrocardiograma, ecocardiograma, aspirado de líquido pericárdico o biopsia de pericardio. Se pueden recetar medicamentos antibacterianos para infecciones asociadas con pericarditis; sin embargo, la pericarditis también puede ser causada por otros patógenos, incluyendo virus (por ejemplo, ecovirus, virus de la influenza), hongos (por ejemplo, Histoplasma spp., Coccidioides spp.) y parásitos eucariotas (p. ej., Toxoplasma spp.).
Ejercicio\(\PageIndex{4}\)
Comparar endocarditis bacteriana aguda y subaguda.
Gangrena de gas
Las lesiones traumáticas o ciertas afecciones médicas, como la diabetes, pueden causar daños en los vasos sanguíneos que interrumpen el flujo sanguíneo a una región del cuerpo. Cuando se interrumpe el flujo sanguíneo, los tejidos comienzan a morir, creando un ambiente anaeróbico en el que las bacterias anaeróbicas pueden prosperar. Esta condición se llama isquemia. Las endosporas de la bacteria anaerobia Clostridium perfringens (junto con otras Clostridium spp. del intestino) pueden germinar fácilmente en los tejidos isquémicos y colonizar los tejidos anaerobios.
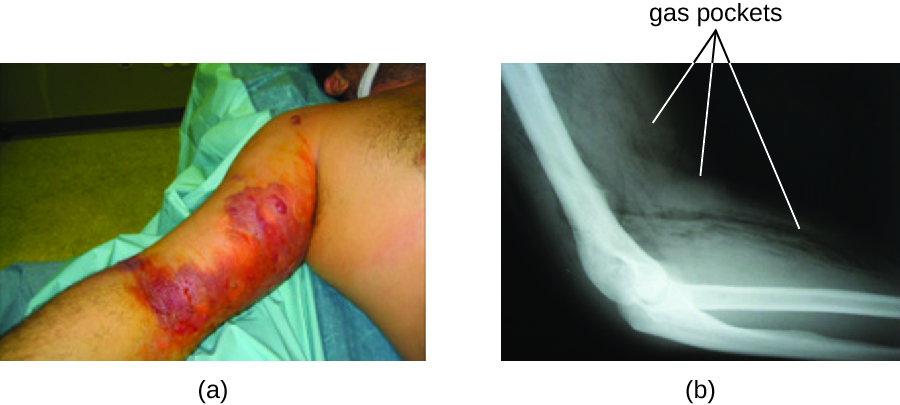
La infección resultante, llamada gangrena gaseosa, se caracteriza por una mionecrosis que se propaga rápidamente (muerte del tejido muscular). El paciente experimenta un inicio repentino de dolor insoportable en el sitio de la infección y el rápido desarrollo de una herida maloliente que contiene burbujas de gas y una secreción delgada y amarillenta teñida con una pequeña cantidad de sangre. A medida que avanza la infección, se forman edema y ampollas cutáneas que contienen líquido azulado púrpura. El tejido infectado se licua y comienza a desprenderse. El margen entre el tejido necrótico y el tejido sano a menudo avanza varias pulgadas por hora incluso con la terapia antibiótica. El choque séptico y la insuficiencia orgánica acompañan frecuentemente a la gangrena gaseosa; cuando los pacientes desarrollan sepsis, la tasa de mortalidad es mayor al 50%.
La toxina α y la toxina theta (θ) son los principales factores de virulencia de C. perfringens implicados en la gangrena gaseosa. La toxina α es una lipasa responsable de descomponer las membranas celulares; también provoca la formación de trombos (coágulos sanguíneos) en los vasos sanguíneos, contribuyendo a la propagación de la isquemia. poros en las membranas celulares del paciente, causando lisis celular. El gas asociado a la gangrena gaseosa es producido por la fermentación de Clostridium de ácido butírico, que produce hidrógeno y dióxido de carbono que se liberan a medida que las bacterias se multiplican, formando bolsas de gas en los tejidos (Figura\(\PageIndex{2}\)).
La gangrena gaseosa se diagnostica inicialmente con base en la presencia de los signos y síntomas clínicos descritos anteriormente en esta sección. El diagnóstico se puede confirmar mediante tinción de Gram y cultivo anaeróbico de exudado de herida (drenaje) y muestras de tejido en agar sanguíneo. El tratamiento generalmente implica el desbridamiento quirúrgico de cualquier tejido necrótico; los casos avanzados pueden requerir amputación. Los cirujanos también pueden usar el cierre asistido por vacío (VAC), una técnica quirúrgica en la que el drenaje asistido por vacío se usa para extraer sangre o líquido seroso de una herida o sitio quirúrgico para acelerar la recuperación. Los tratamientos antibióticos más comunes incluyen penicilina G y clindamicina. Algunos casos también se tratan con oxigenoterapia hiperbárica debido a que Clostridium spp. es incapaz de sobrevivir en ambientes ricos en oxígeno.
Tularemia
La infección por la bacteria gramnegativa Francisella tularensis causa tularemia (o fiebre del conejo), una infección zoonótica en humanos. F. tularensis es un parásito intracelular facultativo que causa principalmente enfermedades en conejos, aunque una gran variedad de animales domesticados también son susceptibles a la infección. Los seres humanos pueden infectarse a través de la ingestión de carne contaminada o, más típicamente, manejo de tejidos animales infectados (por ejemplo, desollar un conejo infectado). La tularemia también puede transmitirse por las picaduras de artrópodos infectados, incluyendo la garrapata del perro (Dermacentor variabilis), la garrapata estrella solitaria (Amblyomma americanum), la garrapata de la madera (Dermacentor andersoni) y las moscas de los ciervos (Chrysops spp.). Aunque la enfermedad no es directamente transmisible entre humanos, la exposición a aerosoles de F. tularensis puede resultar en infecciones potencialmente mortales. F. tularensis es altamente contagiosa, con una dosis infecciosa de tan solo 10 células bacterianas. Además, las infecciones pulmonares tienen una tasa de mortalidad del 30% — 60% si no se tratan. 10 Por estas razones, F. tularensis está actualmente clasificada y debe ser manejada como organismo de bioseguridad nivel-3 (BSL-3) y como potencial agente de guerra biológica.
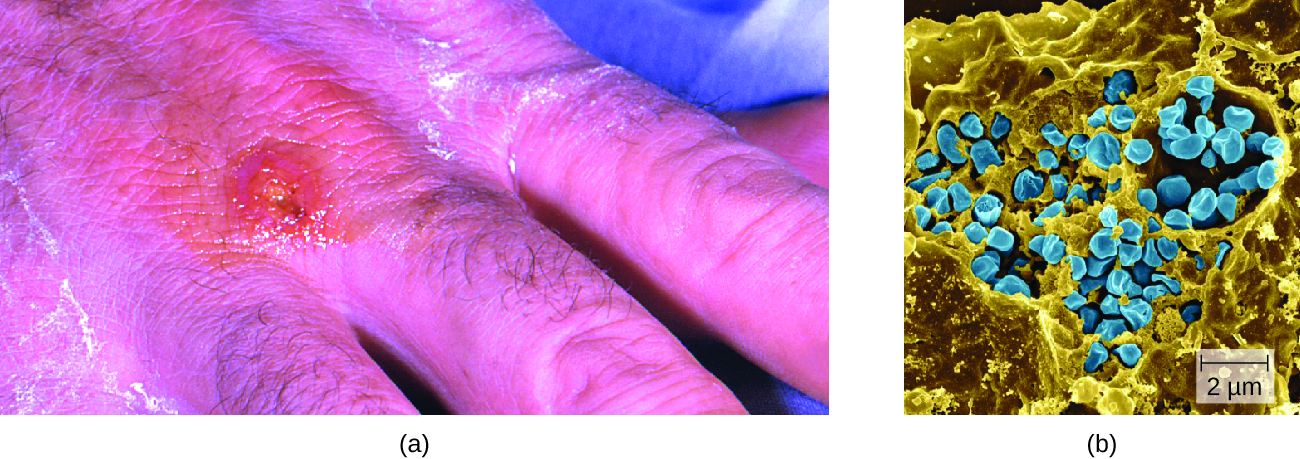
Tras la introducción a través de una rotura en la piel, las bacterias inicialmente se trasladan a los ganglios linfáticos, donde son ingeridas por los fagocitos. Después de escapar del fagosoma, las bacterias crecen y se multiplican intracelularmente en el citoplasma de los fagocitos. Posteriormente pueden diseminarse a través de la sangre a otros órganos como el hígado, los pulmones y el bazo, donde producen masas de tejido llamadas granulomas (Figura\(\PageIndex{3}\)). Después de un periodo de incubación de aproximadamente 3 días, se desarrollan lesiones cutáneas en el sitio de infección. Otros signos y síntomas incluyen fiebre, escalofríos, dolor de cabeza y ganglios linfáticos inflamados y dolorosos.
Un diagnóstico directo de tularemia es un reto porque es muy contagiosa. Una vez realizado el diagnóstico presuntivo de tularemia, se requiere un manejo especial para recolectar y procesar especímenes de pacientes para prevenir la infección de los trabajadores de la salud. Los especímenes sospechosos de contener F. tularensis solo pueden ser manejados por laboratorios BSL-2 o BSL-3 registrados en el Programa Federal Select Agent, y las personas que manejen el espécimen deben usar equipo de protección y usar un gabinete de seguridad biológica clase II.
La tularemia es relativamente rara en Estados Unidos, y sus signos y síntomas son similares a una variedad de otras infecciones que pueden necesitar descartarse antes de que se pueda hacer un diagnóstico. El examen microscópico de anticuerpos fluorescentes-directos (DFA) con anticuerpos específicos para F. tularensis puede confirmar rápidamente la presencia de este patógeno. Cultivar este microbio es difícil debido a su requerimiento para el aminoácido cisteína, el cual debe ser suministrado como nutriente extra en los medios de cultivo. Se dispone de pruebas serológicas para detectar una respuesta inmune contra el patógeno bacteriano. En pacientes con sospecha de infección, se requieren muestras de suero en fase aguda y convaleciente para confirmar una infección activa. Las pruebas basadas en PCR también se pueden usar para la identificación clínica de especímenes directos de fluidos o tejidos corporales, así como especímenes cultivados. En la mayoría de los casos, el diagnóstico se basa en hallazgos clínicos y probables incidentes de exposición a la bacteria. Los antibióticos estreptomicina, gentamicina, doxiciclina y ciprofloxacino son efectivos en el tratamiento de la tularemia.
Brucelosis
Las especies del género Brucella son patógenos intracelulares facultativos gramnegativos que aparecen como coccobacilos. Varias especies causan infecciones zoonóticas en animales y humanos, cuatro de las cuales tienen una patogenicidad humana significativa: B. abortus de bovinos y búfalos, B. canis de perros, B. suis de cerdos y B. melitensis de cabras, ovejas y camellos. Las infecciones por estos patógenos se llaman brucelosis, también conocida como fiebre ondulante, “fiebre mediterránea” o “fiebre de Malta”. La vacunación de animales ha hecho de la brucelosis una enfermedad rara en Estados Unidos, pero sigue siendo común en el Mediterráneo, Asia meridional y central, América Central y del Sur, y el Caribe. Las infecciones humanas se asocian principalmente con la ingestión de carne o productos lácteos no pasteurizados de animales infectados. La infección también puede ocurrir por inhalación de bacterias en aerosoles al manipular productos animales, o por contacto directo con heridas en la piel. En Estados Unidos, la mayoría de los casos de brucelosis se encuentran en individuos con exposición extensa a animales potencialmente infectados (por ejemplo, trabajadores de mataderos, veterinarios).
Dos factores importantes de virulencia producidos por Brucella spp. son la ureasa, que permite que las bacterias ingeridas eviten la destrucción por el ácido estomacal, y el lipopolisacárido (LPS), que permite que las bacterias sobrevivan dentro de los fagocitos. Después de ingresar a los tejidos, las bacterias son fagocitadas por neutrófilos y macrófagos del huésped. Las bacterias luego escapan del fagosoma y crecen dentro del citoplasma de la célula. Las bacterias fagocitadas por los macrófagos se diseminan por todo el cuerpo. Esto da como resultado la formación de granulomas dentro de muchos sitios del cuerpo, incluyendo hueso, hígado, bazo, pulmón, tracto genitourinario, cerebro, corazón, ojo y piel. Las infecciones agudas pueden provocar fiebre ondulante (recidivante), pero las infecciones no tratadas se convierten en una enfermedad crónica que generalmente se manifiesta como enfermedad febril aguda (fiebre de 40—41 °C [104—105.8 °F]) con signos y síntomas recurrentes similares a la gripe.
Brucella solo se encuentra de manera confiable en la sangre durante la etapa de fiebre aguda; es difícil de diagnosticar por cultivo. Además, Brucella es considerada un patógeno BSL-3 y es peligrosa de manejar en el laboratorio clínico sin ropa protectora y al menos un gabinete de seguridad biológica clase II. Las pruebas de aglutinación se utilizan con mayor frecuencia para el serodiagnóstico. Además, se dispone de ensayos inmunoadsorbentes ligados a enzimas (ELISA) para determinar la exposición al organismo. Los antibióticos doxiciclina o ciprofloxacina se prescriben típicamente en combinación con rifampicina; gentamicina, estreptomicina y trimetoprim-sulfametoxazol (TMP-SMZ) también son efectivos contra las infecciones por Brucella y pueden usarse si es necesario.
Ejercicio\(\PageIndex{5}\)
Comparar la patogenia de tularemia y brucelosis.
Enfermedad por arañazo de gato
La zoonosis por arañazo de gato (CSD) (o fiebre por arañazo de gato) es una infección bacteriana que se puede introducir en los ganglios linfáticos cuando un ser humano es mordido o arañado por un gato. Es causada por la bacteria gramnegativa intracelular facultativa Bartonella henselae. Los gatos pueden infectarse a partir de heces de pulgas que contienen B. henselae que ingieren mientras se acicalan. Los humanos se infectan cuando se introducen heces de pulgas o saliva de gato (de garras o lamer) que contiene B. henselae en el sitio de una mordedura o rasguño. Una vez introducido en una herida, B. henselae infecta los glóbulos rojos.
La invasión de glóbulos rojos por B. henselae se ve facilitada por adhesinas asociadas a proteínas de la membrana externa y un sistema de secreción que media el transporte de factores de virulencia a la célula hospedadora. Se indica evidencia de infección si se forma un pequeño nódulo con pus en la ubicación del rasguño 1 a 3 semanas después de la lesión inicial. Las bacterias luego migran a los ganglios linfáticos más cercanos, donde causan hinchazón y dolor. Los signos y síntomas también pueden incluir fiebre, escalofríos y fatiga. La mayoría de las infecciones son leves y tienden a ser autolimitantes. Sin embargo, los pacientes inmunocomprometidos pueden desarrollar angiomatosis bacilar (BA), caracterizada por la proliferación de vasos sanguíneos, dando como resultado la formación de masas similares a tumores en la piel y órganos internos; o peliosis bacilar (PA), caracterizada por múltiples cavidades similares a quistes, llenas de sangre en el hígado y bazo. La mayoría de los casos de CSD se pueden prevenir manteniendo a los gatos libres de pulgas y limpiando rápidamente un rasguño de gato con jabón y agua tibia.
El diagnóstico de CSD es difícil porque la bacteria no crece fácilmente en el laboratorio. Cuando sea necesario, se pueden realizar inmunofluorescencia, pruebas serológicas, PCR y secuenciación génica para identificar las especies bacterianas. Dada la naturaleza limitada de estas infecciones, normalmente no se prescriben antibióticos. Para los pacientes inmunodeprimidos, rifampicina, azitromicina, ciprofloxacino, gentamicina (intramuscular) o TMP-SMZ son generalmente las opciones más efectivas.
Fiebre por mordida de rata
La infección zoonótica por fiebre por mordedura de rata puede ser causada por dos bacterias gramnegativas diferentes: Streptobacillus moniliformis, que es más común en Norteamérica, y Spirillum minor, que es más común en Asia. Debido a los esfuerzos modernos de saneamiento, las mordeduras de ratas son raras en Estados Unidos. Sin embargo, el contacto con fomitos, alimentos o agua contaminados por heces de rata o fluidos corporales también puede causar infecciones. Los signos y síntomas de la fiebre por mordedura de rata incluyen fiebre, vómitos, mialgia (dolor muscular), artralgia (dolor articular) y erupción maculopapular en manos y pies. También se puede formar una úlcera en el sitio de una picadura, junto con cierta hinchazón de los ganglios linfáticos cercanos. En la mayoría de los casos, la infección es autolimitante. Poco se sabe sobre los factores de virulencia que contribuyen a estos signos y síntomas de la enfermedad.
El cultivo celular, la espectrometría de masas MALDI-TOF, PCR o ELISA se pueden utilizar en la identificación de Streptobacillus moniliformis. El diagnóstico de Spirillum minor puede confirmarse mediante observación microscópica directa de los patógenos en la sangre usando manchas de Giemsa o Wright, o microscopía de campo oscuro. Las pruebas serológicas se pueden utilizar para detectar una respuesta inmune del huésped a los patógenos después de aproximadamente 10 días. Los antibióticos más utilizados para tratar estas infecciones son la penicilina o la doxiciclina.
Plaga
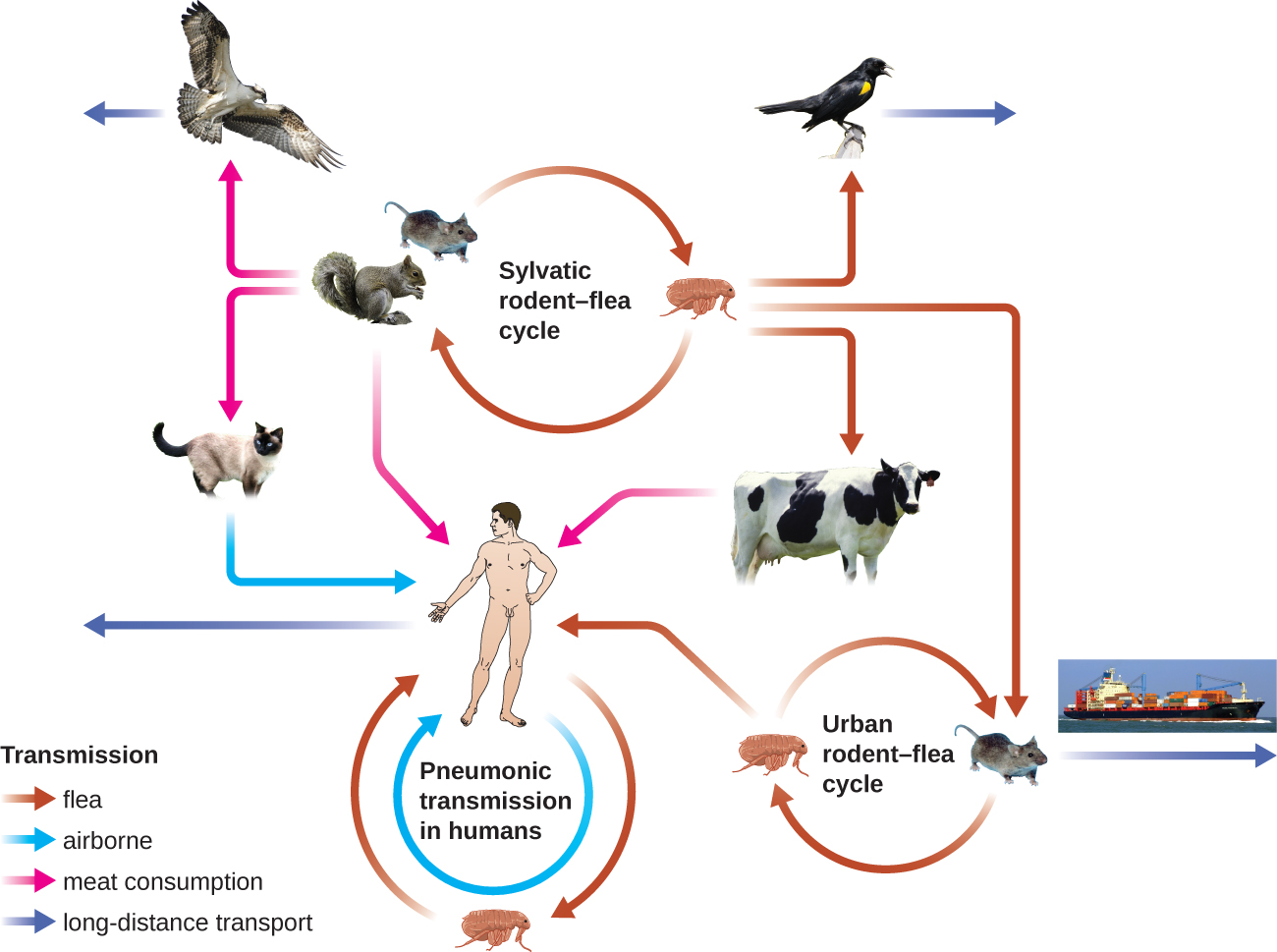
El bacilo gramnegativo Yersinia pestis causa la plaga de infección zoonótica. Esta bacteria causa enfermedad febril aguda en animales, generalmente roedores u otros pequeños mamíferos, y humanos. La enfermedad se asocia con una alta tasa de mortalidad si no se trata. Históricamente, Y. pestis ha sido responsable de varias pandemias devastadoras, que han resultado en millones de muertes (ver Micro Conexiones: La historia de la peste). Hay tres formas de peste: peste bubónica (la forma más común, que representa alrededor del 80% de los casos), peste neumónica y peste septicémica. Estas formas se diferencian por el modo de transmisión y el sitio inicial de infección. La figura\(\PageIndex{4}\) ilustra estos diversos modos de transmisión e infección entre animales y humanos.
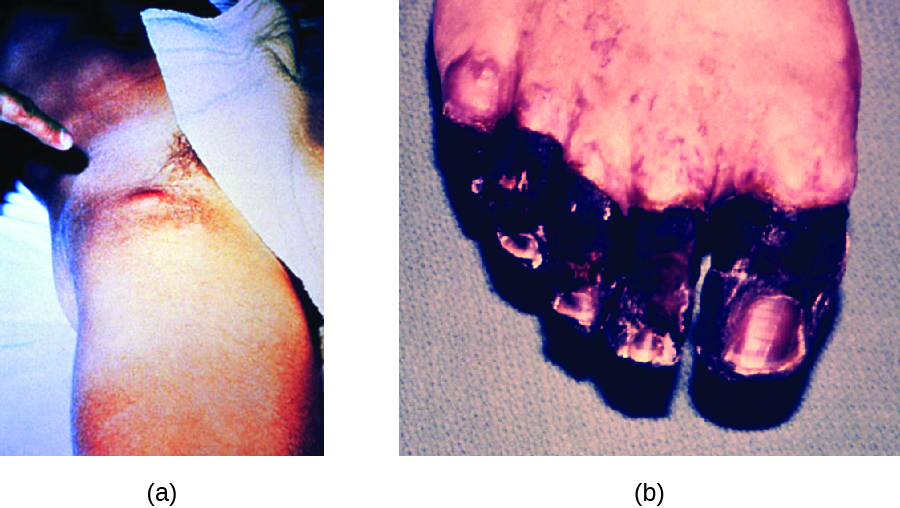
En la peste bubónica, Y. pestis es transferida por la picadura de pulgas infectadas. Dado que la mayoría de las picaduras de pulgas ocurren en las piernas y tobillos, Y. pestis a menudo se introduce en los tejidos y la circulación sanguínea en las extremidades inferiores. Después de un periodo de incubación de 2 a 6 días, los pacientes experimentan fiebre de inicio abrupto (39.5—41 °C [103.1—105.8 °F]), dolor de cabeza, hipotensión y escalofríos. El patógeno se localiza en los ganglios linfáticos, donde causa inflamación, hinchazón y hemorragia que resulta en bubones morados (Figura\(\PageIndex{5}\)). Las bubones a menudo se forman primero en los ganglios linfáticos de la ingle porque estos son los ganglios asociados con las extremidades inferiores; eventualmente, a través de la circulación en la sangre y la linfa, los ganglios linfáticos de todo el cuerpo se infectan y forman bubones. La tasa promedio de mortalidad por peste bubónica es de aproximadamente 55% si no se trata y de aproximadamente 10% con tratamiento antibiótico.
La peste septicémica ocurre cuando Y. pestis se introduce directamente en el torrente sanguíneo a través de un corte o herida y circula por el cuerpo. El periodo de incubación de la peste septicémica es de 1 a 3 días, después de lo cual los pacientes desarrollan fiebre, escalofríos, debilidad extrema, dolor abdominal y shock. También puede ocurrir coagulación intravascular diseminada (CID), dando como resultado la formación de trombos que obstruyen los vasos sanguíneos y promueven isquemia y necrosis en los tejidos circundantes (Figura\(\PageIndex{5}\)). La necrosis ocurre con mayor frecuencia en extremidades como dedos de manos y pies, que se ennegrecen. La peste septicémica puede llevar rápidamente a la muerte, con una tasa de mortalidad cercana al 100% cuando no se trata. Incluso con tratamiento antibiótico, la tasa de mortalidad es de aproximadamente 50%.
La peste neumónica ocurre cuando Y. pestis provoca una infección de los pulmones. Esto puede ocurrir a través de la inhalación de gotitas aerosolizadas de un individuo infectado o cuando la infección se propaga a los pulmones desde otra parte del cuerpo en pacientes con peste bubónica o septicémica. Después de un período de incubación de 1 a 3 días, los signos y síntomas incluyen fiebre, dolor de cabeza, debilidad y una neumonía de rápido desarrollo con dificultad para respirar, dolor en el pecho y tos produciendo moco sanguinolento o acuoso. La neumonía puede ocasionar insuficiencia respiratoria rápida y shock. La peste neumónica es la única forma de peste que se puede propagar de persona a persona por gotitas de aerosol infecciosas. Si no se trata, la tasa de mortalidad es cercana al 100%; con tratamiento antibiótico, la tasa de mortalidad es de aproximadamente 50%.
La alta tasa de mortalidad por la peste es, en parte, consecuencia de estar inusualmente bien equipada con factores de virulencia. A la fecha, existen al menos 15 diferentes factores principales de virulencia que se han identificado a partir de Y. pestis y, de estos, ocho están involucrados con la adherencia a las células hospedadoras. Además, el componente F1 de la cápsula de Y. pestis es un factor de virulencia que permite a la bacteria evitar la fagocitosis. F1 se produce en grandes cantidades durante la infección de mamíferos y es el componente más inmunogénico. 11 El uso exitoso de factores de virulencia permite que los bacilos se diseminen desde el área de la picadura a los ganglios linfáticos regionales y eventualmente a la totalidad de la sangre y los sistemas linfáticos.
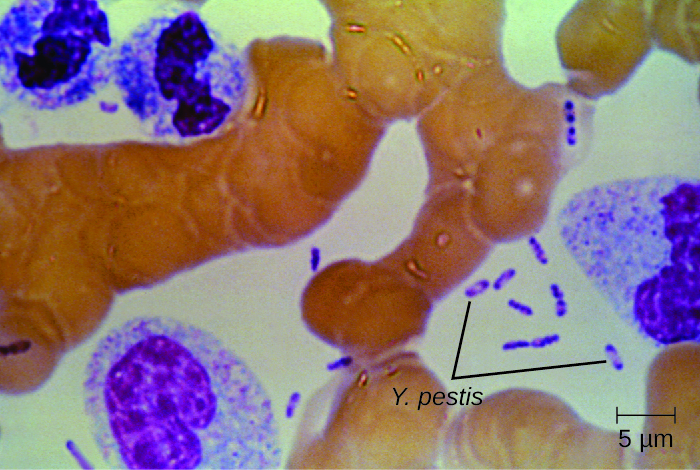
El cultivo y el examen microscópico directo de una muestra de líquido de un bubo, sangre o esputo es la mejor manera de identificar a Y. pestis y confirmar un diagnóstico presuntivo de peste. Los especímenes se pueden teñir usando una técnica de tinción de Gram, Giemsa, Wright o Wayson (Figura\(\PageIndex{6}\)). Las bacterias muestran un patrón característico de tinción bipolar, parecido a imperdibles, que facilita la identificación presuntiva. Se pueden utilizar pruebas de anticuerpos fluorescentes directos (prueba rápida de antígenos de membrana externa) y pruebas serológicas como ELISA para confirmar el diagnóstico. El método confirmatorio para identificar aislados de Y. pestis en Estados Unidos es la lisis de bacteriófagos.
La terapia antibiótica inmediata puede resolver la mayoría de los casos de peste bubónica, pero la peste septicémica y neumónica son más difíciles de tratar debido a sus etapas de incubación más cortas. La supervivencia a menudo depende de un diagnóstico precoz y preciso y de una elección adecuada de la terapia antibiótica. En Estados Unidos, los antibióticos más comunes utilizados para tratar a los pacientes con peste son gentamicina, fluoroquinolonas, estreptomicina, levofloxacino, ciprofloxacino y doxiciclina.
Ejercicio\(\PageIndex{6}\)
Compara la peste bubónica, la peste septicémica y la peste neumónica.
Micro Conexiones: La Historia de la Peste
La primera pandemia de peste registrada, la peste justiniana, ocurrió en el siglo VI d. C. Se cree que se originó en África central y se extendió al Mediterráneo a través de rutas comerciales. En su apogeo, más de 5 mil personas murieron al día tan solo en Constantinopla. En última instancia, un tercio de la población de esa ciudad sucumbió a la peste. 12 El impacto de este brote probablemente contribuyó a la posterior caída del emperador Justiniano.
La segunda gran pandemia, apodada la Peste Negra, ocurrió durante el siglo XIV. Esta vez, se cree que las infecciones se originaron en algún lugar de Asia antes de ser transportadas a Europa por el comercio, los soldados y los refugiados de guerra. Este brote mató a una cuarta parte de la población de Europa (25 millones, principalmente en las principales ciudades). Además, se cree que al menos otros 25 millones han sido asesinados en Asia y África. 13 Esta segunda pandemia, asociada a la cepa Yersinia pestis biovar Medievalis, cicló durante otros 300 años en Europa y Gran Bretaña, y fue llamada la Gran Peste en la década de 1660.
La pandemia más reciente ocurrió en la década de 1890 con Yersinia pestis biovar Orientalis. Este brote se originó en la provincia china de Yunnan y se extendió a nivel mundial a través del comercio. Es en este momento cuando la plaga se abrió camino hacia EU. El agente etiológico de la peste también fue descubierto por Alexandre Yersin (1863—1943) durante este brote. El número general de muertes fue menor que en brotes anteriores, tal vez por la mejora del saneamiento y el apoyo médico. 14 La mayoría de las muertes atribuidas a esta pandemia final ocurrieron en la India.
Visite este enlace para ver un artículo que describe cuán similar es el genoma de la bacteria Black Death a las cepas actuales de peste bubónica.
Enfermedades febriles zoonóticas
Una amplia variedad de enfermedades febriles zoonóticas (enfermedades que causan fiebre) son causadas por bacterias patógenas que requieren vectores artrópodos. Estos patógenos son especies intracelulares obligadas de Anaplasma, Bartonella, Ehrlichia, Orientia y Rickettsia, o espiroquetas del género Borrelia. El aislamiento e identificación de patógenos en este grupo se realiza mejor en laboratorios BSL-3 debido a la baja dosis infecciosa asociada a las enfermedades.
Anaplasmosis
La enfermedad zoonótica transmitida por garrapatas La anaplasmosis granulocítica humana (HGA) es causada por el patógeno intracelular obligado Anaplasma phagocytophilum. El HGA es endémico principalmente en el centro y noreste de Estados Unidos y en países de Europa y Asia.
El HGA suele ser una enfermedad febril leve que causa síntomas similares a la gripe en pacientes inmunocompetentes; sin embargo, los síntomas son lo suficientemente graves como para requerir hospitalización en al menos el 50% de las infecciones y, de esos pacientes, menos del 1% morirá de HGA. 15 Pequeños mamíferos como ratones de patas blancas, ardillas y topillos han sido identificados como reservorios de A. phagocytophilum, que se transmite por la picadura de una garrapata Ixodes. Cinco factores principales de virulencia 16 han sido reportados en Anaplasma; tres son factores de adherencia y dos son factores que permiten al patógeno evitar la respuesta inmune humana. Los enfoques diagnósticos incluyen la localización de microcolonias intracelulares de Anaplasma a través del examen microscópico de neutrófilos o eosinófilos teñidos con tinción de Giemsa o Wright, PCR para la detección de A. phagocytophilum y pruebas serológicas para detectar títulos de anticuerpos contra el patógenos. El principal antibiótico utilizado para el tratamiento es la doxiciclina.
Ehrlichiosis
La ehrlichiosis monocitotrópica humana (HME) es una enfermedad zoonótica transmitida por garrapatas causada por el BSL-2, patógeno intracelular obligado Ehrlichia chaffeensis. Actualmente, la distribución geográfica de HME es principalmente la mitad oriental de EU, con algunos casos reportados en Occidente, lo que corresponde a la distribución geográfica conocida del vector primario, la garrapata estrella solitaria (Amblyomma americanum). Los síntomas de HME son similares a los síntomas similares a los de la gripe observados en la anaplasmosis, pero una erupción es más común, con el 60% de los niños y menos del 30% de los adultos que desarrollan erupciones petequiales, mácula y maculopapulares. 17 Los factores de virulencia permiten que E. chaffeensis se adhiera e infecte monocitos, formando microcolonias intracelulares en monocitos que son diagnósticos para el HME. El diagnóstico de HME se puede confirmar con PCR y pruebas serológicas. El tratamiento de primera línea para adultos y niños de todas las edades con HME es la doxiciclina.
Tifus epidémico
La enfermedad epidémica tifus es causada por Rickettsia prowazekii y se transmite por piojos del cuerpo, Pediculus humanus. Las ardillas voladoras son reservorios animales de R. prowazekii en Norteamérica y también pueden ser fuentes de piojos capaces de transmitir el patógeno. El tifus epidémico se caracteriza por fiebre alta y dolores corporales que duran aproximadamente 2 semanas. Se desarrolla una erupción en el abdomen y el pecho e irradia a las extremidades. Los casos graves pueden provocar la muerte por shock o daños en los tejidos cardíacos y cerebrales. Los humanos infectados son un reservorio importante para esta bacteria porque R. prowazekii es la única Rickettsia que puede establecer un estado portador crónico en humanos.
El tifus epidémico ha jugado un papel importante en la historia de la humanidad, provocando grandes brotes con altas tasas de mortalidad en tiempos de guerra o adversidad. Durante la Primera Guerra Mundial, el tifus epidémico mató a más de 3 millones de personas en el frente oriental. 18 Con la llegada de insecticidas efectivos y la mejora de la higiene personal, el tifus epidémico es ahora bastante raro en Estados Unidos. En el mundo en desarrollo, sin embargo, las epidemias pueden llevar a tasas de mortalidad de hasta 40% en ausencia de tratamiento. 19 En los últimos años, la mayoría de los brotes han tenido lugar en Burundi, Etiopía y Ruanda. Por ejemplo, un brote en los campamentos de refugiados de Burundi en 1997 resultó en 45.000 enfermedades en una población de alrededor de 760,000 personas. 20
Un diagnóstico rápido es difícil debido a la similitud de los síntomas primarios con los de muchas otras enfermedades. Las pruebas diagnósticas moleculares e inmunohistoquímicas son los métodos más útiles para establecer un diagnóstico durante la etapa aguda de la enfermedad cuando las decisiones terapéuticas son críticas. La PCR para detectar genes distintivos de R. prowazekii puede ser utilizada para confirmar el diagnóstico de tifus epidémico, junto con tinción inmunofluorescente de especímenes de biopsia tisular. La serología se suele utilizar para identificar infecciones rickettsiales. Sin embargo, los títulos adecuados de anticuerpos tardan hasta 10 días en desarrollarse. La terapia con antibióticos generalmente se inicia antes de que se complete el diagnóstico. Los medicamentos más comunes utilizados para tratar a los pacientes con tifus epidémico son la doxiciclina o el cloranfenicol.
Tifus murino (endémico)
El tifus murino (también conocido como tifus endémico) es causado por Rickettsia typhi y se transmite por la picadura de la pulga de rata, Xenopsylla cheopis, con ratas infectadas como reservorio principal. Los signos y síntomas clínicos del tipo murinoincluyen una erupción y escalofríos acompañados de cefalea y fiebre que duran aproximadamente 12 días. Algunos pacientes también presentan tos y síntomas similares a la neumonía. La enfermedad grave puede desarrollarse en pacientes inmunodeprimidos, con convulsiones, coma e insuficiencia renal y respiratoria.
El diagnóstico clínico de tifus murino se puede confirmar a partir de una muestra de biopsia del sarpullido. Las pruebas diagnósticas incluyen tinción indirecta de anticuerpos inmunofluorescentes (IFA), PCR para R. typhi y pruebas serológicas agudas y convalecientes. El tratamiento primario es la doxiciclina, con cloranfenicol como segunda opción.
Fiebre manchada de las montañas
La enfermedad de la fiebre manchada de las Montañas Rocosas (RMSF) es causada por Rickettsia rickettsii y se transmite por la picadura de una garrapata de cuerpo duro como la garrapata de perro estadounidense (Dermacentor variabilis), la garrapata de madera de las Montañas Rocosas (D. andersoni) o la garrapata de perro marrón ( Rhipicephalus sanguineus).
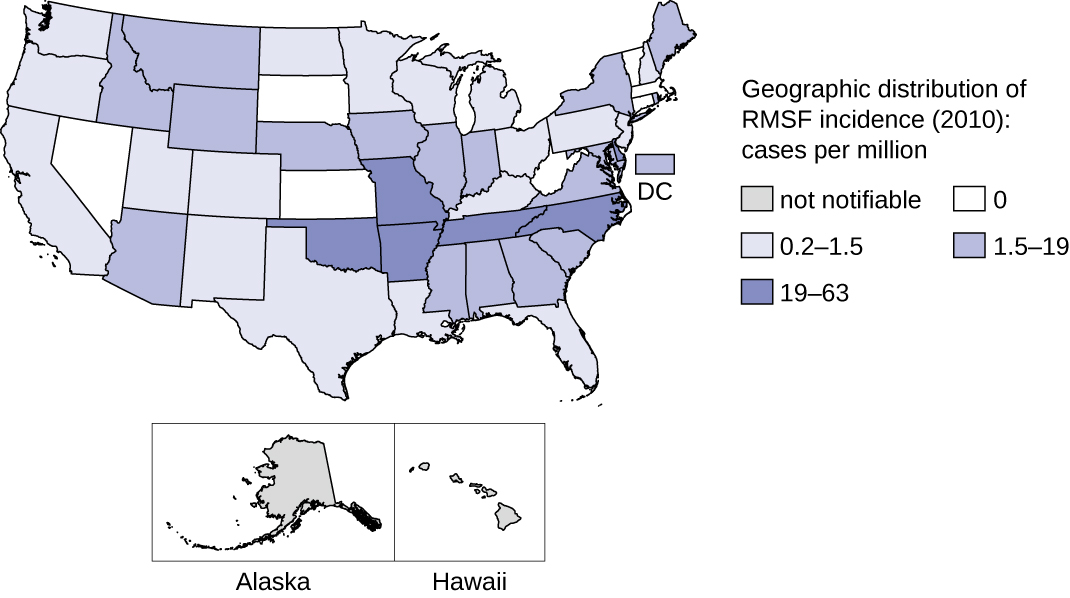
Esta enfermedad es endémica en América del Norte y del Sur y su incidencia coincide con el rango de vectores artrópodos. A pesar de su nombre, la mayoría de los casos en EU no ocurren en la región de las Montañas Rocosas sino en el Sureste; Carolina del Norte, Oklahoma, Arkansas, Tennessee y Missouri representan más del 60% de todos los casos. 21 El mapa de la Figura\(\PageIndex{7}\) muestra la distribución de la prevalencia en Estados Unidos en 2010.
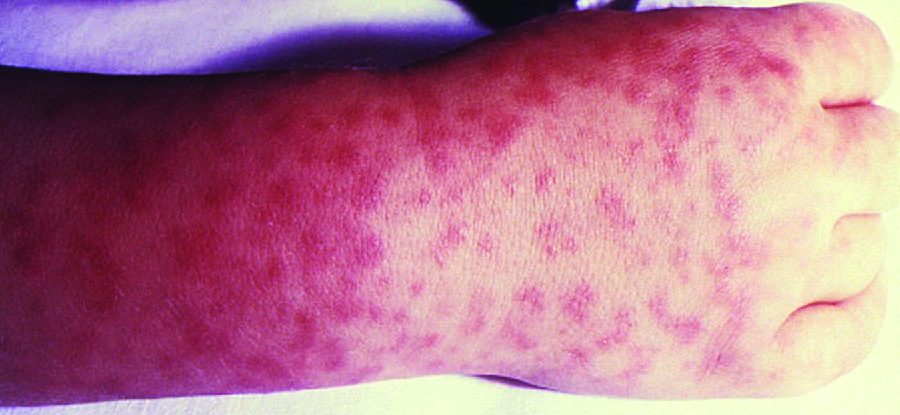
Los signos y síntomas de RMSF incluyen fiebre alta, dolor de cabeza, dolores corporales, náuseas y vómitos. Una erupción petequial (similar en apariencia al sarampión) comienza en las manos y muñecas, y se extiende al tronco, la cara y las extremidades (Figura\(\PageIndex{8}\)). Si no se trata, la RMSF es una enfermedad grave que puede ser mortal en los primeros 8 días incluso en pacientes que de otro modo serían sanos. Idealmente, el tratamiento debe comenzar antes de que se desarrollen las petequias, ya que esto es un signo de progresión a enfermedad grave; sin embargo, el sarpullido generalmente no aparece hasta el día 6 o más tarde después del inicio de los síntomas y solo ocurre en 35% — 60% de los pacientes con la infección. El aumento de la permeabilidad vascular asociada a la formación de petequias puede resultar en tasas de letalidad de 3% o más, incluso en presencia de soporte clínico. La mayoría de las muertes se deben a hipotensión y paro cardíaco o por isquemia después de la coagulación sanguínea.
El diagnóstico puede ser un desafío porque la enfermedad imita varias otras enfermedades que son más prevalentes. El diagnóstico de RMSF se realiza con base en síntomas, tinción de anticuerpos fluorescentes de una muestra de biopsia del sarpullido, PCR para Rickettsia rickettsii y pruebas serológicas agudas y convalecientes. El tratamiento primario es la doxiciclina, con cloranfenicol como segunda opción.
Enfermedad de Lyme
La enfermedad de Lyme es causada por la espiroqueta Borrelia burgdorferi que se transmite por la picadura de una garrapata Ixodes de cuerpo duro y patas negras. I. scapularis es el vector biológico que transmite B. burgdorferi en el este y centro-norte de Estados Unidos e I. pacificus transmite B. burgdorferi en el oeste de Estados Unidos (Figura\(\PageIndex{10}\)). Diferentes especies de garrapatas Ixodes son responsables de la transmisión de B. burgdorferi en Asia y Europa. En Estados Unidos, la enfermedad de Lyme es la enfermedad transmitida por vectores más comúnmente reportada. En 2014, fue la quinta enfermedad de notificación nacional más común. 22
Las garrapatas Ixodes tienen ciclos de vida complejos y los ciervos, ratones e incluso aves pueden actuar como reservorios. A lo largo de 2 años, las garrapatas pasan por cuatro etapas de desarrollo y requieren una comida de sangre de un huésped en cada etapa. En la primavera, los huevos de garrapatas eclosionan en larvas de seis patas. Estas larvas no portan inicialmente B. burgdorferi. Pueden adquirir la espiroqueta cuando toman su primera comida de sangre (típicamente de un ratón). Las larvas luego pasan el invierno y mudan en ninfas de ocho patas en la primavera siguiente. Las ninfas toman harinas de sangre principalmente de pequeños roedores, pero también pueden alimentarse de humanos, excavando en la piel. El período de alimentación puede durar de varios días a una semana y, por lo general, una ninfa infectada tarda 24 horas en transmitir suficiente B. burgdorferi para causar infección en un huésped humano. Las ninfas finalmente maduran en garrapatas adultas macho y hembra, que tienden a alimentarse de animales más grandes como los ciervos o, ocasionalmente, los humanos. Luego los adultos se aparean y producen huevos para continuar el ciclo (Figura\(\PageIndex{9}\)).
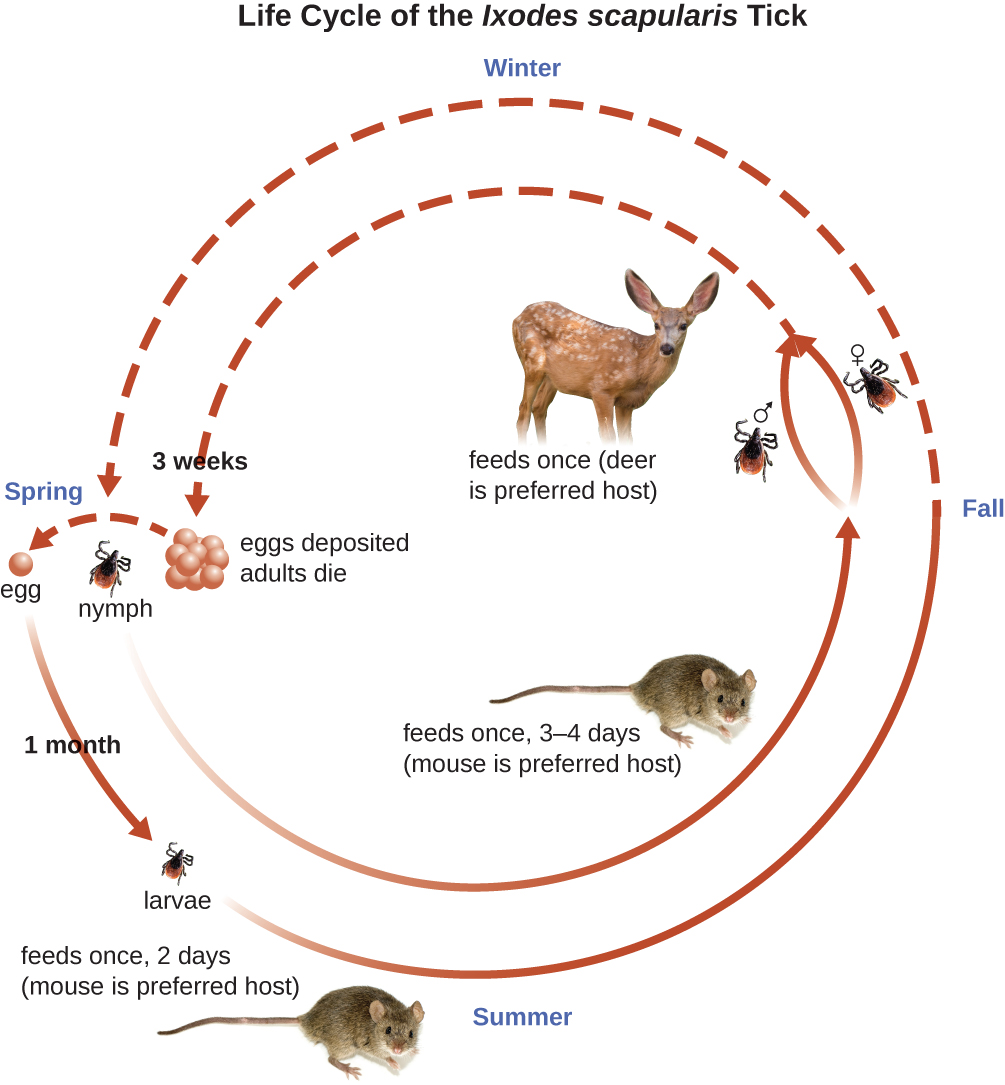
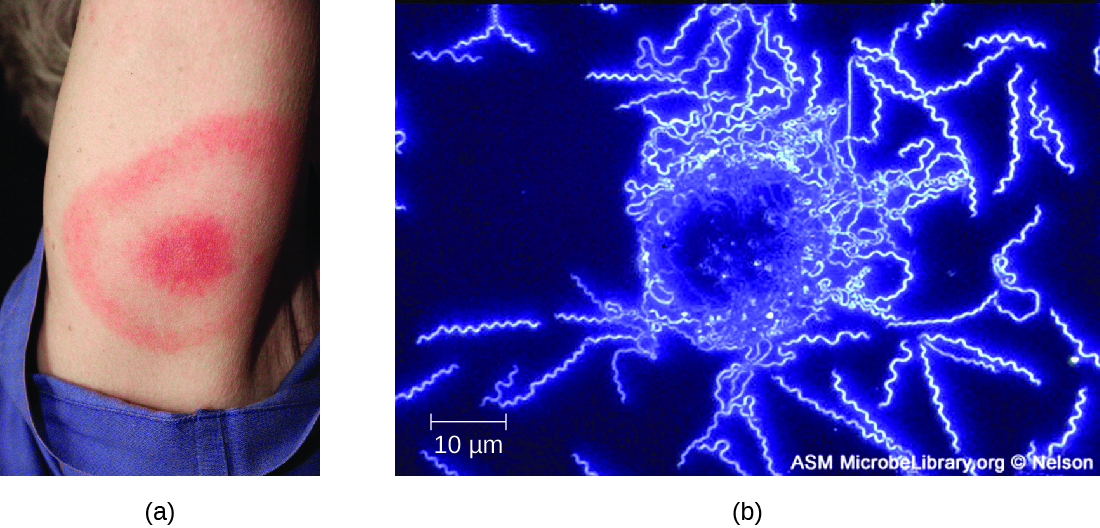
Los síntomas de la enfermedad de Lyme siguen tres etapas: localizada temprana, diseminada temprana y etapa tardía. Durante la etapa localizada temprana, aproximadamente 70% — 80% 23 de los casos pueden caracterizarse por una erupción de ojo de buey, llamada eritema migrante, en el sitio de la picadura inicial de la garrapata. El sarpullido se forma de 3 a 30 días después de la picadura de la garrapata (7 días es el promedio) y también puede estar caliente al tacto (Figura\(\PageIndex{10}\)). 24 Este signo diagnóstico a menudo se pasa por alto si la picadura de garrapata ocurre en el cuero cabelludo u otra ubicación menos visible. Otros síntomas tempranos incluyen síntomas similares a la gripe, como malestar general, dolor de cabeza, fiebre y rigidez muscular. Si el paciente no se trata, la segunda etapa de diseminación temprana de la enfermedad ocurre días a semanas después. Los síntomas en esta etapa pueden incluir dolor de cabeza intenso, rigidez en el cuello, parálisis facial, artritis y carditis. Las manifestaciones tardías de la enfermedad pueden ocurrir años después de la exposición. La inflamación crónica causa daños que eventualmente pueden causar artritis severa, meningitis, encefalitis y estados mentales alterados. La enfermedad puede ser mortal si no se trata.
Se puede hacer un diagnóstico presuntivo de la enfermedad de Lyme basándose únicamente en la presencia de una erupción de ojo de buey en el sitio de la infección, si está presente, además de otros síntomas asociados (Figura\(\PageIndex{10}\)). Además, el marcaje indirecto de anticuerpos inmunofluorescentes (IFA) se puede utilizar para visualizar bacterias a partir de muestras de sangre o biopsia de piel. También se pueden utilizar pruebas serológicas como ELISA para detectar anticuerpos séricos producidos en respuesta a la infección. Durante la etapa temprana de la infección (aproximadamente 30 días), los medicamentos antibacterianos como la amoxicilina y la doxiciclina son efectivos. En las etapas posteriores, se puede administrar penicilina G, cloranfenicol o ceftriaxona por vía intravenosa.
Fiebre recidivante
Borrelia spp. también puede causar fiebre recidivante. Dos de las especies más comunes son B. recurrentis, que causa epidemias de fiebre recidivante transmitida por piojos, y B. hermsii, que causa fiebres recidivantes transmitidas por garrapatas. Estas especies de Borrelia son transmitidas por el piojo corporal Pediculus humanus y la garrapata de cuerpo blando Ornithodoros hermsi, respectivamente. Los piojos adquieren las espiroquetas de reservorios humanos, mientras que las garrapatas las adquieren de reservorios de roedores. Las espiroquetas infectan a los humanos cuando Borrelia en la saliva o excreta del vector ingresa rápidamente a la piel a medida que el vector muerde.
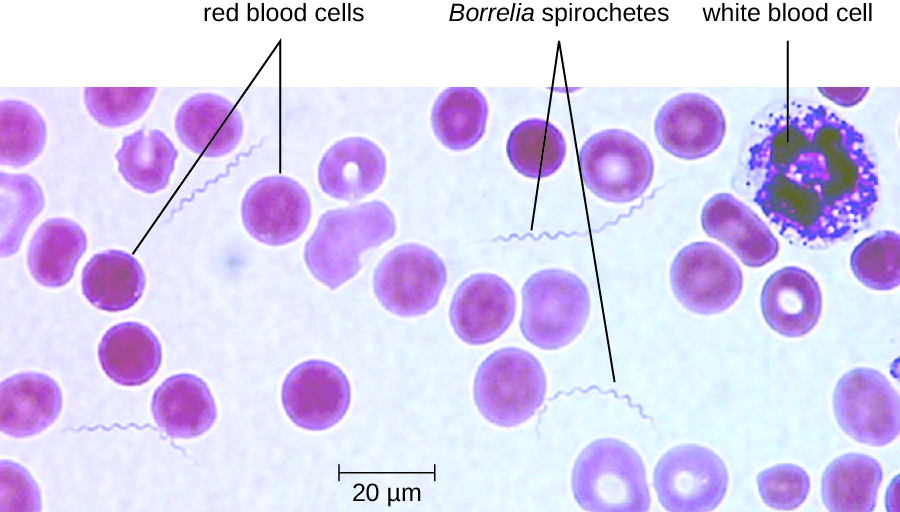
Tanto en el piojo como en las fiebres recidivantes transmitidas por garrapatas, la bacteriemia suele ocurrir después de la exposición inicial, lo que lleva a una fiebre alta repentina (39—43 °C [102.2—109.4 °F) típicamente acompañada de dolor de cabeza y dolores musculares. Después de aproximadamente 3 días, estos síntomas suelen disminuir, solo para regresar nuevamente después de aproximadamente una semana. Después de otros 3 días, los síntomas vuelven a disminuir pero regresan una semana después, y este ciclo puede repetirse varias veces a menos que se vea interrumpido por el tratamiento antibiótico. La evasión inmune a través de la variación antigénica bacteriana es responsable de la naturaleza cíclica de los síntomas en estas enfermedades.
El diagnóstico de fiebre recidivante se puede hacer mediante la observación de espiroquetas en sangre, mediante microscopía de campo oscuro (Figura\(\PageIndex{11}\)). Para la fiebre recidivante transmitida por los piojos, la doxiciclina o la eritromicina son los antibióticos de primera línea. Para la fiebre recidivante transmitida por garrapatas, la tetraciclina o la eritromicina son los antibióticos de primera línea.
Fiebre trinchera
La fiebre de trinchera de la enfermedad transmitida por piojos se caracterizó por primera vez como una enfermedad específica durante la Primera Guerra Mundial, cuando aproximadamente 1 millón de soldados fueron infectados Hoy en día, se limita principalmente a áreas del mundo en desarrollo donde el saneamiento y la higiene deficientes conducen a infestaciones de piojos (por ejemplo, áreas urbanas superpobladas y campamentos de refugiados). La fiebre de trinchera es causada por la bacteria gramnegativa Bartonella quintana, que se transmite cuando las heces de los piojos infectados, Pediculus humanus var corporis, se frotan en la picadura del piojo, la piel desgastada o la conjuntiva. Los síntomas suelen seguir un curso de 5 días marcado por fiebre alta, dolores corporales, conjuntivitis, dolor ocular, dolores severos y dolor óseo intenso en las espinillas, el cuello y la espalda. El diagnóstico se puede hacer mediante hemocultivos; pruebas serológicas como ELISA se pueden usar para detectar títulos de anticuerpos contra el patógeno y también se puede usar PCR. Los antibióticos de primera línea son doxiciclina, antibióticos macrólidos y ceftriaxona.
Ejercicio\(\PageIndex{7}\)
- ¿Cuál es el vector asociado al tifus epidémico?
- Describir el ciclo de vida de la garrapata de venado y cómo propaga la enfermedad de Lyme.
Puntas para garrapatas
Muchas de las enfermedades tratadas en este capítulo involucran vectores artrópodos. De estas, las garrapatas son probablemente las que más se encuentran en Estados Unidos. Las garrapatas adultas tienen ocho patas y dos segmentos corporales, el cefalotórax y la cabeza (Figura\(\PageIndex{12}\)). Por lo general, varían de 2 mm a 4 mm de longitud, y se alimentan de la sangre del huésped al unirse a la piel.
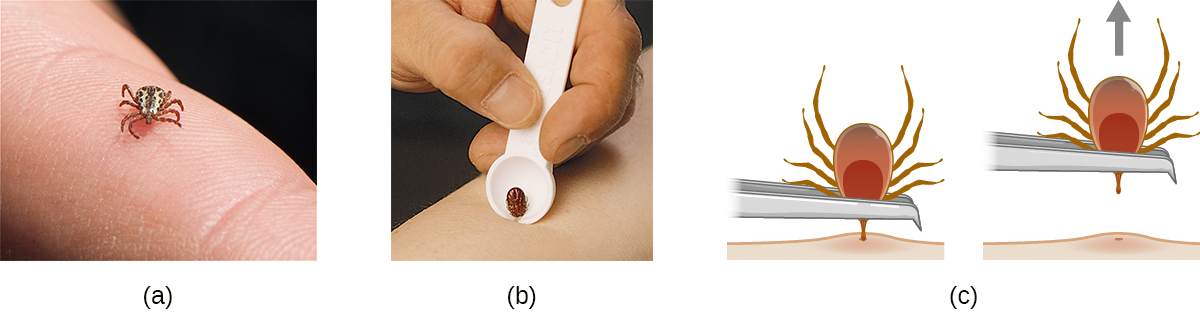
Las garrapatas no adheridas deben eliminarse y eliminarse tan pronto como se descubran. Al retirar una garrapata que ya se ha adherido, tenga en cuenta las siguientes pautas para reducir las posibilidades de exposición a patógenos:
- Use pinzas contundentes para tirar suavemente cerca del sitio de fijación hasta que la garrapata libere su sujeción sobre la piel.
- Evite aplastar el cuerpo de la garrapata y no manejar la garrapata con los dedos desnudos. Esto podría liberar patógenos bacterianos y en realidad aumentar su exposición. La garrapata puede matarse ahogándose en agua o alcohol, o congelarse si es necesario posteriormente para su identificación y análisis.
- Desinfecte la zona a fondo limpiando con un antiséptico como el isopropanol.
- Controle el sitio de la picadura para detectar erupciones u otros signos de infección.
Muchos remedios caseros desaconsejados para la eliminación de garrapatas se han popularizado en los últimos años, propagados por las redes sociales y el pseudoperiodismo. Los profesionales de la salud deben desalentar a los pacientes de recurrir a cualquiera de los siguientes métodos, los cuales NO son recomendables:
- usar productos químicos (por ejemplo, vaselina o esmalte de uñas) para desalojar una garrapata adherida, ya que puede hacer que la garrapata libere líquido, lo que puede aumentar la probabilidad de infección
- usar objetos calientes (fósforos o colillas de cigarrillos) para desalojar una garrapata adjunta
- apretar el cuerpo de la garrapata con los dedos o pinzas
Infecciones bacterianas de los sistemas circulatorio y linfático
Si bien el sistema circulatorio es un sistema cerrado, las bacterias pueden ingresar al torrente sanguíneo a través de varias vías. Las heridas, mordeduras de animales u otras roturas en la piel y las membranas mucosas pueden dar lugar a la rápida diseminación de patógenos bacterianos por todo el cuerpo. Las infecciones localizadas también pueden propagarse al torrente sanguíneo, causando infecciones sistémicas graves y a menudo fatales. Figura\(\PageIndex{13}\) y Figura\(\PageIndex{14}\) resumen las principales características de las infecciones bacterianas de los sistemas circulatorio y linfático.
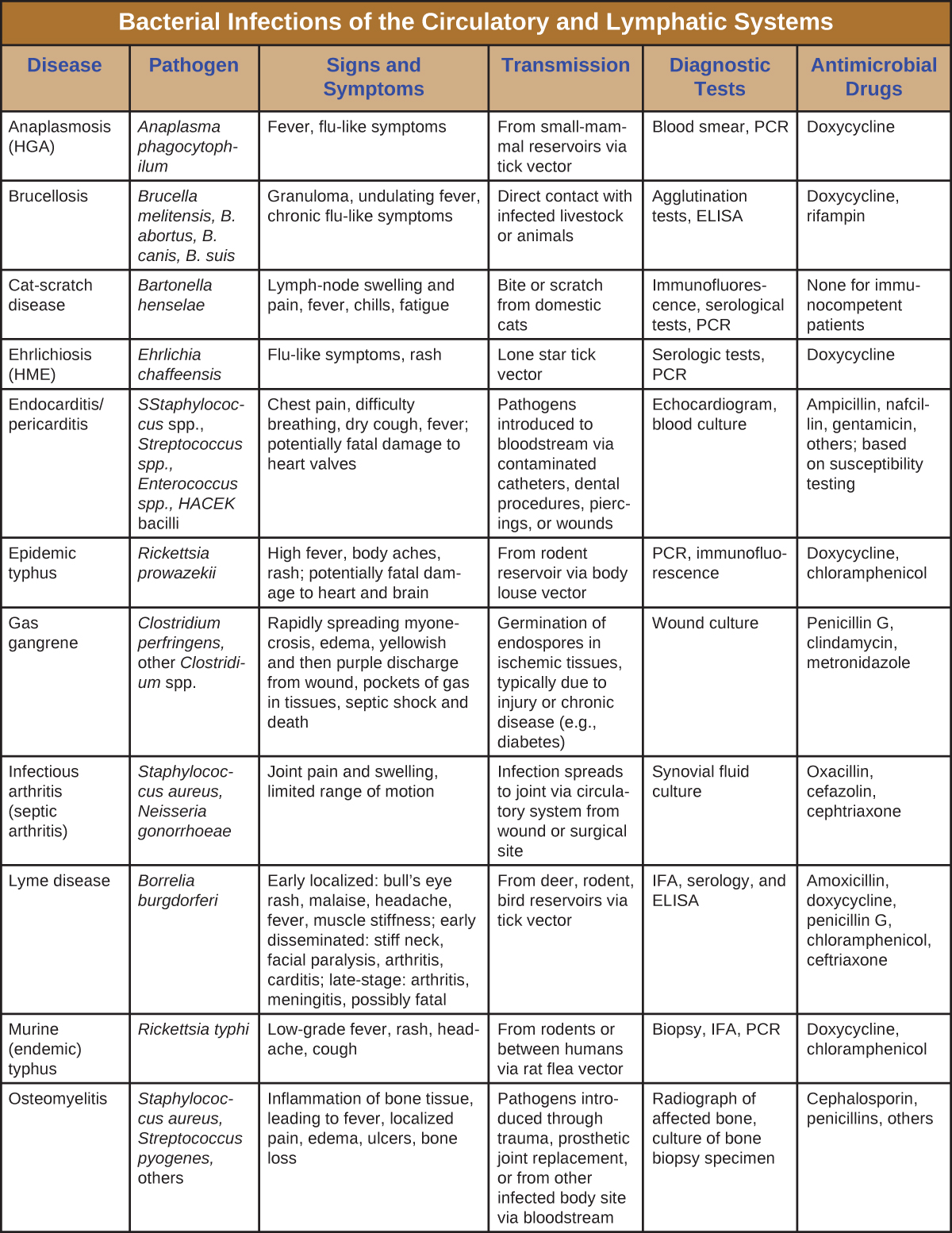
![Cuadro titulado: Infecciones Bacterianas de los Sistemas Circulatorio y Linfático (continuación). Columnas: Enfermedad, Patógeno, Signos y Síntomas, Transmisión, Pruebas Diagnósticas, Medicamentos Antimicrobianos.Plaga; Yersinia pestis; Bubonic: bubones, fiebre, hemorragia interna; septicémica: fiebre, dolor abdominal, shock, CID, necrosis en extremidades; neumónica: neumonía aguda, insuficiencia respiratoria, shock. Todas las formas tienen altas tasas de mortalidad. Transmitido desde reservorios de mamíferos a través de vectores de pulgas o consumo de animal infectado; transmisión de peste neumónica entre humanos a través de aerosoles respiratorios; Cultivo de bacterias a partir de muestras de linfa, sangre o esputo; DFA, ELISA; Gentamicina, fluoroquinolonas, otros. Sepsis puerperal; Streptococcus pyogenes, muchos otros; Fiebre de inicio rápido, shock y muerte; Patógenos introducidos durante o inmediatamente después del parto; Herida, orina o hemocultivo; Según lo determinado por pruebas de susceptibilidad. Fiebre por mordedura de rata; Streptobacillus moniliformis, Spirillum minor; Fiebre, dolor muscular y articular, erupción cutánea, úlcera; Mordedura de rata infectada o exposición a heces o fluidos corporales de rata en alimentos o agua contaminados; Observación del organismo a partir de muestras y pruebas de anticuerpos; Penicilina. Fiebre recurrente; Recurrentis por Borrelia, B. hermsii, otras Borrelia spp.; Fiebre recurrente, cefalea, dolores musculares; De reservorio de roedores o humanos vía piojo corporal o vector de garrapatas; Microscopía de campo oscuro; Doxiciclina, tetraciclina, eritromicina. Fiebre reumática; Streptococcus pyogenes; Dolor e hinchazón articular, inflamación y cicatrización de válvulas cardíacas, soplo cardíaco; Secuela de faringitis estreptocócica; Serología, electrocardiograma, ecocardiograma; Benzatina bencilpenicilina. Fiebre moteada de las Montañas Rocosas; Rickettsia rickettsia; Fiebre alta, cefalea, dolores corporales, náuseas y vómitos, erupción petequial; hipotensión e isquemia potencialmente fatales por coagulación sanguínea; De reservorio de roedores vía vectores de garrapatas; Biopsia, serología, PCR; Doxiciclina, cloranfenicol. Síndrome de choque tóxico (SST); Staphylococcus aureus; Fiebre alta repentina, vómitos, diarrea, hipotensión, muerteLos patógenos de infección localizada se diseminan al torrente sanguíneo; patógenos introducidos en tampones u otros productos intravaginales; Serología, identificación de toxinas a partir de aislamientos; Clindamicina, vancomicina. Síndrome de choque tóxico (STSS); Streptococcus pyogenes; Fiebre alta repentina, vómitos, diarrea, síndrome de dificultad respiratoria aguda (SDRA), hipoxemia, fascitis necrotizante, muerte; Sequela de infección estreptocócica de piel o tejidos blandos; [FALTANTE]; Penicilina, cefalosporina. Fiebre de trinchera; Bartonella Quintana; Fiebre alta, conjuntivitis, dolor ocular, dolores de cabeza, dolor intenso en huesos de espinillas, cuello y espalda; Entre humanos vía vector de piojo corporal; Cultivo de sangre, ELISA, PCR; Doxiciclina, antibióticos macrólidos, ceftriaxona. Tularemia (fiebre del conejo); Francisella tularensis Lesiones cutáneas, fiebre, escalofríos, cefalea, bubones; Comer o manejar conejo infectado; transmisión del animal infectado a través del vector garrapata o mosca; transmisión en aerosol (en laboratorio o como arma biológica); DFA; Estreptomicina, gentamicina, otros.](https://bio.libretexts.org/@api/deki/files/9163/OSC_Microbio_25_02_BactCircDP_Part2.jpg)
Conceptos clave y resumen
- Las infecciones bacterianas del sistema circulatorio son casi universalmente graves. Si no se trata, la mayoría tiene altas tasas de mortalidad.
- Los patógenos bacterianos suelen requerir una brecha en las defensas inmunitarias para colonizar el sistema circulatorio. La mayoría de las veces, esto implica una herida o la picadura de un vector artrópodo, pero también puede ocurrir en entornos hospitalarios y resultar en infecciones nosocomiales.
- La sepsis por bacterias gramnegativas y grampositivas, fiebre puerperal, fiebre reumática, endocarditis, gangrena gaseosa, osteomielitis y síndrome de choque tóxico suelen ser el resultado de una lesión o introducción de bacterias por intervención médica o quirúrgica.
- Tularemia, brucelosis, fiebre por arañazo de gato, fiebre por mordedura de rata y peste bubónica son enfermedades zoonóticas transmitidas por vectores biológicos
- La ehrliquiosis, la anaplasmosis, el tifus endémico y murino, la fiebre manchada de las Montañas Rocosas, la enfermedad de Lyme, la fiebre recurrente y la fiebre de trinchera se transmiten por vectores artrópodos
- Debido a que sus síntomas son tan similares a los de otras enfermedades, muchas infecciones bacterianas del sistema circulatorio son difíciles de diagnosticar.
- Las terapias antibióticas estándar son efectivas para el tratamiento de la mayoría de las infecciones bacterianas del sistema circulatorio, a menos que la bacteria sea resistente, en cuyo caso puede requerirse un tratamiento sinérgico.
- La respuesta inmune sistémica a una bacteriemia, que implica la liberación de cantidades excesivas de citocinas, a veces puede ser más dañina para el huésped que la infección misma.
Notas al pie
- 1 S.P. LaRosa. “Sepsis.” 2010. http://www.clevelandclinicmeded.com/...isease/sepsis/.
- 2 D.C. Angus, T. Van der Poll. “Sepsis Grave y Shock Séptico”. New England Journal of Medicine 369, núm. 9 (2013) :840—851.
- 3 Centros de Control y Prevención de Enfermedades. “Síndrome de Shock Tóxico (No Estreptocócico) (TSS) 2011 Definición de Caso”. https://wwwn.cdc.gov/nndss/condition...finition/2011/. Consultado el 25 de julio de 2016.
- 4 Centros de Control y Prevención de Enfermedades. “Síndrome de Shock Tóxico Estreptocócico (STSS) (Streptococcus pyogenes) 2010 Definición de Caso”. https://wwwn.cdc.gov/nndss/condition...finition/2010/. Consultado el 25 de julio de 2016.
- 5 M.E. Camisón, Mader JT. “Artritis Séptica Aguda”. Revisiones de Microbiología Clínica 15 núm. 4 (2002) :527—544.
- 6 J.R. Maneiro et al. “Predictores de Falla de Tratamiento y Mortalidad en Artritis Séptica Nativa Reumatología Clínica 34, núm. 11 (2015) :1961-1967.
- 7 M. Vázquez. “Osteomielitis en Niños”. Dictamen Vigente en Pediatría 14, núm. 1 (2002) :112—115.
- 8 A. Beaudoin et al. “Fiebre reumática aguda y cardiopatía reumática entre niños—Samoa Americana, 2011—2012”. Informe Semanal de Morbilidad y Mortalidad 64 núm. 20 (2015) :555—558.
- 9 M.A. Gerber et al. “Prevención de la fiebre reumática y diagnóstico y tratamiento de la faringitis estreptocócica aguda: una declaración científica del Comité de Fiebre Reumática, Endocarditis y Enfermedad de Kawasaki de la Asociación Americana del Corazón del Consejo de Enfermedades Cardiovasculares en la Juventud, el Consejo Interdisciplinario de Funcionales Genómica y Biología Traslacional, y el Consejo Interdisciplinario de Calidad de la Atención e Investigación de Resultados: Avalado por la Academia Americana de Pediatría”. Circulación 119, núm. 11 (2009) :1541—1551.
- 10 Organización Mundial de la Salud. “Lineamientos de la OMS sobre Tularemia”. 2007. http://www.cdc.gov/tularemia/resources/whotularemiamanual.pdf. Consultado el 26 de julio de 2016.
- 11 MOH Laboratorio Clave de Biología de Sistemas de Patógenos. “Factores de Virulencia de Bacterias Patógenas, Yersinia.” http://www.mgc.ac.cn/cgi-bin/VFs/gen...Genus=Yersinia. Consultado el 9 de septiembre de 2016.
- 12 Rosen, Guillermo. La pulga de Justiniano: la peste, el imperio y el nacimiento de Europa. Vikingo Adulto; pg 3; ISBN 978-0-670-03855-8.
- 13 Benedictow, Ole J. 2004. La muerte negra 1346-1353: La historia completa. Woodbridge: Prensa Boydell.
- 14 Centros de Control y Prevención de Enfermedades. “Plaga: Historia”. http://www.cdc.gov/plague/history/. Accedido el 15 de septiembre de 2016.
- 15 J.S. Bakken et al. “Diagnóstico y Manejo de Enfermedades Rickettsiales Transmitidas por Tickets: Fiebre Manchada de las Montañas Rocosas, Ehrliquiosis, y Anaplasmosis — Estados Unidos. Una Guía Práctica para Médicos y Otros Profesionales de la Salud y de la Salud Pública”. Recomendaciones e Informes MMWR 55 núm. RR04 (2006) :1—27.
- 16 MOH Laboratorio Clave de Biología de Sistemas de Patógenos, “Factores de Virulencia de Bacterias Patógenas, Anaplasma” 2016. http://www.mgc.ac.cn/cgi-bin/VFs/jsif/main.cgi. Consultado el 26 de julio de 2016.
- 17 Centros de Control y Prevención de Enfermedades. “Ehrlichiosis, síntomas, diagnóstico y tratamiento.” 2016. https://www.cdc.gov/ehrlichiosis/symptoms/index.html. Consultado el 29 de julio de 2016.
- 18 Drali, R., Brouqui, P. y Raoult, D. “El tifus en la Primera Guerra Mundial” Microbiología Hoy 41 (2014) 2:58 —61.
- 19 Centros de Control y Prevención de Enfermedades. Información de salud de los CDC para viajes internacionales 2014: El libro amarillo. Oxford University Press, 2013. http://wwwnc.cdc.gov/travel/yellowbook/2016/infectious-diseases-related-to-travel/rickettsial-spotted-typhus-fevers-related-infections-anaplasmosis-ehrlichiosis. Consultado el 26 de julio de 2016.
- 20 Organización Mundial de la Salud. “Tifus.” 1997. www.who.int/mediacentre/factsheets/fs162/es/. Consultado el 26 de julio de 2016.
- 21 Centros de Control y Prevención de Enfermedades. “Fiebre Manchada de las Montañas Rocosas (RMSF): Estadística y Epidemiología”. http://www.cdc.gov/rmsf/stats/index.html. Accedido el 16 de septiembre de 2016.
- 22 Centros de Control y Prevención de Enfermedades. “Enfermedad de Lyme. Datos y Estadística.” 2015. http://www.cdc.gov/lyme/stats/index.html. Consultado el 26 de julio de 2016.
- 23 Centros de Control y Prevención de Enfermedades. “Signos y Síntomas de la Enfermedad de Lyme No Tratada”. 2015. http://www.cdc.gov/lyme/signs_symptoms/index.html. Consultado el 27 de julio de 2016.
- 24 Centros de Control y Prevención de Enfermedades. “Garrapatas. Síntomas de la enfermedad transmitida por garrapatas.” 2015. http://www.cdc.gov/ticks/symptoms.html. Consultado el 27 de julio de 2016.


