25.4: Infecciones parasitarias de los sistemas circulatorio y linfático
- Page ID
- 54856
Objetivos de aprendizaje
- Identificar parásitos comunes que causan infecciones de los sistemas circulatorio y linfático
- Comparar las principales características de enfermedades parasitarias específicas que afectan a los sistemas circulatorio y linfático
Algunos protozoos y trematodos parásitos también son capaces de provocar infecciones del sistema circulatorio humano. A pesar de que estas infecciones son raras en EU, siguen causando un sufrimiento generalizado en el mundo en vías de desarrollo en la actualidad. Las infecciones fúngicas del sistema circulatorio son muy raras. Por lo tanto, no se discuten en este capítulo.
Malaria
A pesar de más de un siglo de intensa investigación y avances clínicos, la malaria sigue siendo una de las enfermedades infecciosas más importantes del mundo en la actualidad. Su distribución generalizada pone en peligro a más de la mitad de la población mundial. En 2015, la OMS estimó que había alrededor de 214 millones de casos de malaria en todo el mundo, resultando en alrededor de 438 mil muertes; alrededor del 88% de los casos y 91% de las muertes ocurrieron en África. 1 Aunque la malaria no es actualmente una amenaza importante en EU, la posibilidad de su reintroducción es una preocupación. La malaria es causada por varios protozoarios parásitos del género Plasmodium: P. falciparum, P. knowlesi, P. malariae, P. ovale y P. vivax. Plasmodium infecta principalmente a los glóbulos rojos y se transmite a través de la picadura de mosquitos Anopheles.
Actualmente, P. falciparum es la causa más común y letal de malaria, a menudo llamada malaria falciparum. La malaria por falciparum está muy extendida en regiones altamente pobladas de África y Asia, lo que pone a muchas personas en riesgo de padecer la forma más grave de la enfermedad.
Los signos y síntomas clásicos de la malaria son ciclos de fiebre extrema y escalofríos. Los síntomas repentinos y violentos de la malaria comienzan con malestar general, escalofríos abruptos y fiebre (39—41° C [102.2—105.8 °F]), pulso rápido y débil, poliuria, dolor de cabeza, mialgia, náuseas y vómitos. Después de 2 a 6 horas de estos síntomas, la fiebre cae, y se produce sudoración profusa durante 2 a 3 horas, seguida de fatiga extrema. Estos síntomas son el resultado de que Plasmodium emerge de los glóbulos rojos sincrónicamente, lo que lleva a la ruptura simultánea de una gran cantidad de glóbulos rojos, lo que resulta en daños en el bazo, el hígado, los ganglios linfáticos y la médula ósea. El daño orgánico resultante de la hemólisis provoca que los pacientes desarrollen sangre de lodo (es decir, sangre en la que los glóbulos rojos se aglutinan en grumos) que pueden llevar a la falta de oxígeno, necrosis de los vasos sanguíneos, insuficiencia orgánica y muerte.
En infecciones establecidas, los ciclos palúdicos de fiebre y escalofríos suelen ocurrir cada 2 días en la enfermedad descrita como malaria terciana, la cual es causada por P. vivax y P. ovale. Los ciclos ocurren cada 3 días en la enfermedad descrita como malaria cuartanana, la cual es causada por P. malariae. Estos intervalos pueden variar entre los casos.
Plasmodium tiene un ciclo de vida complejo que incluye varias etapas de desarrollo producidas alternativamente en mosquitos y humanos (Figura\(\PageIndex{1}\)). Cuando un mosquito infectado toma una comida de sangre, los esporozoitos en la glándula salival del mosquito se inyectan en la sangre del huésped. Estos parásitos circulan hacia el hígado, donde se convierten en esquizontes. Los esquizontes luego se someten a esquizoogonía, lo que resulta en la liberación de muchos merozoítos a la vez. Los merozoitos se trasladan al torrente sanguíneo e infectan los glóbulos rojos. Dentro de los glóbulos rojos, los merozoitos se convierten en trofozoitos que producen más merozoitos. La liberación sincrónica de merozoitos de los glóbulos rojos en la noche conduce a los síntomas de la malaria.
Además, algunos trofozoitos se desarrollan alternativamente en gametocitos masculinos y femeninos. Los gametocitos son absorbidos cuando el mosquito toma una comida de sangre de un individuo infectado. La esporogonía sexual ocurre en el intestino del mosquito. Los gametocitos se fusionan para formar cigotos en el intestino del insecto. Los cigotos se vuelven móviles y se alargan en un ookinete. Esta forma penetra en la pared del intestino medio y se desarrolla en un ooquisto. Finalmente, el oocisto libera nuevos esporozoitos que migran a las glándulas salivales del mosquito para completar el ciclo de vida.
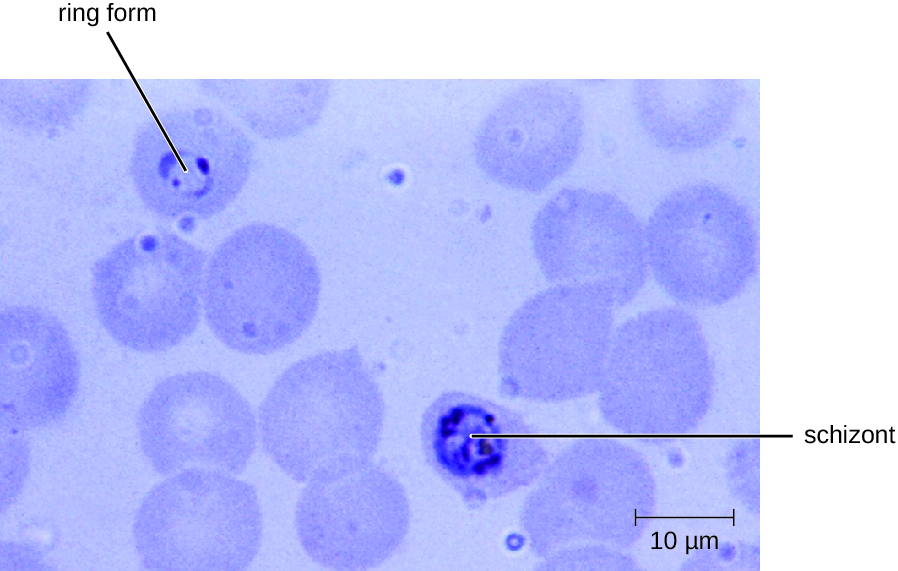
El diagnóstico de malaria es por observación microscópica de formas de desarrollo de Plasmodium en frotis de sangre y ensayos rápidos de EIA que detectan antígenos o enzimas de Plasmodium (Figura\(\PageIndex{2}\)). Se pueden recetar medicamentos como cloroquina, atovacuona, arteméter y lumefantrina tanto para terapia aguda como profiláctica, aunque algunos Plasmodium spp. han mostrado resistencia a los antipalúdicos. El uso de insecticidas y mosquiteros tratados con insecticidas puede limitar la propagación de la malaria. A pesar de los esfuerzos por desarrollar una vacuna contra la malaria, actualmente no hay ninguna disponible.
![Ciclo de vida de Plasmodium. [Etapas hepáticas humanas] 1 — El mosquito toma una comida de sangre e inyecta Plasmodium en un ser humano. 2 — Plasmodium infecta células hepáticas. 3 — Plasmodium se multiplica en la célula hepática. [Etapas de sangre humana] 4 — Plasmodium ingresa a la sangre. Una etapa de anillo inmaduro parece un anillo de sello en un glóbulo rojo. Esto se convierte en una etapa de anillo maduro y se somete a mitosis para producir esquizontes que se liberan al romper los glóbulos rojos. 5 — Gametos (1n) producidos por meiosis. [Etapas de mosquitos] 6 - Moquito toma una harina de sangre e ingiere gametos. 7 — Los microgametos fertilizan al macrogameto. 8 — Formas del cigoto (2n). 9 — El cigoto sufre mitosis. 10 — El parásito se diferencia y entra en la saliva del mosquito.](https://bio.libretexts.org/@api/deki/files/9172/OSC_Microbio_25_04_Malaria.jpg)
La campaña Nothing But Nets, una iniciativa de la Fundación de las Naciones Unidas, se ha asociado con la Fundación Bill y Melinda Gates para poner mosquiteros disponibles en los países en desarrollo de África. Visite su sitio web para conocer más sobre sus esfuerzos para prevenir la malaria.
Ejercicio\(\PageIndex{1}\)
¿Por qué la malaria es una de las enfermedades infecciosas más importantes?
Toxoplasmosis
La enfermedad toxoplasmosis es causada por el protozoo Toxoplasma gondii. T. gondii se encuentra en una amplia variedad de aves y mamíferos, 2 y las infecciones humanas son comunes. Los Centros para el Control y la Prevención de Enfermedades (CDC) estiman que 22.5% de la población de 12 años o más ha sido infectada con T. gondii; sin embargo, los individuos inmunocompetentes suelen ser asintomáticos. 3 Los gatos domésticos son los únicos hospedadores definitivos conocidos para las etapas sexuales de T. gondii y, por lo tanto, son los principales reservorios de infección. Los gatos infectados arrojan oocistos de T. gondii en sus heces, y estos oocistos generalmente se propagan a los humanos a través del contacto con materia fecal en los cuerpos de los gatos, en cajas de arena o en camas de jardín donde los gatos al aire libre defecan.
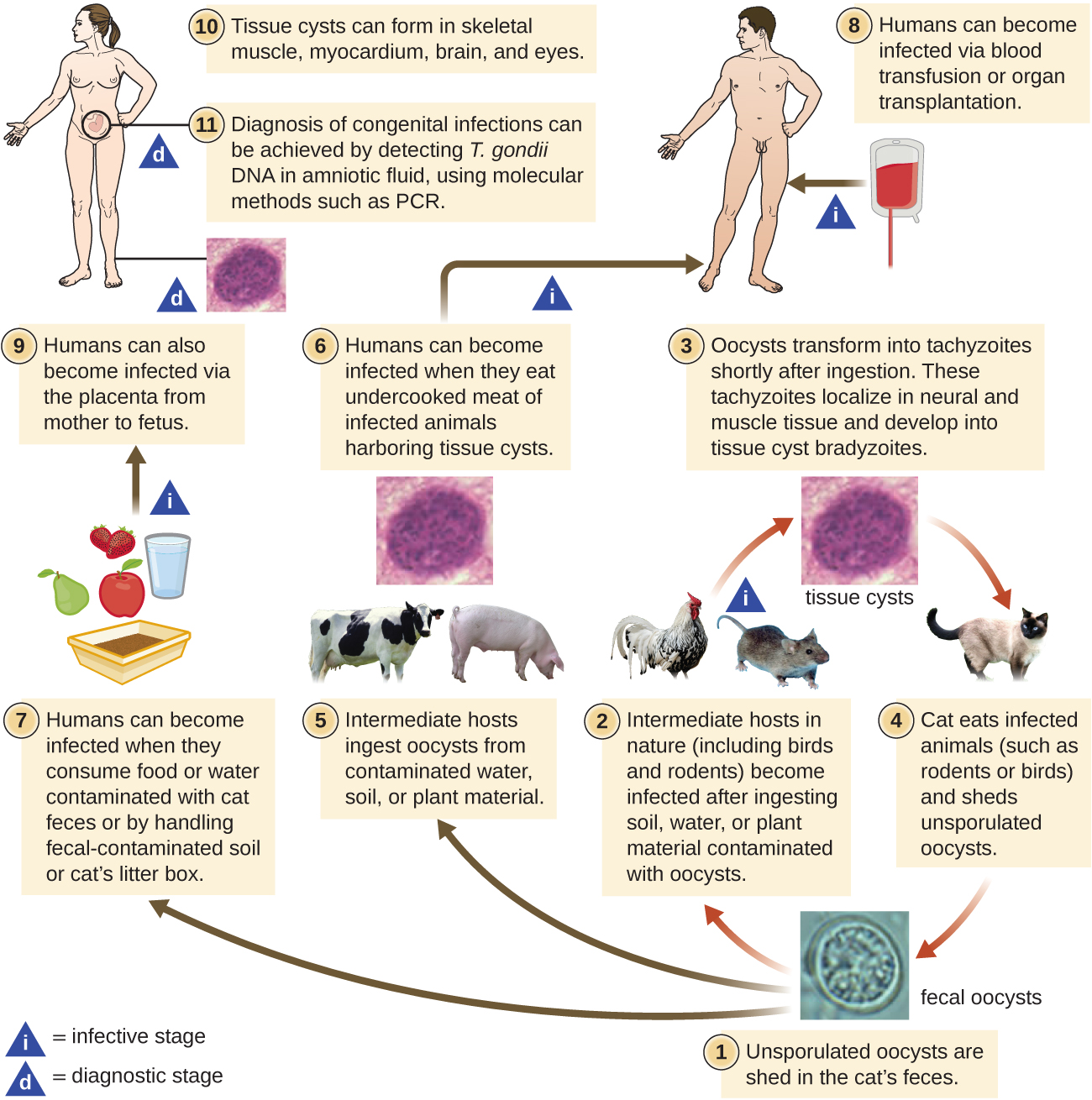
T. gondii tiene un ciclo de vida complejo que involucra múltiples huéspedes. El ciclo de vida de T. gondii comienza cuando se desprenden oocistos no esporulados en las heces del gato. Estos oocistos tardan de 1 a 5 días en esporular en el ambiente y volverse infecciosos. Los huéspedes intermedios en la naturaleza incluyen aves y roedores, que se infectan después de ingerir suelo, agua o material vegetal contaminado con los oocistos infecciosos. Una vez ingeridos, los oocistos se transforman en taquizoitos que se localizan en el tejido neural y muscular del ave o roedor, donde se desarrollan en quistes tisulares. Los gatos pueden infectarse después de consumir aves y roedores que albergan quistes tisulares. Los gatos y otros animales también pueden infectarse directamente por la ingestión de ooquistes esporulados en el ambiente. Curiosamente, la infección por Toxoplasma parece ser capaz de modificar el comportamiento del huésped. Los ratones infectados por Toxoplasma pierden el miedo a las feromonas de gato. Como resultado, se convierten en presas más fáciles para los gatos, facilitando la transmisión del parásito al gato hospedador definitivo 4 (Figura\(\PageIndex{3}\)).
Las infecciones por toxoplasma en humanos son extremadamente comunes, pero la mayoría de las personas infectadas son asintomáticas o presentan síntomas subclínicos. Algunos estudios sugieren que el parásito puede ser capaz de influir en la personalidad y el rendimiento psicomotor de los humanos infectados, de manera similar a la forma en que modifica el comportamiento en otros mamíferos. 5 Cuando se presentan los síntomas, tienden a ser leves y similares a los de la mononucleosis. Sin embargo, la toxoplasmosis asintomática puede llegar a ser problemática en ciertas situaciones. Los quistes pueden alojarse en una variedad de tejidos humanos y permanecen inactivos durante años. La reactivación de estas infecciones quiescentes puede ocurrir en pacientes inmunocomprometidos después de un trasplante, terapia contra el cáncer o el desarrollo de un trastorno inmune como el SIDA. En pacientes con SIDA que tienen toxoplasmosis, el sistema inmunitario no puede combatir el crecimiento de T. gondii en los tejidos corporales; como resultado, estos quistes pueden causar encefalitis, retinitis, neumonitis, trastornos cognitivos y convulsiones que eventualmente pueden ser fatales.
La toxoplasmosis también puede representar un riesgo durante el embarazo porque los taquizoitos pueden atravesar la placenta y causar infecciones graves en el feto en desarrollo. La extensión del daño fetal resultante de la toxoplasmosis depende de la gravedad de la enfermedad materna, el daño a la placenta, la edad gestacional del feto cuando se infecta y la virulencia del organismo. La toxoplasmosis congénita a menudo conduce a la pérdida fetal o al parto prematuro y puede provocar daños en el sistema nervioso central, manifestándose como retraso mental, sordera o ceguera. En consecuencia, los CDC aconsejan a las mujeres embarazadas que tengan especial cuidado en la preparación de la carne, la jardinería y el cuidado de los gatos domésticos. 6 El diagnóstico de la infección por toxoplasmosis durante el embarazo generalmente se logra mediante serología, incluyendo la prueba TORCH (la “T” en TORCH significa toxoplasmosis). El diagnóstico de infecciones congénitas también se puede lograr detectando ADN de T. gondii en líquido amniótico, utilizando métodos moleculares como la PCR.
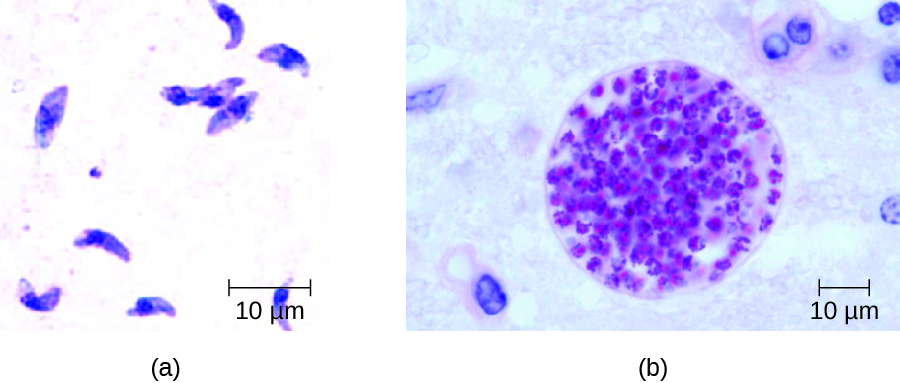
En adultos, el diagnóstico de toxoplasmosis puede incluir la observación de quistes tisulares en especímenes de tejido. Se pueden observar quistes tisulares en especímenes de biopsia teñidos de Giemsa o Wright, y también se pueden usar tomografía computarizada, resonancia magnética y punción lumbar para confirmar la infección (Figura\(\PageIndex{4}\)).
Prevenir la infección es la mejor defensa de primera línea contra la toxoplasmosis. Las medidas preventivas incluyen lavarse bien las manos después de manipular carne cruda, tierra o arena para gatos, y evitar el consumo de verduras posiblemente contaminadas con heces de gato. Toda la carne debe cocinarse a una temperatura interna de 73.9—76.7 °C (165—170 °F).
La mayoría de los pacientes inmunocompetentes no requieren intervención clínica para infecciones por Toxoplasma. Sin embargo, los recién nacidos, las mujeres embarazadas y las pacientes inmunodeprimidas pueden ser tratados con pirimetamina y sulfadiazina, excepto durante el primer trimestre del embarazo, ya que estos medicamentos pueden causar defectos congénitos. La espiramicina se ha utilizado de manera segura para reducir la transmisión en mujeres embarazadas con infección primaria durante el primer trimestre debido a que no cruza la placenta.
Ejercicio\(\PageIndex{2}\)
¿Cómo infecta T. gondii a los humanos?
Babesiosis
La babesiosis es una rara enfermedad infecciosa zoonótica causada por Babesia spp. Estos protozoos parásitos infectan a diversos animales salvajes y domésticos y pueden ser transmitidos a los humanos por garrapatas Ixodes de patas negras. En humanos, la Babesia infecta los glóbulos rojos y se replica dentro de la célula hasta que se rompe. La Babesia liberada de los glóbulos rojos rotos continúan el ciclo de crecimiento invadiendo otros glóbulos rojos. Los pacientes pueden ser asintomáticos, pero aquellos que sí presentan síntomas suelen experimentar inicialmente malestar general, fatiga, escalofríos, fiebre, dolor de cabeza, mialgia y artralgia. En casos raros, particularmente en pacientes asplénicos (ausencia de bazo), ancianos y pacientes con SIDA, la babesiosis puede parecerse a la malaria falciparum, con fiebre alta, anemia hemolítica, hemoglobinuria (hemoglobina o sangre en orina), ictericia e insuficiencia renal, y la infección puede ser fatal. La infección por Babesia asintomática previamente adquirida puede llegar a ser sintomática si se realiza una esplenectomía.
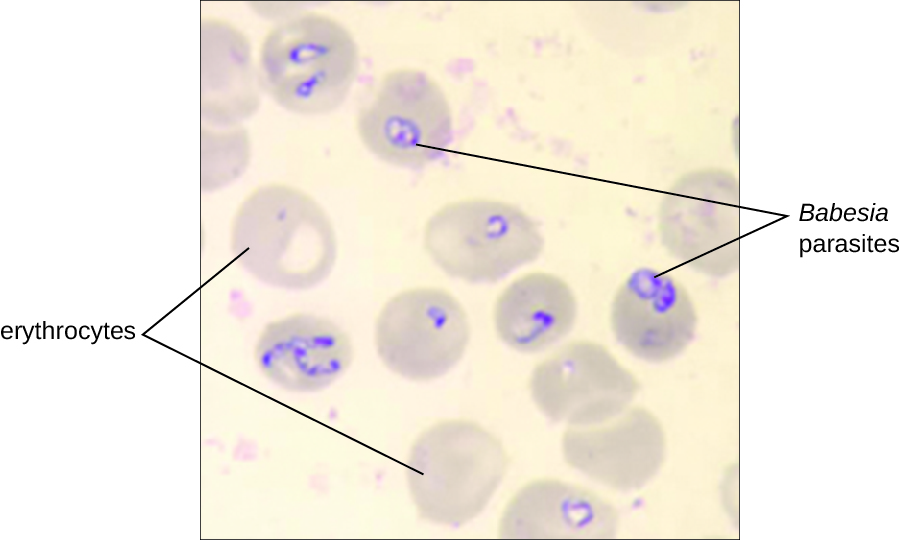
El diagnóstico se basa principalmente en la observación microscópica de parásitos en frotis de sangre (Figura\(\PageIndex{5}\)). También se puede realizar detección serológica y de anticuerpos por IFA y se dispone de pruebas basadas en PCR. Muchas personas no requieren intervención clínica para las infecciones por Babesia, sin embargo, las infecciones graves se pueden eliminar con una combinación de atovaquona y azitromicina o una combinación de clindamicina y quinina.
Enfermedad de Chagas
También llamada tripanosomiasis americana, la enfermedad de Chagas es una zoonosis clasificada como una enfermedad tropical desatendida (NTD). Es causada por el protozoo flagelado Trypanosoma cruzi y se transmite más comúnmente a animales y personas a través de las heces de bichos triatominos. El insecto triatomino es apodado el chinche besador porque frecuentemente pica a los humanos en la cara o alrededor de los ojos; el insecto a menudo defeca cerca de la picadura y la materia fecal infectada puede ser frotada en la herida de la picadura por el individuo mordido (Figura\(\PageIndex{6}\)). La picadura en sí es indolora y, inicialmente, muchas personas no muestran signos de la enfermedad. Los modos alternativos de transmisión incluyen transfusiones de sangre contaminada, trasplantes de órganos de donantes infectados y transmisión congénita de madre a feto.
La enfermedad de Chagas es endémica en gran parte de México, Centroamérica y Sudamérica, donde, según la OMS, se estima que entre 6 millones y 7 millones de personas están infectadas. 7 Actualmente, la enfermedad de Chagas no es endémica en EU, a pesar de que en la mitad sur del país se encuentran chinches triatominos.
Los insectos triatominos suelen estar activos por la noche, cuando toman comidas de sangre mordiendo las caras y los labios de personas o animales mientras duermen y a menudo defecan cerca del sitio de la picadura. La infección ocurre cuando el huésped se frota las heces en los ojos, la boca, la herida por mordedura u otra rotura en la piel. El protozoo ingresa entonces a la sangre e invade tejidos del corazón y sistema nervioso central, así como macrófagos y monocitos. Los reservorios no humanos de parásitos de T. cruzi incluyen animales salvajes y animales domesticados como perros y gatos, que también actúan como reservorios del patógeno. 8
Hay tres fases de la enfermedad de Chagas: aguda, intermedia y crónica. Estas fases pueden ser asintomáticas o potencialmente mortales dependiendo del estado de inmunocompetencia del paciente.
En la enfermedad de fase aguda, los síntomas incluyen fiebre, dolor de cabeza, mialgia, sarpullido, vómitos, diarrea y agrandamiento del bazo, hígado y ganglios linfáticos. Además, se puede formar un nódulo localizado llamado chagoma en el portal de entrada, y se puede presentar hinchazón de los párpados o del costado de la cara, llamado signo de Romaña, cerca de la herida por mordedura. Los síntomas de la fase aguda pueden resolverse espontáneamente, pero si no se trata, la infección puede persistir en los tejidos, causando daños irreversibles en el corazón o el cerebro. En casos raros, los niños pequeños pueden morir de miocarditis o meningoencefalitis durante la fase aguda de la enfermedad de Chagas.
Después de la fase aguda se encuentra una fase intermedia prolongada durante la cual se encuentran pocos o ningún parásito en la sangre y la mayoría de las personas son asintomáticas. Muchos pacientes permanecerán asintomáticos de por vida; sin embargo, décadas después de la exposición, se estima que entre 20% y 30% de las personas infectadas desarrollarán una enfermedad crónica que puede ser debilitante y a veces potencialmente mortal. En la fase crónica, los pacientes pueden desarrollar hinchazón dolorosa del colon, lo que lleva a torsiones severas, estreñimiento y obstrucción intestinal; hinchazón dolorosa del esófago, que conduce a disfagia y desnutrición; y cardiomegalia flácida (agrandamiento del corazón), que puede conducir a insuficiencia cardíaca y muerte súbita .
El diagnóstico se puede confirmar a través de varias pruebas diferentes, incluyendo observación microscópica directa de tripanosomas en la sangre, IFA, EIA, PCR y cultivo en medios artificiales. En regiones endémicas, se pueden utilizar xenodiagnoses; este método implica permitir que las chinches besadoras no infectadas se alimenten del paciente y luego examinar sus heces para detectar la presencia de T. cruzi.
Los medicamentos nifurtimox y benznidazol son tratamientos efectivos durante la fase aguda de la enfermedad de Chagas. La eficacia de estos fármacos es mucho menor cuando la enfermedad se encuentra en fase crónica. Evitar la exposición al patógeno a través del control de vectores es el método más efectivo para limitar esta enfermedad.
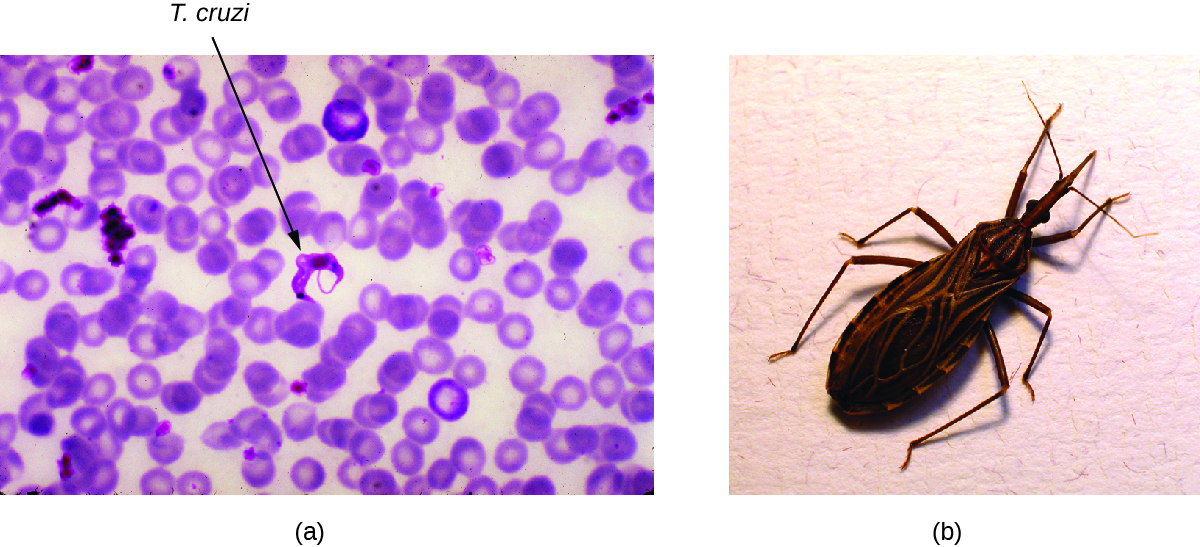
Ejercicio\(\PageIndex{3}\)
¿Cómo infectan los insectos besadores a los humanos con Trypanosoma cruzi?
Leishmaniasis
Aunque está clasificada como DTN, la leishmaniasis está relativamente extendida en regiones tropicales y subtropicales, afectando a personas en más de 90 países. Es causada por aproximadamente 20 especies diferentes de Leishmania, parásitos protozoarios que son transmitidos por vectores de moscas de la arena como Phlebotomus spp. y Lutzomyia spp. Perros, gatos, ovejas, caballos, roedores de ganado y humanos pueden servir como reservorios.
El protozoo de Leishmania es fagocitado por macrófagos pero utiliza factores de virulencia para evitar la destrucción dentro del fagolisosoma. Los factores de virulencia inhiben las enzimas fagolisosómicas que de otro modo destruirían al parásito. El parásito se reproduce dentro del macrófago, lo lisa y la progenie infecta nuevos macrófagos (ver Micro Conexiones: Cuando falla la fagocitosis).
Las tres principales formas clínicas de leishmaniasis son cutánea (llaga oriental, hervor de Delhi, ebullición de Alepo), visceral (kala-azar, fiebre de Dumdum) y mucosa (espundios). La forma más común de enfermedad es la leishmaniasis cutánea, la cual se caracteriza por la formación de llagas en el sitio de la picadura de insecto que pueden comenzar como pápulas o nódulos antes de convertirse en úlceras grandes (Figura\(\PageIndex{7}\)).
La leishmaniasis visceral puede tardar meses y a veces años en desarrollarse, lo que lleva al agrandamiento de los ganglios linfáticos, el hígado, el bazo y la médula ósea. El daño a estos sitios del cuerpo desencadena fiebre, pérdida de peso e hinchazón del bazo y el hígado. También provoca una disminución en el número de glóbulos rojos (anemia), glóbulos blancos (leucopenia) y plaquetas (trombocitopenia), provocando que el paciente se vuelva inmunocomprometido y sea más susceptible a infecciones fatales de los pulmones y del tracto gastrointestinal.
La forma mucosa de la leishmaniasis es una de las formas menos comunes de la enfermedad. Causa una lesión similar a la forma cutánea pero la leishmaniasis mucosa se asocia con membranas mucosas de la boca, narinas o faringe, y puede ser destructiva y desfigurante. La leishmaniasis mucosa ocurre con menor frecuencia cuando la infección cutánea original (piel) es tratada rápidamente.
El diagnóstico definitivo de leishmaniasis se realiza visualizando organismos en frotis teñidos con Giemsa, aislando protozoos de Leishmania en cultivos o mediante ensayos basados en PCR de aspirados de tejidos infectados. Las sondas de ADN específicas o el análisis de parásitos cultivados pueden ayudar a distinguir las especies de Leishmania que están causando leishmaniasis cutánea simple de aquellas capaces de causar leishmaniasis mucosa.
Por lo general, la leishmaniasis cutánea no se trata. Las lesiones se resolverán después de semanas (o varios meses), pero pueden resultar en cicatrices. Las tasas de recurrencia son bajas para esta enfermedad. Las infecciones más graves se pueden tratar con estibogluconato (gluconato de antimonio), anfotericina B y miltefosina.

Ejercicio\(\PageIndex{4}\)
Comparar las formas mucosas y cutáneas de la leishmaniasis.
Esquistosomiasis
La esquistosomiasis (bilharzia) es una DTN causada por trematodos sanguíneos del género Schistosoma que son originarios del Caribe, Sudamérica, Medio Oriente, Asia y África. La mayoría de los casos de esquistosomiasis humana son causados por Schistosoma mansoni, S. haematobium o S. japonicum. Los esquistosomas son los únicos trematodos que invaden a través de la piel; todos los demás trematodos infectan por ingestión. La OMS estima que al menos 258 millones de personas requirieron tratamiento preventivo para la esquistosomiasis en 2014. 9
Los huéspedes humanos infectados arrojan huevos de Schistosoma en orina y heces, lo que puede contaminar hábitats de agua dulce de caracoles que sirven como hospedadores intermedios. Los huevos eclosionan en el agua, liberando miracidios, una etapa intermedia de crecimiento del Esquistosoma que infecta a los caracoles. Los miracidios maduran y se multiplican dentro de los caracoles, transformándose en cercarias que salen del caracol y entran al agua, donde pueden penetrar en la piel de nadadores y bañistas. Las cercarias migran a través del tejido humano y entran al torrente sanguíneo, donde maduran en gusanos machos y hembras adultos que se aparean y liberan óvulos fertilizados. Los óvulos viajan a través del torrente sanguíneo y penetran en diversos sitios del cuerpo, incluyendo la vejiga o el intestino, de donde se excretan en la orina o las heces para comenzar de nuevo el ciclo de vida (Figura 5.2.4).
Pocos días después de la infección, los pacientes pueden desarrollar sarpullido o picazón en la piel asociada con el sitio de penetración de las cercarias. Dentro de 1 a 2 meses de la infección, pueden desarrollarse síntomas, incluyendo fiebre, escalofríos, tos y mialgia, ya que los óvulos que no se excretan circulan por el cuerpo. Después de años de infección, los óvulos se alojan en los tejidos y desencadenan inflamación y cicatrices que pueden dañar el hígado, el sistema nervioso central, el intestino, el bazo, los pulmones y la vejiga. Esto puede causar dolor abdominal, agrandamiento del hígado, sangre en la orina o heces, y problemas para orinar. El aumento del riesgo de cáncer de vejiga también se asocia con la infección crónica por Esquistosoma. Además, los niños que se infectan repetidamente pueden desarrollar desnutrición, anemia y dificultades de aprendizaje.
El diagnóstico de esquistosomiasis se realiza mediante la observación microscópica de óvulos en heces u orina, especímenes de tejido intestinal o vesical, o pruebas serológicas. El medicamento praziquantel es efectivo para el tratamiento de todas las infecciones por esquistosomas. Mejorar la gestión de las aguas residuales y educar a las poblaciones en riesgo para limitar la exposición al agua contaminada puede ayudar a controlar la propagación de la enfermedad.
Dermatitis Cercarial
La cercaria de algunas especies de Schistosoma sólo puede transformarse en gusanos adultos y completar su ciclo de vida en hospederos animales como aves migratorias y mamíferos. Las cercarias de estos gusanos siguen siendo capaces de penetrar la piel humana, pero son incapaces de establecer una infección productiva en el tejido humano. Aún así, la presencia de la cercaria en los vasos sanguíneos pequeños desencadena una respuesta inmune, lo que resulta en protuberancias elevadas con comezón llamadas dermatitis cercarial (también conocida como picor de nadador o picazón de cavadora de almejas). Aunque es incómodo, la dermatitis cercarial suele ser autolimitante y rara vez grave. Los antihistamínicos y antipruriginosos se pueden utilizar para limitar la inflamación y el picor, respectivamente.
Ejercicio\(\PageIndex{5}\)
¿Cómo ocurren las infecciones por esquistosomas en humanos?
Patógenos eucariotas comunes del sistema circulatorio humano
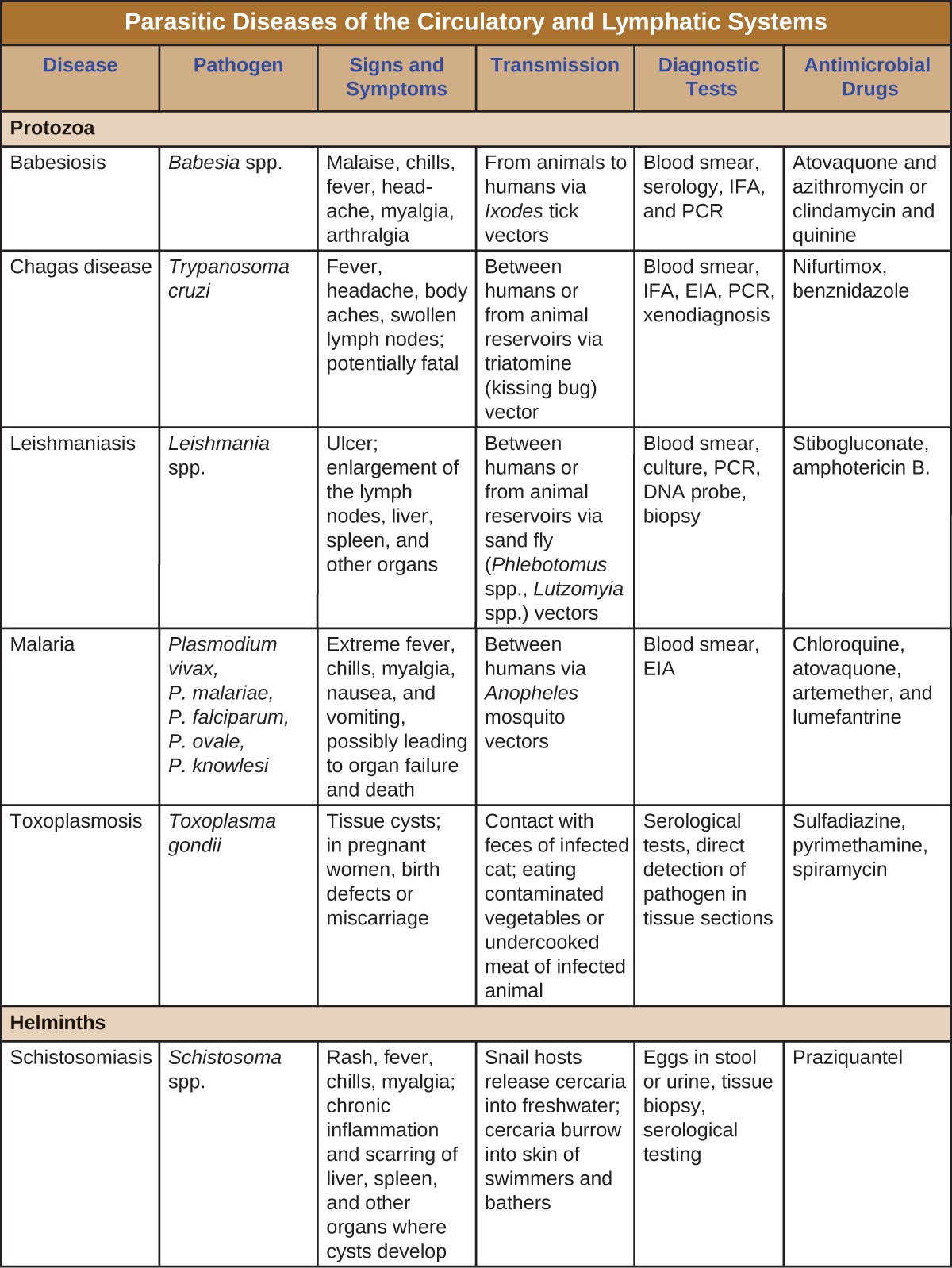
Las infecciones protozoarias y helmínticas son prevalentes en el mundo en desarrollo. Algunas de las infecciones parasitarias más importantes se resumen en la Figura\(\PageIndex{8}\).
A pesar del tratamiento antibiótico continuado y la extracción del catéter venoso, la condición de Bárbara disminuyó aún más. Comenzó a mostrar signos de shock y su presión arterial bajó a 77/50 mmHg. Se administraron antiinflamatorios y drotrecogina-α para combatir la sepsis. Sin embargo, al séptimo día de hospitalización, Bárbara experimentó insuficiencia hepática y renal y falleció.
Staphylococcus aureus probablemente formó una biopelícula en la superficie del catéter de Barbara. A partir de ahí, las bacterias se derramaron crónicamente en su circulación y produjeron los síntomas clínicos iniciales. Las terapias quimioterapéuticas fracasaron en gran parte debido al aislado de SARM resistente a fármacos. Factores de virulencia como la leucocidina y las hemolisinas también interfirieron con su respuesta inmune. La disminución final de Barbara puede haber sido consecuencia de la producción de enterotoxinas y la toxina del síndrome de choque tóxico (TSST), que pueden iniciar un shock tóxico.
Los catéteres venosos son intervenciones comunes que salvan vidas para muchos pacientes que requieren la administración a largo plazo de medicamentos o líquidos. Sin embargo, también son sitios comunes de infecciones del torrente sanguíneo. La Organización Mundial de la Salud estima que hay hasta 80 mil infecciones del torrente sanguíneo relacionadas con catéteres cada año en Estados Unidos, lo que resulta en alrededor de 20 mil muertes. 10
Conceptos clave y resumen
- La malaria es un parásito protozoario que sigue siendo una causa importante de muerte principalmente en los trópicos. Varias especies del género Plasmodium son responsables de la malaria y todas son transmitidas por mosquitos Anopheles. Plasmodium infecta y destruye los glóbulos rojos humanos, lo que provoca daño orgánico, anemia, necrosis de los vasos sanguíneos y muerte. La malaria puede tratarse con diversos fármacos antipalúdicos y prevenirse mediante el control de vectores.
- La toxoplasmosis es una infección protozoaria generalizada que puede causar infecciones graves en los fetos inmunocomprometidos y en desarrollo. Los gatos domésticos son el huésped definitivo.
- La babesiosis es una infección generalmente asintomática de glóbulos rojos que puede causar síntomas similares a la malaria en pacientes ancianos, inmunodeprimidos o asplénicos.
- La enfermedad de Chagas es una enfermedad tropical transmitida por insectos triatominos. El tripanosoma infecta corazón, tejidos neurales, monocitos y fagocitos, a menudo permaneciendo latentes durante muchos años antes de causar daños graves y a veces fatales al sistema digestivo y al corazón.
- La leishmaniasis es causada por el protozoo Leishmania y es transmitida por las moscas de la arena. Los síntomas son generalmente leves, pero los casos graves pueden causar daño orgánico, anemia y pérdida de competencia inmune.
- La esquistosomiasis es causada por una casualidad transmitida por caracoles. El trematodo se mueve por todo el cuerpo en el torrente sanguíneo e infecta crónicamente diversos tejidos, lo que lleva a daño orgánico.
Notas al pie
- 1 Organización Mundial de la Salud. “Informe Mundial de Malaria 2015: Resumen”. 2015. http://www.who.int/malaria/publicati...015/report/en/. Consultado el 28 de julio de 2016.
- 2 A.M. Tenter et al.. “Toxoplasma gondii: De los animales a los humanos”. Revista Internacional de Parasitología 30 núm. 12-13 (2000) :1217—1258.
- 3 Centros de Control y Prevención de Enfermedades. “Parásitos - Toxoplasmosis (Infección por Toxoplasma). Epidemiología y factores de riesgo.” 2015 http://www.cdc.gov/parasites/toxoplasmosis/epi.html. Consultado el 28 de julio de 2016.
- 4 J. Flegr. “Efectos del Toxoplasma en el Comportamiento Humano”. Boletín de Esquizofrenia 33, núm. 3 (2007) :757—760.
- 5 Ibíd.
- 6 Centros de Control y Prevención de Enfermedades. “Parásitos - Toxoplasmosis (infección por Toxoplasma). Toxoplasmosis Preguntas Frecuentes (FAQs).” 2013. http://www.cdc.gov/parasites/toxopla...info/faqs.html. Consultado el 28 de julio de 2016.
- 7 Organización Mundial de la Salud. “Enfermedad de Chagas (tripanosomiasis americana). Hoja Informativa.” 2016. http://www.who.int/mediacentre/factsheets/fs340/en/. Consultado el 29 de julio de 2016.
- 8 C.E. Reisenman et al. “Infección de bichos besados con Trypanosoma cruzi, Tucson, Arizona, EUA”. Enfermedades Infecciosas Emergentes 16 núm. 3 (2010) :400—405.
- 9 Organización Mundial de la Salud. “Esquistosomiasis. Hoja Informativa.” 2016. http://www.who.int/mediacentre/factsheets/fs115/en/. Consultado el 29 de julio de 2016.
- 10 Organización Mundial de la Salud. “Seguridad del paciente, prevención de infecciones del torrente sanguíneo a partir de catéteres venosos de línea central.” 2016. www.who.int/patientsafety/imp... tation/bsi/en/. Consultado el 29 de julio de 2016.


