8.5: Tacto y dolor
- Page ID
- 144006
Universidad de Oslo, Universidad de Gotemburgo
Los sistemas sensoriales de tacto y dolor nos proporcionan información sobre nuestro entorno y nuestro cuerpo que a menudo es crucial para la supervivencia y el bienestar. Además, el tacto es una fuente de placer. En este módulo, revisamos cómo la información sobre nuestro entorno y nuestro cuerpo es codificada en la periferia e interpretada por el cerebro como sensaciones de tacto y dolor. Discutimos cómo estas experiencias a menudo son moldeadas dramáticamente por factores de arriba hacia abajo como motivación, expectativa, estado de ánimo, miedo, estrés y contexto. Cuando funcionan bien, estos circuitos promueven la supervivencia y nos preparan para tomar decisiones adaptativas. La pérdida patológica del contacto puede resultar en una desconexión percibida del cuerpo, y la insensibilidad al dolor puede ser muy peligrosa, lo que lleva a un comportamiento peligroso desadaptativo. Por otro lado, los padecimientos de dolor crónico, en los que estos sistemas comienzan a señalar dolor en respuesta al tacto inocuo o incluso en ausencia de algún estímulo sensorial observable, tienen un tremendo impacto negativo en la vida de los afectados. Comprender cómo nuestros mecanismos de procesamiento sensorial pueden modularse psicológica y fisiológicamente promete ayudar a investigadores y médicos a encontrar nuevas formas de aliviar el sufrimiento de los pacientes con dolor crónico.
objetivos de aprendizaje
- Describir la transducción de señales somatosensoriales: Las propiedades de los tipos de receptores así como la diferencia en las propiedades de los aferentes C y aferentes A y qué funciones se cree que tienen estos.
- Describir la hipótesis del toque social y el papel del toque afectivo en el desarrollo y la vinculación.
- Explique el modelo motivación-decisión y la modulación descendente del dolor, y dé ejemplos sobre cómo este circuito puede promover la supervivencia.
- Explicar cómo las expectativas y el contexto afectan las experiencias de dolor y tacto.
- Describir el concepto de dolor crónico y por qué el tratamiento es tan difícil.
Introducción
Imagina una vida libre de dolor. ¿Cómo sería: tranquilo, intrépido, sereno? ¿Te sentirías invulnerable, invencible? Deshacerse del dolor es una misión popular: una búsqueda rápida de “vida sin dolor” en Google devuelve más de 4 millones de visitas, incluidos enlaces a varias guías de autoayuda más vendidas que prometen una vida sin dolor en solo 7 pasos, 6 semanas o 3 minutos. El manejo del dolor es un mercado de mil millones de dólares e involucra mucho más que solo productos farmacéuticos. Seguramente una vida sin dolor sería mejor?
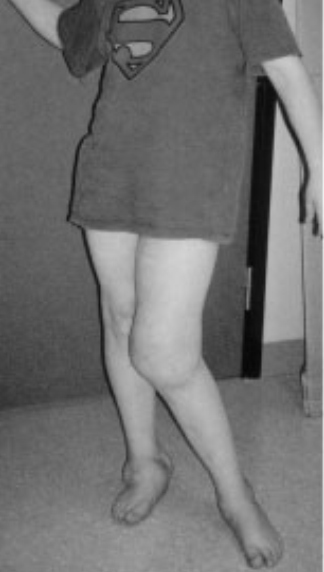
Bueno, considera uno de los “pocos afortunados”: “Thomas”, de 12 años, nunca ha sentido un dolor profundo. Ni siquiera cuando una fractura lo hizo caminar con una pierna más corta que la otra, de manera que los huesos de su pierna sana fueron aplastados lentamente hasta la destrucción debajo de la articulación de la rodilla (ver Figura 8.5.1). Para Thomas y otros miembros de una gran familia sueca, la vida sin dolor es una dura realidad debido a un gen mutado que afecta el crecimiento de los nervios conduciendo un dolor profundo. La mayoría de los afectados sufren daño articular y frecuentes fracturas en huesos de pies y manos; algunos terminan en sillas de ruedas incluso antes de llegar a la pubertad (Minde et al., 2004). Resulta que el dolor, en general, nos sirve bien.
Vivir sin sentido del tacto suena menos atractivo que estar libre de dolor; el tacto es una fuente de placer y esencial para cómo nos sentimos. Perder el sentido del tacto tiene graves implicaciones, algo que la paciente G. L. experimentó cuando un tratamiento con antibióticos dañó el tipo de nervios que señalan el contacto de su piel y la posición de sus articulaciones y músculos. Ella reportó sentir que había perdido su yo físico de la nariz para abajo, haciéndola “desencarnada” —como si ya no tuviera ninguna conexión con el cuerpo adherido a su cabeza. Si no miraba sus brazos y piernas, simplemente podían “vagar” sin que ella lo supiera, inicialmente no podía caminar, e incluso después de volver a aprender esta habilidad dependía tanto de su atención visual que cerrar los ojos la haría aterrizar en un montón desesperado en el suelo. Sólo las caricias ligeras como las de las manos de sus hijos pueden hacerle sentir que tiene un cuerpo, pero incluso estas sensaciones siguen siendo vagas y esquivas (Olausson et al., 2002; Sacks, 1985).
Sensación
Los sentidos cutáneos de la piel conectan el cerebro con el cuerpo y el mundo exterior
El tacto y el dolor son aspectos del sistema somatosensorial, que proporciona a nuestro cerebro información sobre nuestro propio cuerpo (interocepción) y propiedades del mundo externo inmediato (exterocepción) (Craig, 2002). Contamos con receptores somatosensoriales ubicados en todo el cuerpo, desde la superficie de nuestra piel hasta la profundidad de nuestras articulaciones. La información que envían al sistema nervioso central se divide generalmente en cuatro modalidades: sentidos cutáneos (sentidos de la piel), propiocepción (posición corporal), cinestesia (movimiento corporal) y nocicepción (dolor, malestar). Nos vamos a centrar en los sentidos cutáneos, que responden a estímulos táctiles, térmicos y pruriginosos (picazón), y eventos que causan daño tisular (y por lo tanto dolor). Además, cada vez hay más evidencias de una quinta modalidad específicamente canalizando el tacto agradable (McGlone & Reilly, 2010).
Diferentes tipos de receptores son sensibles a estímulos específicos
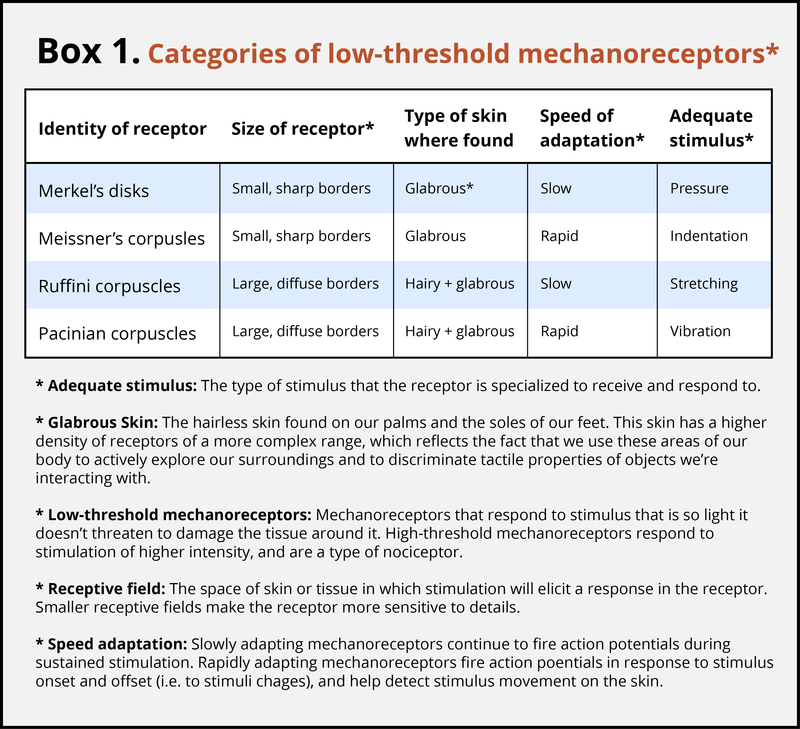
La piel puede transmitir muchas sensaciones, como el frío mordaz de un viento, la cómoda presión de una mano que sostiene la suya o el picor irritante de una bufanda de lana. Los diferentes tipos de información activan receptores específicos que convierten la estimulación de la piel en impulsos nerviosos eléctricos, un proceso llamado transducción. Hay tres grupos principales de receptores en nuestra piel: mecanorreceptores, que responden a estímulos mecánicos, como caricias, estiramientos o vibraciones de la piel; termorreceptores, que responden a temperaturas frías o calientes; y quimiorreceptores, que responden a ciertos tipos de químicos aplicados externamente o liberados dentro de la piel (como la histamina de una inflamación). Para una visión general de los diferentes tipos de receptores y sus propiedades, consulte el Cuadro 1. La experiencia del dolor generalmente comienza con la activación de nociceptores, receptores que disparan específicamente a estímulos potencialmente dañinos para los tejidos. La mayoría de los nociceptores son subtipos de quimiorreceptores o mecanorreceptores. Cuando el tejido está dañado o inflamado, ciertas sustancias químicas se liberan de las células, y estas sustancias activan los nociceptores quimiosensibles. Los nociceptores mecanoreceptivos tienen un alto umbral de activación, responden a la estimulación mecánica que es tan intensa que podría dañar el tejido.
Los potenciales de acción en las células receptoras viajan como impulsos nerviosos con diferentes velocidades
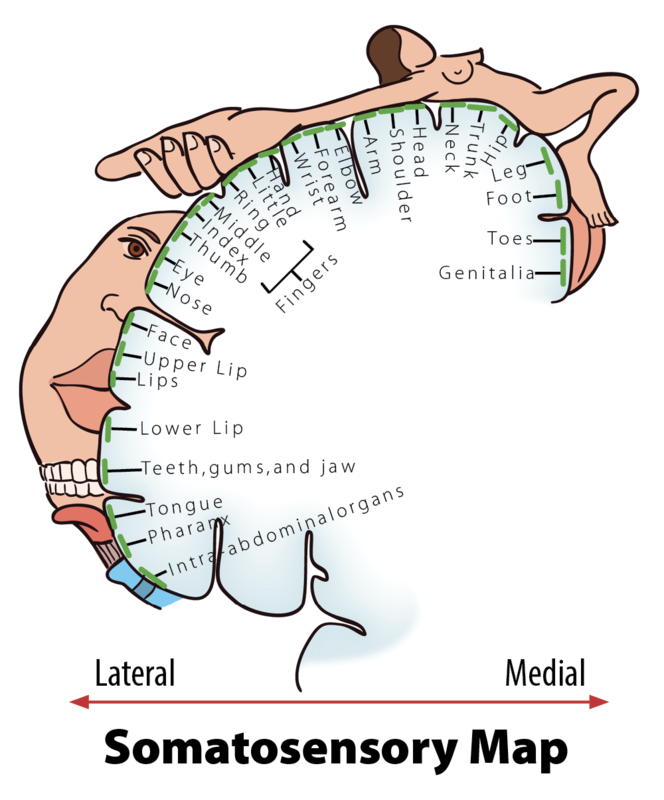
Cuando pisas un alfiler, esto activa una gran cantidad de mecanorreceptores, muchos de los cuales son nociceptores. Es posible que hayas notado que la sensación cambia con el tiempo. Primero sientes una puñalada aguda que te impulsa a quitarte el pie, y sólo entonces sientes una ola de dolor más dolorido. La puñalada aguda se señala a través de fibras A de rápida conducción, que se proyectan hacia la corteza somatosensorial. Esta parte de la corteza está organizada somatópicamente, es decir, las señales sensoriales se representan de acuerdo a donde en el cuerpo provienen (ver ilustraciones, Figura 8.5.2). El dolor desagradable que sientes después de la puñalada afilada es una señal separada y simultánea enviada desde los nociceptores en tu pie a través del dolor C delgado o fibras Aδ-a la corteza insular y otras regiones cerebrales involucradas en el procesamiento de la emoción y la interocepción (ver Figura 8.5.3 para un representación esquemática de esta vía). La experiencia de pisar un pin está, en otras palabras, compuesta por dos señales separadas: una señal discriminatoria que nos permite localizar el estímulo táctil y distinguir si se trata de una puñalada contundente o aguda; y una señal afectiva que nos permite saber que pisar el pin es malo. Es común dividir el dolor en aspectos sensoriales —discriminatorios y afectivos— motivacionales (Auvray, Myin, & Spence, 2010). Esta distinción corresponde, al menos en parte, a cómo viaja esta información del sistema nervioso periférico al sistema nervioso central y a cómo se procesa en el cerebro (Price, 2000).
Los aspectos afectivos del tacto son importantes para el desarrollo y las relaciones
Los sentidos táctiles no solo están ahí para la discriminación o detección de eventos potencialmente dolorosos, como demostraron Harlow y Suomi (1970) en una serie de experimentos desgarradores donde los monos bebés fueron tomados de sus madres. Los monos infantiles podían elegir entre dos madres sustitutas artificiales, una madre “caliente” sin comida pero con una cubierta suave y peluda; y una madre fría de acero con comida. Los bebés mono pasaron la mayor parte de su tiempo aferrándose a la madre suave, y solo se trasladaron brevemente a la madre dura y de acero para alimentarse, lo que indica que el tacto es de “importancia sobrecogedora” para el infante (Harlow y Suomi, 1970, p. 161). El tacto suave es fundamental para crear y mantener relaciones sociales en los primates; se arreglan entre sí acariciando el pelaje y eliminando parásitos, una actividad importante no solo para su bienestar individual sino también para la cohesión grupal (Dunbar, 2010; Keverne, Martensz, & Tuite, 1989). Aunque la gente no se arregla de la misma manera, el tacto suave también es importante para nosotros.
El sentido del tacto es el primero en desarrollarse mientras uno está en el útero, y los bebés humanos anhelan el tacto desde el momento en que nacen. A partir de estudios de huérfanos humanos, sabemos que el tacto también es crucial para el desarrollo humano. En orfanatos rumanos donde se alimentaba a los bebés pero no se les daba atención regular ni contacto físico, los niños sufrieron retraso cognitivo y neurodesarrollo (Simons & Land, 1987). El contacto físico ayuda a que un bebé que llora se calme, y se cree que el toque calmante que una madre le da a su hijo reduce los niveles de hormonas del estrés como el cortisol. Los altos niveles de cortisol tienen efectos negativos en el desarrollo neural, e incluso pueden conducir a la pérdida celular (Feldman, Singer, & Zagoory, 2010; Fleming, O'Day, & Kraemer, 1999; Pechtel & Pizzagalli, 2011). Por lo tanto, la reducción del estrés a través de abrazos y caricias podría ser importante no sólo para el bienestar de los niños, sino también para el desarrollo del cerebro infantil.
Los sentidos de la piel son similares en todas las especies, probablemente reflejando la ventaja evolutiva de poder decir lo que te está tocando, dónde está sucediendo y si es probable que cause daño tisular o no. Una intrigante línea de investigación táctil sugiere que los humanos, los gatos y otros animales tienen un sistema especial, evolutivamente conservado que promueve el tacto suave porque tiene un significado social y emocional. A nivel periférico, este sistema consiste en un subtipo de fibras C que responde no a estímulos dolorosos, sino al tacto suave de caricias, llamadas fibras C-táctiles. La velocidad de disparo de las fibras táctiles C se correlaciona estrechamente con lo agradable que se siente la caricia, sugiriendo que están codificando específicamente para las suaves caricias típicas del toque social afiliativo (Löken, Wessberg, Morrison, McGlone, & Olausson, 2009). Este hallazgo ha llevado a la hipótesis del toque social, que propone que las fibras C-táctiles forman un sistema de percepción táctil que apoya la vinculación social (Morrison, Löken, & Olausson, 2010; Olausson, Wessberg, Morrison, McGlone, & Vallbo, 2010). El descubrimiento del sistema C-táctil sugiere que el tacto se organiza de manera similar al dolor; las fibras A de conducción rápida contribuyen a aspectos sensorios—discriminatorios, mientras que las fibras C delgadas contribuyen a aspectos afectivos-motivacionales (Löken, Wessberg, Morrison, McGlone, & Olausson, 2009). Sin embargo, si bien estos sistemas aferentes “cableados” a menudo nos proporcionan información precisa sobre nuestro entorno y nuestro cuerpo, la forma en que experimentamos el tacto o el dolor depende en gran medida de fuentes de arriba hacia abajo como la motivación, la expectativa, el estado de ánimo, el miedo y el estrés.
Modulación
El dolor es necesario para la supervivencia, pero nuestro cerebro puede detenerlo si es necesario
En abril de 2003, el escalador Aron Ralston se encontró en el piso de Blue John Canyon en Utah, obligado a tomar una decisión espantosa: enfrentar una muerte lenta pero cierta, o amputarle el brazo derecho. Cinco días antes se cayó por el cañón, desde entonces había estado atrapado con el brazo derecho atrapado entre una roca de 800 libras y el empinado muro de arenisca. Débil por falta de comida y agua y cerca de darse por vencido, se le ocurrió como una epifanía que si le rompía los dos huesos del antebrazo podría lograr cortar el resto con su navaja de bolsillo. El pensamiento de liberarse y sobrevivir lo hizo salir tanto que pasó los siguientes 40 minutos completamente absorto en la tarea: primero chasqueando sus huesos usando su cuerpo como palanca, luego metiendo los dedos en el brazo, pellizcando haces de fibras musculares y cortándolos uno por uno, antes de cortar el azul arterias y los nervios pálidos “similares a los de los nódulos”. El dolor no era importante. Solo cortar el grueso nervio principal blanco lo hizo detenerse por un minuto; la avalancha de dolor, describe, fue como meter todo su brazo “en un caldero de magma”. Finalmente libre, rapeló por un acantilado y caminó otras 7 millas hasta que fue rescatado por algunos excursionistas (Ralston, 2010). ¿Cómo es posible hacerte algo tan insoportablemente doloroso, y aún así lograr caminar, hablar y pensar racionalmente después? La respuesta se encuentra dentro del cerebro, donde se interpretan las señales del cuerpo. Cuando percibimos señales somatosensoriales y nociceptivas del cuerpo, la experiencia es altamente subjetiva y maleable por motivación, atención, emoción y contexto.
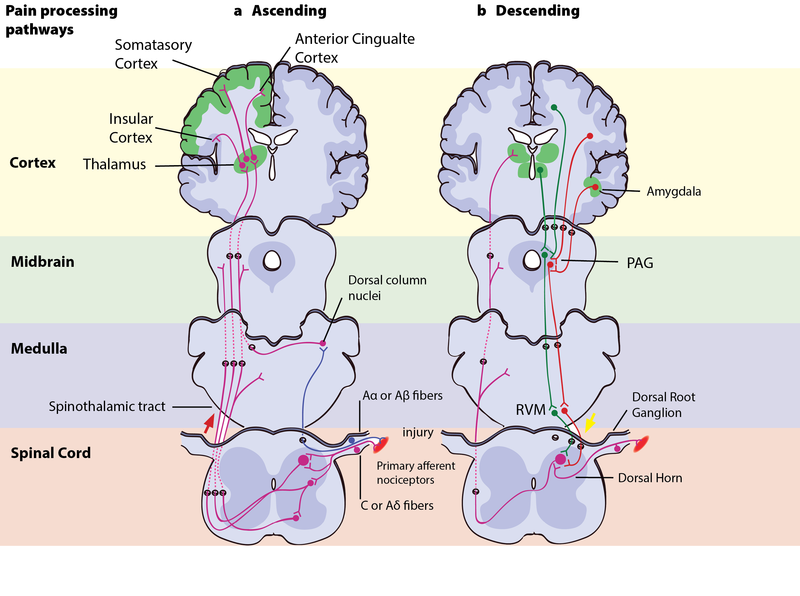
Vías izquierdas - ascendentes del dolor: Una lesión se señaliza simultáneamente a través de fibras Aα o Aβ de conducción rápida y C-dolor o fibras Aδ-conductoras lentas. Las fibras A rápidas señalan presión, estiramiento y otros movimientos del tejido a la corteza somatosensorial a través de los núcleos de la columna dorsal. Las fibras C-pain y Aδ-envían información de dolor de nociceptores en el tejido o la piel, y transmiten estas señales a neuronas de segundo orden en el cuerno dorsal de la médula espinal. Las neuronas de segundo orden luego cruzan hacia el lado opuesto, donde forman el tracto espinotalámico ascendente. Este tracto proyecta señales a núcleos en la médula y mesencéfalo en el camino hacia el tálamo (T). El tálamo transmite la información a la corteza somatosensorial e insular, así como a regiones corticales que median diferentes aspectos de la experiencia del dolor como las respuestas afectivas en la corteza cingulada.
Derecha - Vías descendentes de modulación del dolor: La información del entorno y ciertos estados motivacionales pueden activar esta vía de arriba hacia abajo. Varias áreas en el prosencéfalo límbico incluyendo la corteza cingulada e insular anterior, núcleos en la amígdala y el hipotálamo (H), se proyectan hacia el mesencéfalo gris periacueductal (PAG), que luego modula la transmisión ascendente del dolor desde el sistema de dolor aferente indirectamente a través del ventromedial rostral médula (RVM) en el tronco encefálico. Este sistema modulador produce analgesia por la liberación de opioides endógenos, y utiliza células ON y OFF para ejercer un control inhibitorio (verde) o facilitador (rojo) de las señales nociceptivas en el asta dorsal espinal.
El modelo motivación-decisión y la modulación descendente del dolor
Según el modelo motivación-decisión, el cerebro evalúa automática y continuamente los pros y los contras de cualquier situación, sopesando las amenazas inminentes y las recompensas disponibles (Fields, 2004, 2006). Cualquier cosa más importante para la supervivencia que evitar el dolor activa el sistema modulador del dolor descendente del cerebro, un sistema de arriba hacia abajo que involucra varias partes del cerebro y del tronco encefálico, que inhibe la señalización nociceptiva para que se puedan atender las acciones más importantes. En el caso extremo de Aron, sus acciones probablemente se basaron en un proceso de decisión tan inconsciente, teniendo en cuenta su estado homeostático (su hambre, sed, la inflamación y descomposición de su mano aplastada afectando lentamente al resto de su cuerpo), la entrada sensorial disponible (el dulce olor de su piel en disolución, el silencio a su alrededor indicando su soledad), y su conocimiento sobre las amenazas que enfrenta (muerte, o dolor insoportable que no lo matará) versus las posibles recompensas (supervivencia, volver a ver a su familia). La historia de Aron ilustra la ventaja evolutiva de poder apagar el dolor: El sistema modulador del dolor descendente nos permite pasar por acciones potencialmente salvadoras de vidas. Sin embargo, cuando uno ha alcanzado la seguridad u obtenido la recompensa, la curación es más importante. El mismo sistema descendente puede entonces “activar” la nocicepción del cuerpo para promover la curación y motivarnos a evitar acciones potencialmente dolorosas. Para facilitar o inhibir las señales nociceptivas del cuerpo, el sistema modulador del dolor descendente utiliza un conjunto de células ON o OFF en el tronco encefálico, que regula la cantidad de la señal nociceptiva que llega al cerebro. El sistema descendente depende de la señalización opioide, y analgésicos como la morfina alivian el dolor a través de este circuito (Petrovic, Kalso, Petersson, & Ingvar, 2002).
El poder analgésico de la recompensa

Pensar en las cosas buenas, como sus seres queridos y la vida por delante, probablemente fue fundamental para la supervivencia de Aron. La promesa de una recompensa puede ser suficiente para aliviar el dolor. Esperar alivio del dolor (obtener menos dolor suele ser el mejor resultado posible si tienes dolor, es decir, es una recompensa) de un tratamiento médico contribuye al efecto placebo, donde el alivio del dolor se debe al menos en parte al circuito de modulación descendente de tu cerebro, y tal alivio depende del cerebro propio sistema opioide (Elippert et al., 2009; Elippert, Finsterbusch, Bingel, & Buchel, 2009; Levine, Gordon, & Fields, 1978). Comer comida sabrosa, escuchar buena música o sentir un tacto agradable en la piel también disminuye el dolor tanto en animales como en humanos, presumiblemente a través del mismo mecanismo en el cerebro (Leknes & Tracey, 2008). En un experimento ahora clásico, Dum y Herz (1984) alimentaron a las ratas con comida normal para ratas o las dejaron darse un festín con dulces cubiertos de chocolate altamente gratificantes (a las ratas les encantan los dulces) mientras estaban de pie sobre un plato de metal hasta que aprendieron exactamente qué esperar cuando se colocaron allí. Cuando el plato se calentó hasta un nivel nocivo/doloroso, las ratas que esperaban dulces soportaron la temperatura el doble de tiempo que las ratas que esperaban comida normal. Además, este efecto fue completamente abolido cuando el sistema opioide (endorfina) de las ratas se bloqueó con un medicamento, lo que indica que el efecto analgésico de la anticipación de recompensa fue causado por la liberación de endorfinas.
Para Aron el escalador, tanto el estrés por saber que la muerte era inminente como la anticipación de la recompensa que sería sobrevivir probablemente inundó su cerebro de endorfinas, contribuyendo a la ola de emoción y euforia que experimentó mientras realizaba la amputación “como desató un niño de cinco años en sus regalos de Navidad” (Ralston, 2010). Esto alteró su experiencia del dolor por el daño tisular extremo que estaba causando y le permitió concentrarse en liberarse. Nuestro cerebro, resulta, puede modular la percepción de lo desagradable que es el dolor, al tiempo que conserva la capacidad de experimentar la intensidad de la sensación (Rainville, Duncan, Price, Carrier, & Bushnell, 1997; Rainville, Feine, Bushnell, & Duncan, 1992). Las recompensas sociales, como tomar la mano de tu novio o novia, tienen efectos reductores del dolor. Incluso mirar una foto de él/ella puede tener efectos similares, de hecho, ver una imagen de una persona a la que nos sentimos cercanos no solo reduce las calificaciones subjetivas del dolor, sino también la actividad en áreas cerebrales relacionadas con el dolor (Eisenberger et al., 2011). Las cosas más comunes que se deben hacer cuando se quiere ayudar a alguien a través de una experiencia dolorosa —estar presente y sostener la mano de la persona—, por lo tanto, parece tener un efecto mediblemente positivo.
Cuando el tacto se vuelve doloroso o el dolor se vuelve crónico
Lo más probable es que te hayan quemado el sol varias veces en tu vida y hayas experimentado cómo incluso la palmadita más ligera en la espalda o la ropa más suave pueden sentir dolor en tu piel sobresensible. Esta condición, donde el tacto inocuo da una sensación de ardor y sensibilidad, es similar a una afección crónica llamada alodinia —donde la enfermedad o lesión neuronal hace que el tacto que normalmente es agradable se sienta desagradablemente doloroso. En la alodinia, la lesión neuronal en el cuerno dorsal espinal provoca que los Aβ-aferentes, que se activan por el tacto no nociceptivo, accedan a vías nociceptivas (Liljencrantz et al., 2013). El resultado es que incluso el tacto suave es interpretado por el cerebro como doloroso. Si bien una respuesta de dolor agudo a estímulos nocivos tiene una función protectora vital, la alodinia y otras afecciones de dolor crónico constituyen una tremenda fuente de sufrimiento innecesario que afecta a millones de personas. Aproximadamente 100 millones de estadounidenses sufren de dolor crónico, y el costo económico anual asociado se estima en $560-635 mil millones (Committee on Advance Pain Research, Care, & Institute of Medicine, 2011). Las afecciones de dolor crónico son muy diversas y pueden implicar cambios en los niveles periférico, espinal, central y psicológico. Los mecanismos están lejos de entenderse completamente, y desarrollar un tratamiento adecuado sigue siendo un gran desafío para los investigadores del dolor.
Las afecciones de dolor crónico a menudo comienzan con una lesión en un nervio periférico o en el tejido que lo rodea, liberando hormonas y moléculas inflamatorias que sensibilizan a los nociceptores. Esto hace que el nervio y los aferentes vecinos sean más excitables, de manera que también los nervios ilesos se vuelven hiperexcitables y contribuyen a la persistencia del dolor. Una lesión también podría hacer que las neuronas se disparen sin parar independientemente de los estímulos externos, proporcionando una entrada casi constante al sistema del dolor. La sensibilización también puede ocurrir en el cerebro y en el sistema modulador descendente del tronco encefálico (Zambreanu, Wise, Brooks, Iannetti, & Tracey, 2005). Exactamente en qué niveles se altera la percepción del dolor en los pacientes con dolor crónico puede ser extremadamente difícil de identificar, haciendo del tratamiento un proceso a menudo agotador de ensayo y error. El sufrimiento de dolor crónico tiene impactos dramáticos en la vida de los afligidos. Estar en dolor durante más tiempo puede conducir a depresión, ansiedad (miedo o anticipación de dolor futuro) e inmovilización, todo lo cual a su vez puede exacerbar el dolor (Wiech & Tracey, 2009). La emoción negativa y la atención al dolor pueden aumentar la sensibilización al dolor, posiblemente manteniendo el sistema modulador descendente del dolor en modo de facilitación. Por lo tanto, la distracción es una técnica de uso común en hospitales donde los pacientes tienen que someterse a tratamientos dolorosos como cambiar vendas en quemaduras grandes. Sin embargo, para los pacientes con dolor crónico, desviar la atención no es una solución a largo plazo. Factores positivos como el apoyo social pueden reducir el riesgo de dolor crónico después de una lesión, y así pueden ayudar a adaptarse al cambio corporal como resultado de una lesión. Ya hemos hablado de cómo tener una mano que sostener podría aliviar el sufrimiento. El tratamiento del dolor crónico debe apuntar a estos factores emocionales y sociales así como a los fisiológicos.
El poder de la mente

El contexto del dolor y el tacto tiene un gran impacto en la forma en que lo interpretamos. Solo imagina lo diferente que se sentiría para Aron si alguien le amputara la mano contra su voluntad y sin razón discernible. El dolor prolongado por lesiones puede ser más fácil de soportar si el incidente que las causa proporciona un contexto positivo, como una herida de guerra que atestigua el coraje y compromiso de un soldado, o el dolor fantasma de una mano que fue cortada para permitir que la vida continúe. El significado relativo del dolor se ilustra mediante un experimento reciente, donde se administró el mismo calor moderadamente doloroso a los participantes en dos contextos diferentes: un contexto de control donde la alternativa era un calor no doloroso; y otro donde la alternativa era un calor intensamente doloroso. En el contexto testigo, donde el calor moderado fue el desenlace menos preferible, se calificó (como era de esperar) como doloroso. En el otro contexto fue el mejor resultado posible, y aquí exactamente el mismo calor moderadamente doloroso se calificó como agradable, porque significaba que se había evitado el calor intensamente doloroso. Este cambio algo sorprendente en la percepción —donde el dolor se vuelve agradable porque representa alivio de algo peor— resalta la importancia del significado que los individuos atribuyen a su dolor, que puede tener efectos decisivos en el tratamiento del dolor (Leknes et al., 2013). En el caso del tacto, saber quién o qué está acariciando tu piel puede marcar la diferencia: intenta pensar en babosas la próxima vez que alguien te acaricie la piel si quieres una ilustración de este punto. En un estudio reciente, a un grupo de varones heterosexuales se les dijo que estaban a punto de recibir caricias sensuales en la pierna ya sea por un experimentador masculino o por una experimentadora femenina atractiva (Gazzola et al., 2012). Los participantes del estudio no pudieron ver quién los estaba tocando. A pesar de que siempre fue la experimentadora femenina quien realizó la caricia, los machos heterosexuales calificaron las caricias sensuales por lo demás agradables como claramente desagradables cuando creían que el experimentador masculino lo hacía. Además, las respuestas cerebrales al “toque masculino” en la corteza somatosensorial se redujeron, ejemplificando cómo la regulación de arriba hacia abajo del tacto se asemeja a la inhibición del dolor de arriba hacia abajo.
El dolor y el placer no solo comparten sistemas moduladores, otro atributo común es que no necesitamos estar nosotros mismos en el extremo receptor para poder experimentarlo. ¿Cómo te sentiste al leer sobre Aron cortando su propio tejido, o “Thomas” destruyendo sus propios huesos sin saberlo? ¿Te estremeciste? Es muy probable que algunas de las áreas de tu cerebro que procesan aspectos afectivos del dolor estuvieran activas a pesar de que los nociceptores en tu piel y tejido profundo no estaban disparando. El dolor se puede experimentar indirectamente, al igual que el picor, el tacto placentero y otras sensaciones. Tania Singer y sus colegas encontraron en un estudio de fMRI que algunas de las mismas áreas cerebrales que estaban activas cuando los participantes sentían dolor en su propia piel (cingulado anterior e insula) también estaban activas cuando se les dio una señal de que un ser querido estaba sintiendo el dolor. Aquellos que fueron más “empáticos” también mostraron las mayores respuestas cerebrales (Singer et al., 2004). Se ha encontrado un efecto similar para un toque placentero: La insula posterior de los participantes que ven videos del brazo de otra persona siendo acariciado suavemente muestra la misma activación que si ellos mismos estuvieran recibiendo el toque (Morrison, Bjornsdotter, & Olausson, 2011).
Resumen
Las experiencias sensoriales nos conectan con las personas que nos rodean, con el resto del mundo y con nuestros propios cuerpos. Agradable o desagradable, son parte de ser humanos. En este módulo, hemos visto cómo poder inhibir las respuestas al dolor es fundamental para nuestra supervivencia y en casos como el del escalador Aron Ralston, esa habilidad puede permitirnos hacer cosas extremas. También hemos visto lo importante que es la capacidad de sentir dolor para nuestra salud, ilustrada por el joven “Thomas”, quien se sigue lastimando porque simplemente no nota el dolor. Si bien “Thomas” tiene que aprender a evitar actividades dañinas sin el aporte sensorial que normalmente nos guía, G. L. ha tenido que aprender a seguir acercándose y moverse en un mundo que apenas puede sentir en absoluto, con un cuerpo que prácticamente está desconectado de su conciencia. Muy poca sensación o demasiada de ella no lleva a nada bueno, por agradable o desagradable que se sienta generalmente la sensación. Mientras tengamos sistemas nerviosos que funcionen normalmente, somos capaces de ajustar el volumen de las señales sensoriales y nuestras reacciones conductuales de acuerdo al contexto en el que nos encontramos. Cuando se trata de señales sensoriales como el tacto y el dolor, somos intérpretes, no instrumentos de medición. La búsqueda de comprender cómo nuestros mecanismos de procesamiento sensorial pueden modularse, psicológica y fisiológicamente, promete ayudar a los investigadores y médicos a encontrar nuevas formas de aliviar la angustia del dolor crónico.
Recursos Externos
- Libro: Butler, D. S., Moseley, G. L., & Sunyata. (2003). Explicar el dolor (p. 19). Australia: Noigroup.
- Libro: Kringelbach, M. L., & Berridge, K. C. (Eds.). (2010). Placeres del cerebro (p. 343). Oxford, Reino Unido: Oxford University Press.
- Libro: Ralston, A. (2004). Entre una roca y un lugar duro: La base de la película 127 Horas. Nueva York, NY: Atria.
- Libro: Sacos, O. (1998). El hombre que confundió a su esposa con un sombrero: Y otros cuentos clínicos. Nueva York, NY: Simon & Schuster.
- Video: Serie documental de la BBC “Sentidos humanos”, Episodio 3: Tacto y visión
- watchdocumentary.org/watch/hu... f3e33c14a.html
- Video: Documental de la BBC “Placer y dolor con Michael Mosley”
- http://www.bbc.co.uk/programmes/b00y377q
- Video: TEDxAdelaide - Lorimer Moseley — “Por qué duelen las cosas”
- Video: Tráiler de la película 127 Horas, dirigida por Danny Boyle y estrenada en 2010
- Web: Página de inicio de la Asociación Internacional para el Estudio del Dolor
- http://www.iasp-pain.org
- Web: Actas del Coloquio de la Academia Nacional de Ciencias “La Neurobiología del Dolor”
- http://www.pnas.org/content/96/14.toc#COLLOQUIUM
- Web: Centro de Manejo del Dolor de la Escuela de Medicina de Stanford
- http://paincenter.stanford.edu/
- Recurso del sitio web con el objetivo de comunicar “avances y problemas en las ciencias clínicas en cuanto se relacionan con el papel del cerebro y la mente en los trastornos del dolor crónico”, dirigido por el Dr. Lorimer Moseley
- www.bodymind.org/
Preguntas de Discusión
- Tu amigo ha tenido un accidente y existe la posibilidad de que la lesión pueda causar dolor durante un periodo prolongado. ¿Cómo apoyarías a tu amigo? ¿Qué dirías y harías para aliviar el dolor y por qué crees que funcionaría?
- Hemos aprendido que el tacto y la sensación de dolor en muchos aspectos no reflejan “objetivamente” el mundo exterior o el estado corporal. Más bien, estas experiencias están moldeadas por diversas influencias de arriba hacia abajo, e incluso pueden ocurrir sin ninguna activación periférica. Esto es similar a la forma en que funcionan otros sistemas sensoriales, por ejemplo, los sistemas visuales o auditivos, y parece reflejar una forma general en que el cerebro procesa los eventos sensoriales. ¿Por qué crees que el cerebro interpreta la información sensorial entrante en lugar de dar una lectura uno a uno como lo harían un termómetro y otros instrumentos de medición? Imagina que en cambio tuviste “acceso directo e imparcial” entre estímulos y sensación. ¿Cuáles serían las ventajas y desventajas de esto?
- Los sentimientos de dolor o tacto son subjetivos, tienen una cualidad particular que percibes subjetivamente. ¿Cómo podemos saber si el dolor que sientes es similar al dolor que siento? ¿Es posible que los científicos modernos puedan medir objetivamente tales sentimientos subjetivos?
El vocabulario
- Fibras A
- Nervios sensoriales de rápida conducción con axones mielinizados. Las vainas de mielina de mayor diámetro y más gruesas aumentan la velocidad de conducción. Las fibras Aβ conducen señales táctiles de mecanorreceptores de bajo umbral con una velocidad de 80 m/s y un diámetro de 10 μm; las fibras Aδ-tienen un diámetro de 2.5 μm y conducen señales frías, nocivas y térmicas a 12 m/s. La tercera fibra A de conducción más rápida es la Aα, que conduce información propioceptiva con un velocidad de 120 m/s y un diámetro de 20 μm.
- Alodinia
- Dolor debido a un estímulo que normalmente no provoca dolor, por ejemplo, cuando un ligero toque acariciante se siente doloroso.
- Analgesia
- Alivio del dolor.
- Fibras C
- Fibras C: aferentes sensoriales delgados no mielinizados de conducción lenta con un diámetro de 1 μm y una velocidad de conducción de aproximadamente 1 m/s. Las fibras C-dolor transmiten señales nocivas, térmicas y de calor; las fibras táctiles C transmiten un tacto suave, caricias ligeras.
- Dolor crónico
- Dolor persistente o recurrente, más allá del curso habitual de enfermedad o lesión aguda; a veces presente sin daño tisular observable o causa clara.
- C-dolor o Aδ-fibras
- Las fibras C-pain transmiten señales nocivas, térmicas y térmicas
- Fibras C-táctiles
- Las fibras táctiles C transmiten un tacto suave, caricias ligeras
- Sentidos cutáneos
- Los sentidos de la piel: táctil, térmica, pruriginosa (picazón), dolorosa y agradable.
- Sistema modulador del dolor descendente
- Un sistema modulador del dolor de arriba hacia abajo capaz de inhibir o facilitar el dolor. La vía produce analgesia por la liberación de opioides endógenos. Varias estructuras cerebrales y núcleos forman parte de este circuito, como las áreas del lóbulo frontal de la corteza cingulada anterior, la corteza orbitofrontal y la corteza insular; y los núcleos de la amígdala y el hipotálamo, todos ellos proyectados a una estructura en el mesencéfalo llamada gris periacueductal (PAG). Luego, el PAG controla la transmisión ascendente del dolor desde el sistema de dolor aferente indirectamente a través de la médula rostral ventromedial (RVM) en el tronco encefálico, que utiliza células ON y OFF para inhibir o facilitar las señales nociceptivas en el asta dorsal espinal.
- Endorfina
- Un péptido endógeno similar a la morfina que se une a los receptores opioides en el cerebro y el cuerpo; sintetizado en el sistema nervioso del cuerpo.
- Exterocepción
- El sentido del mundo externo, de toda estimulación originada desde fuera de nuestros propios cuerpos.
- Interocepción
- El sentido del estado fisiológico del cuerpo. Hambre, sed, temperatura, dolor y otras sensaciones relevantes para la homeostasis. La entrada visceral como la frecuencia cardíaca, la presión arterial y la actividad digestiva dan lugar a una experiencia de los estados internos del cuerpo y reacciones fisiológicas a la estimulación externa. Esta experiencia ha sido descrita como una representación del “yo material”, y se plantea la hipótesis de que es la base de sentimientos subjetivos, emoción y autoconciencia.
- Nocicepción
- El proceso neural de codificación de estímulos nocivos, la entrada sensorial de los nociceptores. No necesariamente doloroso, y crucialmente no necesario para la experiencia del dolor.
- Nociceptores
- Receptores sensoriales de umbral alto del sistema nervioso somatosensorial periférico capaces de transducir y codificar estímulos nocivos. Los nociceptores envían información sobre el daño tisular real o inminente al cerebro. Estas señales a menudo pueden provocar dolor, pero la nocicepción y el dolor no son lo mismo.
- Estímulo nocivo
- Un estímulo que está dañando o amenazando con dañar los tejidos normales.
- Hipótesis del tacto ocial
- Propone que el toque social es un dominio distinto del tacto. Los aferentes táctiles C forman una vía especial que distingue el toque social de otros tipos de toque al disparar selectivamente en respuesta al toque de relevancia socioafectiva; enviando así información afectiva paralela a la información discriminatoria de las fibras Aβ. De esta manera, el toque socialmente relevante se destaca del resto por tener especial valor emocional positivo y se procesa aún más en áreas cerebrales relacionadas con el afecto como la insula.
- Dolor
- Definida como “una experiencia sensorial y emocional desagradable asociada con daño tisular real o potencial, o descrita en términos de dicho daño”, según la Asociación Internacional para el Estudio del Dolor.
- Dolor fantasma
- Dolor que parece originarse en una extremidad amputada.
- Efecto placebo
- Efectos de un tratamiento que no son causados por las propiedades físicas de un tratamiento sino por el significado que se le atribuye. Estos efectos reflejan la activación propia del cerebro de los sistemas moduladores, que se desencadena por la expectativa positiva o el deseo de un tratamiento exitoso. La analgesia placebo es el efecto placebo más estudiado y se ha demostrado que depende, en gran medida, de los mecanismos opioides. La analgesia placebo puede revertirse mediante el bloqueo farmacológico de los receptores opioides. La palabra “placebo” probablemente se deriva de la palabra latina “placebit” (“le agradará”).
- Sensibilización
- Aumento de la capacidad de respuesta de las neuronas nociceptivas a su entrada normal y/o reclutamiento de una respuesta a entradas normalmente subumbrales. Clínicamente, la sensibilización solo puede inferirse indirectamente de fenómenos como la hiperalgesia o la alodinia. La sensibilización puede ocurrir en el sistema nervioso central (sensibilización central) o en la periferia (sensibilización periférica).
- Hipótesis del tacto ocial
- Propone que el toque social es un dominio distinto del tacto. Los aferentes táctiles C forman una vía especial que distingue el toque social de otros tipos de toque al disparar selectivamente en respuesta al toque de relevancia socioafectiva; enviando así información afectiva paralela a la información discriminatoria de las fibras Aβ. De esta manera, el toque socialmente relevante se destaca del resto por tener especial valor emocional positivo y se procesa aún más en áreas cerebrales relacionadas con el afecto como la insula.
- Corteza somatosensorial
- Consiste en corteza sensorial primaria (S1) en la circunvolución postcentral en los lóbulos parietales y corteza somatosensorial secundaria (S2), la cual se define funcionalmente y se encuentra en el banco superior del surco lateral, llamado opérculo parietal. La corteza somatosensorial también incluye partes de la corteza insular.
- Organizado somatópicamente
- Cuando las partes del cuerpo que están representadas en una región cerebral particular se organizan topográficamente de acuerdo con su ubicación física en el cuerpo (ver ilustración de la Figura 8.5.2).
- Tracto espinotalámico
- Corre por la columna lateral de la médula espinal hasta el tálamo. Las fibras C ingresan al cuerno dorsal de la médula espinal y forman una sinapsis con una neurona que luego cruza hacia la columna lateral y se convierte en parte del tracto espinotalámico.
- Transducción
- Los mecanismos que convierten los estímulos en señales eléctricas que pueden ser transmitidas y procesadas por el sistema nervioso. La estimulación física o química crea potenciales de acción en una célula receptora en el sistema nervioso periférico, que luego se conduce a lo largo del axón hasta el sistema nervioso central.
Referencias
- Auvray, M., Myin, E., & Spence, C. (2010). Los aspectos sensitivo-discriminativos y afectivo-motivacionales del dolor. Revisiones de Neurociencia y Bioconductual, 34 (2), 214—223.
- Comité de Avance de la Investigación del Dolor, Cuidado e Instituto de Medicina. (2011). Aliviar el dolor en Estados Unidos: un plan para transformar la prevención, la atención, la educación y la investigación. Washington, D.C.: Prensa de la Academia Nacional.
- Craig, A. D. (2002). ¿Cómo te sientes? Interocepción: el sentido de la condición fisiológica del cuerpo. Nature Reseñas Neurociencia, 3 (8), 655—666.
- Dum, J., & Herz, A. (1984). Modulación endorfinérgica de sistemas de recompensa neural indicada por cambios de comportamiento. Farmacología Bioquímica y Comportamiento, 21 (2), 259—266.
- Dunbar, R. I. (2010). El papel social del tacto en humanos y primates: función conductual y mecanismos neurobiológicos. Revisiones de Neurociencia y Biocomportamiento, 34 (2), 260—268.
- Elippert, F., Bingel, U., Schoell, E. D., Yacubian, J., Klinger, R., Lorenz, J., & Buchel, C. (2009). La activación del sistema de control del dolor descendente opioidérgico subyace a la analgesia placebo. Neurona, 63 (4), 533—543.
- Eippert, F., Finserbusch, J., Bingel, U., & Buchel, C. (2009). Evidencia directa de afectación medular en analgesia placebo. Ciencia, 326 (5951), 404.
- Eisenberger, N. I., Maestro, S. L., Inagaki, T. K., Taylor, S. E., Shirinyan, D., Lieberman, M. D., & Naliboff, B. D. (2011). Las figuras de apego activan una región neural relacionada con la señal de seguridad y reducen la experiencia de dolor. Actas de la Academia Nacional de Ciencias de los Estados Unidos de América, 108 (28), 11721—11726.
- Feldman, R., Singer, M., & Zagoory, O. (2010). El tacto atenúa la reactividad fisiológica de los bebés al estrés. Ciencia del Desarrollo, 13 (2), 271—278.
- Campos, H. L. (2006). Un modelo de motivación-decisión del dolor: El papel de los opioides. En H. Flor, E. Kalso, & J. O. Dostrovsky (Eds.), Actas del 11º Congreso Mundial sobre el Dolor (pp. 449—459). Seattle, WA: IASP.
- Fields, H. L. (2004). Control del dolor opioide dependiente del estado. Nature Reseñas Neurociencia, 5 (7), 565—575.
- Fleming, A. S., O'Day, D. H., & Kraemer, G. W. (1999). Neurobiología de las interacciones madre-bebé: Experiencia y plasticidad del sistema nervioso central a través del desarrollo y las generaciones. Revisiones de Neurociencia y Bioconductual, 23 (5), 673—685.
- Gazzola, V., Spezio, M. L., Etzel, J. A., Castelli, F., Adolphs, R., & Keysers, C. (2012). La corteza somatosensorial primaria discrimina la significación afectiva en el contacto social. Actas de la Academia Nacional de Ciencias de los Estados Unidos de América, 109 (25), E1657—1666.
- Harlow, H. F., & Suomi, S. J. (1970). Naturaleza del amor: simplificada. Psicólogo Americano, 25 (2), 161—168.
- Keverne, E. B., Martensz, N. D., & Tuite, B. (1989). Las concentraciones de beta-endorfina en líquido cefalorraquídeo de monos están influenciadas por las relaciones de aseo. Psiconeuroendocrinología, 14 (1—2), 155—161.
- Leknes, S., & Tracey, I. (2008). Una neurobiología común para el dolor y el placer. Nature Reseñas Neurociencia, 9 (4), 314—320.
- Leknes, S., Berna, C., Lee, M. C., Snyder, G. D., Biele, G., & Tracey, I. (2013). La importancia del contexto: Cuando el alivio relativo hace que el dolor sea agradable. Dolor, 154 (3), 402—410.
- Levine, J. D., Gordon, N. C., & Fields, H. L. (1978). El mecanismo de la analgesia placebo. Lanceta, 2 (8091), 654—657.
- Liljencrantz, J., Björnsdotter, M., Morrison, I., Bergstrand, S., Ceko, M., Seminowicz, D. A.,. Olausson, H. (2013). Procesamiento C-táctil alterado en alodinia táctil dinámica humana. Dolor, 154 (2), 227—234.
- Löken, L. S., Wessberg, J., Morrison, I., McGlone, F., & Olausson, H. (2009). Codificación del tacto agradable por aferentes no mielinizados en humanos. Neurociencia de la naturaleza, 12 (5), 547—548.
- McGlone, F., & Reilly, D. (2010). El sistema sensorial cutáneo. Revisiones de neurociencia y biocomportamiento, 34 (2), 148—159.
- Minde, J., Toolanen, G., Andersson, T., Nennesmo, I., Remahl, I. N., Svensson, O., & Solders, G. (2004). Insensibilidad familiar al dolor (HSAN V) y mutación en el gen NGFB. Estudio neurofisiológico y patológico. Músculo y Nervio, 30 (6), 752—760.
- Morrison, I., Bjornsdotter, M., & Olausson, H. (2011). Las respuestas vicarias al contacto social en la corteza insular posterior se ajustan a agradables velocidades de caricias. Revista de Neurociencia, 31 (26), 9554—9562.
- Morrison, I., Löken, L. S., & Olausson, H. (2010). La piel como órgano social. Investigación Cerebral Experimental, 204 (3), 305—314.
- Olausson, H., Lamarre, Y., Backlund, H., Morin, C., Wallin, B. G., Starck, G.,. Bushnell, M. C. (2002). Los aferentes táctiles no mielinizados señalan el tacto y se proyectan a la corteza insular. Neurociencia de la naturaleza, 5 (9), 900—904.
- Olausson, H., Wessberg, J., Morrison, I., McGlone, F., & Vallbo, Å. (2010). Neurofisiología de aferentes táctiles no mielinizados. Revisiones de Neurociencia y Biocomportamiento, 34 (2), 185—191.
- Pechtel, P., & Pizzagalli, D. A. (2011). Efectos del estrés temprano en la función cognitiva y afectiva: Una revisión integrada de la literatura humana. Psicofarmacología, 214 (1), 55—70.
- Petrovic, P., Kalso, E., Petersson, K. M., & Ingvar, M. (2002). Placebo y analgesia opioide: imagen de una red neuronal compartida. Ciencia, 295 (5560), 1737—1740.
- Precio, D. D. (2000). Mecanismos psicológicos y neuronales de la dimensión afectiva del dolor. Ciencia, 288 (5472), 1769—1772.
- Rainville, P., Duncan, G. H., Price, D. D., Carrier, B., & Bushnell, M. C. (1997). Afecto de dolor codificado en el cingulado anterior humano pero no en la corteza somatosensorial. Ciencia, 277 (5328), 968—971.
- Rainville, P., Feine, J. S., Bushnell, M. C., & Duncan, G. H. (1992). Una comparación psicofísica de respuestas sensoriales y afectivas a cuatro modalidades de dolor experimental. Investigación somatosensorial y motora, 9 (4), 265—277.
- Ralston, A. (2010, 31 de diciembre). Las 127 horas de Aron Ralston: Esto va a convertir una historia infernal. Recuperado de The Telegraph: www.telegraph.co.uk/cultura/b... tory.-.-.. html
- Sacos, O. (1985). La dama incorpórea. En El hombre que confundió a su esposa con un sombrero y otros cuentos clínicos (pp. 43—54) Nueva York, NY: Simon & Schuster.
- Simons, D. J., & Land, P. W. (1987). La experiencia temprana de estimulación táctil influye en la organización de la corteza sensorial somática. Naturaleza, 326 (6114), 694—697.
- Cantante, T., Seymour, B., O'Doherty, J., Kaube, H., Dolan, R. J., & Frith, C. D. (2004). La empatía por el dolor involucra los componentes afectivos pero no sensoriales del dolor. Ciencia, 303 (5661), 1157—1162.
- Wiech, K., & Tracey, I. (2009). Influencia de las emociones negativas en el dolor: efectos conductuales y mecanismos neuronales. Neuroimagen, 47 (3), 987—994.
- Zambreanu, L., Wise, R. G., Brooks, J. C. W., Iannetti, G. D., & Tracey, I. (2005). Un papel del tronco encefálico en la sensibilización central en humanos. Evidencia de resonancia magnética funcional. Dolor, 114 (3), 397—407.