13.1: Introducción
- Page ID
- 128171
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
objetivos de aprendizaje
- Distinguir tres modos de transferencia de calor
Introducción a la transferencia de calor y calor
La energía puede existir en muchas formas y el calor es una de las más intrigantes. El calor a menudo se oculta, ya que solo existe cuando está en tránsito, y se transfiere por una serie de métodos claramente diferentes. La transferencia de calor toca todos los aspectos de nuestras vidas y nos ayuda a entender cómo funciona el universo. Explica el escalofrío que sentimos en una noche clara y ventosa, o por qué el núcleo de la Tierra aún no se ha refrescado. Este módulo define y explora la transferencia de calor, sus efectos y los métodos por los cuales se transfiere el calor. Estos temas son fundamentales, además de prácticos, y a menudo serán referidos en los módulos que se avecinan.
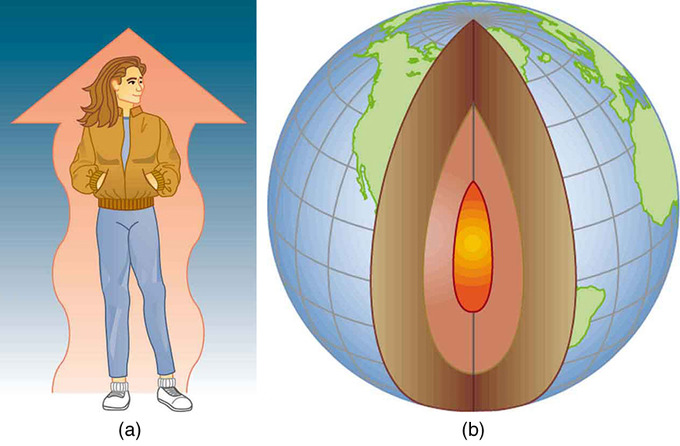
Ejemplos de Transferencia de Calor: (a) El efecto de enfriamiento de una noche clara y brisa es producido por el viento y por la transferencia de calor radiativo al espacio exterior frío. (b) Hubo una vez gran controversia sobre la edad de la Tierra, pero ahora se acepta generalmente que tiene alrededor de 4.5 mil millones de años. Gran parte del debate se centra en el interior fundido de la Tierra. Según nuestro entendimiento de la transferencia de calor, si la Tierra es realmente tan vieja, su centro debería haberse enfriado hace mucho tiempo. El descubrimiento de la radiactividad en las rocas reveló la fuente de energía que mantiene fundido el interior de la Tierra, a pesar de la transferencia de calor a la superficie, y de ahí al frío espacio exterior.
Definiciones
El físico escocés James Clerk Maxwell, en su clásico de 1871 Theory of Heat, fue uno de los muchos que comenzaron a construir sobre la idea ya establecida de que el calor era algo que ver con la materia en movimiento. Esta fue la misma idea planteada por Sir Benjamin Thompson en 1798, quien dijo que sólo seguía la obra de muchos otros. Uno de los libros recomendados por Maxwell fue Heat as a Mode of Motion de John Tyndall. Maxwell esbozó cuatro estipulaciones para la definición de calor:
- Es algo que puede ser transferido de un cuerpo a otro.
- Es una cantidad medible, y así tratada matemáticamente.
- No puede tratarse como una sustancia, porque puede transformarse en algo que no es una sustancia, como el trabajo mecánico.
- El calor es una de las formas de energía.
En los siguientes apartados, definiremos el calor de manera más rigurosa, prestando especial atención a cómo se puede medir y cuantificar.
Estimación de la cantidad de calor
La cantidad de calor transferido por algún proceso puede medirse directamente o determinarse indirectamente a través de cálculos basados en otras cantidades. La medición directa es por calorimetría y es la base empírica primaria de la idea de cantidad de calor transferido en un proceso. El calor transferido se mide por cambios en un cuerpo de propiedades conocidas, por ejemplo, aumento de temperatura, cambio de volumen o longitud, o cambio de fase, como el derretimiento del hielo. Las estimaciones indirectas de la cantidad de calor transferido se basan en la ley de conservación de energía y, en casos particulares, en la primera ley de termodinámica (explorada en los siguientes apartados). La estimación indirecta es el enfoque principal de muchos estudios teóricos de la cantidad de calor transferido.
Métodos de transferencia de calor
Después de definir y cuantificar la transferencia de calor y sus efectos en los sistemas físicos, discutiremos los métodos por los cuales se transfiere el calor. Tantos procesos implican transferencia de calor, por lo que es difícil imaginar una situación en la que no se produzca ninguna transferencia de calor. Sin embargo, cada proceso que implica transferencia de calor se lleva a cabo por solo tres métodos:
- La conducción es la transferencia de calor a través de la materia estacionaria por contacto físico. (La materia es estacionaria en una escala macroscópica; sabemos que hay movimiento térmico de los átomos y moléculas a cualquier temperatura por encima del cero absoluto). El calor transferido entre el quemador eléctrico de una estufa y el fondo de una sartén es transferida por conducción.
- La convección es la transferencia de calor por el movimiento macroscópico de un fluido. Este tipo de transferencia se realiza en un horno de aire forzado y en sistemas meteorológicos, por ejemplo.
- La transferencia de calor por radiación ocurre cuando se emiten o absorben microondas, radiación infrarroja, luz visible u otra forma de radiación electromagnética. Un ejemplo obvio es el calentamiento de la Tierra por el Sol. Un ejemplo menos obvio es la radiación térmica del cuerpo humano.
Calor como transferencia de energía
El calor es la transferencia espontánea de energía debido a una diferencia de temperatura.
objetivos de aprendizaje
- Identificar SI y unidades comunes de calor
Calor como transferencia de energía
Considera dos objetos a diferentes temperaturas que se juntan. La energía se transfiere del objeto más caliente al más frío, hasta que ambos objetos alcanzan el equilibrio térmico (es decir, ambos se convierten en la misma temperatura). ¿Cómo se transfiere esta energía? Ningún trabajo es realizado por ninguno de los dos objetos, porque ninguna fuerza actúa a través de la distancia. La transferencia de energía es causada por la diferencia de temperatura, y cesa una vez que las temperaturas son iguales. Esta observación lleva a la siguiente definición de calor: El calor es la transferencia espontánea de energía debido a una diferencia de temperatura.

Transferencia de Calor y Equilibrio: (a) El refresco y el hielo tienen diferentes temperaturas, T1 y T2, y no están en equilibrio térmico. (b) Cuando se permite que el refresco y el hielo interactúen, la energía se transfiere hasta que alcanzan la misma temperatura T, logrando el equilibrio. La transferencia de calor se produce debido a la diferencia de temperaturas. De hecho, dado que el refresco y el hielo están ambos en contacto con el aire circundante y el banco, la temperatura de equilibrio será la misma para ambos.
¿Dónde se pierde más calor? : Usa termómetros móviles para descubrir dónde una casa tiene un aislamiento deficiente.
Transferencia de calor: Una breve introducción a la transferencia de calor para estudiantes.
El calor a menudo se confunde con la temperatura. Por ejemplo, podemos decir que el calor era insoportable, cuando en realidad nos referimos a que la temperatura era alta. El calor es una forma de energía, mientras que la temperatura no lo es. El error surge porque somos sensibles al flujo de calor, más que a la temperatura.
Unidades
Debido a que el calor es una forma de energía, tiene la unidad SI de julio (J). La caloría (cal) es una unidad común de energía, definida como la energía necesaria para cambiar la temperatura de 1.00 g de agua en 1.00ºC —específicamente, entre 14.5ºC y 15.5ºC, ya que existe una ligera dependencia de la temperatura. Otra unidad común de calor es la kilocaloría (kcal), que es la energía necesaria para cambiar la temperatura de 1.00 kg de agua en 1.00ºC. Dado que la masa a menudo se especifica en kilogramos, la kilocaloría se usa comúnmente. Las calorías de los alimentos (dada la notación Cal, y a veces llamadas “grandes calorías”) son en realidad kilocalorías (1kilocalorie=1000 calorías), un hecho que no se determina fácilmente a partir del etiquetado de paquetes en Estados Unidos, pero más común en Europa y en otros lugares. En algunos campos de ingeniería, la Unidad Térmica Británica (BTU), equivalente a aproximadamente 1.055 kilo-julios, es ampliamente utilizada.

Figura 1 Equivalencia de Calor y Trabajo: Representación esquemática del experimento de Joule que estableció la equivalencia de calor y trabajo
La cantidad total de energía transferida como calor se escribe convencionalmente como Q para fines algebraicos. El calor liberado por un sistema en su entorno es por convención una cantidad negativa (Q < 0); cuando un sistema absorbe calor de su entorno, es positivo (Q > 0).
Equivalente mecánico de calor
También es posible cambiar la temperatura de una sustancia haciendo el trabajo. El trabajo puede transferir energía dentro o fuera de un sistema. Esta realización ayudó a establecer el hecho de que el calor es una forma de energía. James Prescott Joule (1818—1889) realizó muchos experimentos para establecer el equivalente mecánico del calor, el trabajo necesario para producir los mismos efectos que la transferencia de calor. En cuanto a las unidades utilizadas para estos dos términos, el mejor valor moderno para esta equivalencia es de 1.000 kcal = 4186 J. Consideramos esta ecuación como la conversión entre dos unidades diferentes de energía.
La Figura 1 muestra una de las configuraciones experimentales más famosas de Joule para demostrar el equivalente mecánico del calor. Demostró que el trabajo y el calor pueden producir los mismos efectos, y ayudó a establecer el principio de conservación de la energía. La energía potencial gravitacional (PE) (trabajo realizado por la fuerza gravitacional) se convierte en energía cinética (KE), y luego se aleatoriza por viscosidad y turbulencia en mayor energía cinética promedio de átomos y moléculas en el sistema, produciendo un aumento de temperatura. Sus contribuciones al campo de la termodinámica fueron tan significativas que la unidad de energía SI recibió su nombre.
El calor agregado o eliminado de un sistema cambia su energía interna (un concepto que discutiremos en la siguiente sección) y así su temperatura. Tal incremento de temperatura se observa mientras se cocina. Sin embargo, agregar calor no necesariamente aumenta la temperatura. Un ejemplo es el derretimiento del hielo; es decir, cuando una sustancia cambia de una fase a otra. El trabajo realizado en el sistema o por el sistema también puede cambiar la energía interna del sistema. Joule demostró que la temperatura de un sistema puede aumentarse agitando. Si se frota un cubito de hielo contra una superficie rugosa, el trabajo se realiza mediante la fuerza de fricción. Un sistema tiene una energía interna bien definida, pero no podemos decir que tenga cierto “contenido de calor” o “contenido de trabajo”. Utilizamos la frase “transferencia de calor” para enfatizar su naturaleza.
Energía Interna
La energía interna de un sistema es la suma de toda la energía cinética y potencial en un sistema.
objetivos de aprendizaje
- Expresar la energía interna en términos de energía cinética y potencial
Energía Interna
James Joule demostró que tanto el calor como el trabajo pueden producir el mismo cambio en la energía interna de una sustancia, estableciendo el principio de la equivalencia mecánica del calor. El calor es enfáticamente una cantidad que describe únicamente la energía que se transfiere. No tiene sentido hablar del 'calor' total que contiene un objeto o sistema. Sin embargo, un sistema contiene una cantidad cuantificable de energía llamada energía interna de un sistema. La energía interna de un sistema es la cantidad que cambia con la suma o resta de trabajo o calor. Está estrechamente relacionado con la temperatura.
Definición
La energía interna es la energía requerida para crear un sistema, excluyendo la energía necesaria para desplazar su entorno. La energía interna tiene dos componentes: energía cinética y energía potencial. La energía cinética consiste en toda la energía que involucra los movimientos de las partículas que constituyen el sistema, incluyendo traslación, vibración y rotación. La energía potencial está asociada con los constituyentes estáticos de la materia, la energía eléctrica estática de los átomos dentro de las moléculas o cristales, y la energía de los enlaces químicos. La ecuación que describe la energía interna total de un sistema es entonces:
\[\mathrm{U=U_{kinetic}+U_{potential}.}\]
También podemos pensar en la energía interna como la suma de todos los estados energéticos de cada componente del sistema:
\[\mathrm{U=∑_iE_i.}\]
A cualquier temperatura finita, las energías cinéticas y potenciales se convierten constantemente entre sí, pero la energía total permanece constante en un sistema aislado. La porción de energía cinética de la energía interna da lugar a la temperatura del sistema. Podemos usar la mecánica estadística para relacionar los movimientos (algo) aleatorios de las partículas en un sistema con la energía cinética media del conjunto de partículas, y así la cantidad empíricamente medible expresada como temperatura.
Podemos ver que la energía interna es una propiedad extensa: depende del tamaño del sistema o de la cantidad de sustancia que contiene.
En la mayoría de los casos, no nos preocupa la cantidad total de energía interna en el sistema, ya que rara vez es conveniente o necesario considerar todas las energías pertenecientes al sistema. Más bien, estamos mucho más interesados en el cambio en la energía interna, dada alguna transferencia de trabajo o calor. Esto se puede expresar como:
\[\mathrm{ΔU=Q+W_{mech}+W_{other}.}\]
Q es calor agregado a un sistema y W mech es el trabajo mecánico realizado por el entorno debido a cambios de presión o volumen en el sistema. Todas las demás perturbaciones y energías añadidas por otros procesos, como una corriente eléctrica introducida en un circuito electrónico, se resume como el término W extra.
Podemos calcular un pequeño cambio en la energía interna del sistema considerando la cantidad infinitesimal de calor ΔQ añadida al sistema menos la cantidad infinitesimal de trabajo δW realizada por el sistema:
\[\mathrm{dU=δQ−δW.}\]
Esta expresión es la primera ley de la termodinámica.

El Sol y la Energía Interna: La fusión nuclear en el sol convierte la energía potencial nuclear en energía interna disponible y mantiene la temperatura del Sol muy alta.
Puntos Clave
- El calor es un concepto crucial que toca todos los aspectos de nuestras vidas. James Clerk Maxwell estableció principios importantes que se combinan en la definición de calor.
- La cantidad de transferencia de calor puede medirse directamente o estimarse indirectamente a través de la ciencia de la calorimetría.
- Hay tres modos de transferencia de calor: conducción, convección y radiación.
- Si se juntan dos objetos a diferente temperatura, la energía se transferirá del objeto más caliente al más frío hasta que ambos estén a la misma temperatura. Esta transferencia de energía se conoce como calor.
- El calor no debe confundirse con la temperatura. La temperatura describe el estado interno de un objeto, mientras que el calor se refiere a la energía transferida hacia o desde el objeto.
- Dado que el calor es una forma de energía, su unidad SI es el joule. Otras unidades comunes de energía térmica incluyen la caloría y la kilocaloría, iguales a 4.186 y 4,186 julios, respectivamente.
- Debido a que el calor y el trabajo implican la transferencia de energía, cada uno puede producir los mismos efectos. El concepto del equivalente mecánico del calor fue instrumental para establecer el principio de conservación de la energía.
- Si bien un sistema no contiene 'calor', sí contiene una cantidad total de energía llamada energía interna.
- La energía interna es la energía necesaria para crear un sistema, menos la energía necesaria para desplazar su entorno.
- La mayoría de las veces, nos interesa el cambio en la energía interna más que en la energía interna total.
- La primera ley de la termodinámica,\(\mathrm{dU=ΔQ−ΔW}\), describe pequeños cambios en la energía interna.
Términos Clave
- transferencia de calor: La transmisión de energía térmica por conducción, convección o radiación.
- calorimetría: La ciencia de medir el calor absorbido o evolucionado durante el curso de una reacción química o cambio de estado.
- kilocaloría: Unidad de energía no SI igual a 1,000 calorías o 4,186 julios; igual a la “caloría” o “Calorías” utilizadas en el etiquetado nutricional. Símbolo: kcal.
- equilibrio térmico: Dos sistemas están en equilibrio térmico si pudieran transferir calor entre sí, pero no lo hacen.
- equivalente mecánico de calor: El trabajo necesario para producir los mismos efectos que la transferencia de calor.
- energía interna: La suma de toda la energía presente en el sistema, incluyendo la energía cinética y potencial; equivalentemente, la energía necesaria para crear un sistema, excluyendo la energía necesaria para desplazar su entorno.
- sistema aislado: Un sistema que no interactúa con su entorno, es decir, su energía total y masa permanecen constantes.
LICENCIAS Y ATRIBUCIONES
CONTENIDO CON LICENCIA CC, COMPARTIDO PREVIAMENTE
- Curación y Revisión. Proporcionado por: Boundless.com. Licencia: CC BY-SA: Atribución-CompartirIgual
CC CONTENIDO LICENCIADO, ATRIBUCIÓN ESPECÍFICA
- Colegio OpenStax, Colegio de Física. 17 de septiembre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42226/latest/?collection=col11406/1.7. Licencia: CC BY: Atribución
- Colegio OpenStax, Colegio de Física. 17 de septiembre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42226/latest/?collection=col11406/1.7. Licencia: CC BY: Atribución
- Colegio OpenStax, Colegio de Física. 17 de septiembre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42221/latest/?collection=col11406/1.7. Licencia: CC BY: Atribución
- Colegio OpenStax, Colegio de Física. 17 de septiembre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42223/latest/?collection=col11406/1.7. Licencia: CC BY: Atribución
- Calor. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Heat. Licencia: CC BY-SA: Atribución-CompartirIgual
- calorimetría. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/calorimetría. Licencia: CC BY-SA: Atribución-CompartirIgual
- transferencia de calor. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/heat_transfer. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, Colegio de Física. 15 de octubre de 2012. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42221/latest/?collection=col11406/1.7. Licencia: CC BY: Atribución
- Colegio OpenStax, Colegio de Física. 18 de septiembre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42223/latest/?collection=col11406/1.7. Licencia: CC BY: Atribución
- Calor. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Heat. Licencia: CC BY-SA: Atribución-CompartirIgual
- Sin límites. Proporcionado por: Boundless Learning. Ubicado en: www.boundless.com//physics/defining thermal-equilibrium—2. Licencia: CC BY-SA: Atribución-CompartirIgual
- Sin límites. Proporcionado por: Boundless Learning. Ubicado en: www.boundless.com//fisics/131/equivalente-mecánico-de-calor. Licencia: CC BY-SA: Atribución-CompartirIgual
- kilocaloría. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/kilocalorie. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, Colegio de Física. 15 de octubre de 2012. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42221/latest/?collection=col11406/1.7. Licencia: CC BY: Atribución
- Transferencia de Calor. Ubicado en: http://www.youtube.com/watch?v=pEBwctL490M. Licencia: Dominio Público: Sin Derechos de Autor Conocidos. Términos de licencia: Licencia estándar de YouTube
- Colegio OpenStax, Colegio de Física. 13 de octubre de 2012. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42223/latest/?collection=col11406/1.7. Licencia: CC BY: Atribución
- Colegio OpenStax, Colegio de Física. 13 de octubre de 2012. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42223/latest/?collection=col11406/1.7. Licencia: CC BY: Atribución
- Energía interna. Proporcionado por: Wikipedia. Ubicado en: http://en.Wikipedia.org/wiki/Internal_energy. Licencia: CC BY-SA: Atribución-CompartirIgual
- Sin límites. Proporcionado por: Boundless Learning. Ubicado en: www.boundless.com//fisics/definición/internal-energy. Licencia: CC BY-SA: Atribución-CompartirIgual
- sistema aislado. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/isolated_system. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, Colegio de Física. 15 de octubre de 2012. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42221/latest/?collection=col11406/1.7. Licencia: CC BY: Atribución
- Transferencia de Calor. Ubicado en: http://www.youtube.com/watch?v=pEBwctL490M. Licencia: Dominio Público: Sin Derechos de Autor Conocidos. Términos de licencia: Licencia estándar de YouTube
- Colegio OpenStax, Colegio de Física. 13 de octubre de 2012. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42223/latest/?collection=col11406/1.7. Licencia: CC BY: Atribución
- Colegio OpenStax, Colegio de Física. 13 de octubre de 2012. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m42223/latest/?collection=col11406/1.7. Licencia: CC BY: Atribución
- Calor. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Heat. Licencia: Dominio Público: No Conocido Derechos de Autor


