29.5: Átomos multielectrón
- Page ID
- 128203
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)objetivos de aprendizaje
- Describir la estructura atómica y el blindaje en átomos multielectrones
Átomos multielectrón
Los átomos con más de un electrón, como el helio (He) y el Nitrógeno (N), se denominan átomos multielectrón. El hidrógeno es el único átomo en la tabla periódica que tiene un electrón en los orbitales bajo estado fundamental.
En los átomos similares al hidrógeno (aquellos con un solo electrón), la fuerza neta sobre el electrón es tan grande como la atracción eléctrica del núcleo. Sin embargo, cuando más electrones están involucrados, cada electrón (en la nn-shell) siente no solo la atracción electromagnética del núcleo positivo, sino también las fuerzas de repulsión de otros electrones en conchas de '1' a 'nn'. Esto hace que la fuerza neta sobre los electrones en las capas externas de electrones sea significativamente menor en magnitud. Por lo tanto, estos electrones no están tan fuertemente unidos al núcleo como los electrones más cercanos al núcleo. Este fenómeno a menudo se conoce como el Efecto de Penetración Orbital. La teoría del blindaje también explica por qué los electrones de la capa de valencia se eliminan más fácilmente del átomo.

Efecto de blindaje de electrones: Un átomo multielectrónico con electrones internos que blindan los electrones externos del núcleo cargado positivamente
El tamaño del efecto de blindaje es difícil de calcular precisamente debido a los efectos de la mecánica cuántica. Como aproximación, la carga nuclear efectiva en cada electrón se puede estimar por:\(\mathrm{Z_{eff}=Z−σZ}_\text{eff} = \mathrm{Z} – \sigma \), donde\(\mathrm{Z}\) está el número de protones en el núcleo y σ\ sigma es el número promedio de electrones entre el núcleo y el electrón en cuestión. σ\ sigma se puede encontrar usando química cuántica y la Ecuación de Schrodinger o usando la fórmula empírica de Slater.
Por ejemplo, considere un catión de sodio, un anión de flúor y un átomo de neón neutro. Cada uno tiene 10 electrones, y el número de electrones de no valencia es dos (10 electrones totales menos ocho electrones de valencia), pero la carga nuclear efectiva varía porque cada uno tiene un número diferente de protones:
\[\mathrm { Z } _ { \mathrm { eff } } \mathrm { F } ^ { - } = 9 - 2 = 7 +\]
\[\mathrm { Z } _ { \mathrm { eff } } \mathrm { Ne } = 10 - 2 = 8 +\]
\[\mathrm { Z } _ { \mathrm { eff } } \mathrm { Na } ^ { + } = 11 - 2 = 9 +\]
Como consecuencia, el catión de sodio tiene la mayor carga nuclear efectiva y, por lo tanto, el radio atómico más pequeño.
La Tabla Periódica
Una tabla periódica es la disposición de los elementos químicos de acuerdo a sus configuraciones electrónicas y propiedades químicas recurrentes.
objetivos de aprendizaje
- Explique cómo se organizan los elementos en la Tabla Periódica.
Una tabla periódica es una presentación tabular de los elementos químicos, organizada sobre la base de sus números atómicos, configuraciones de electrones y propiedades químicas recurrentes. Los elementos se presentan según sus números atómicos (número de protones) en orden creciente. La forma estándar de la mesa comprende una cuadrícula de dieciocho por siete o cuerpo principal de elementos, colocados sobre una doble fila de elementos más pequeña. La tabla también se puede deconstruir en cuatro bloques rectangulares: el bloque s a la izquierda, el bloque p a la derecha, el bloque d en el medio y el bloque f debajo de eso. Las filas de la tabla se llaman periodos. Las columnas de los bloques s, d y p se denominan grupos, algunos de los cuales tienen nombres como los halógenos o los gases nobles.
Dado que, por definición, una tabla periódica incorpora tendencias recurrentes, cualquier tabla de este tipo puede ser utilizada para derivar relaciones entre las propiedades de los elementos y predecir las propiedades de nuevos elementos que aún están por descubrir o sintetizar. Como resultado, una tabla periódica, en forma estándar o alguna otra variante, proporciona un marco útil para analizar el comportamiento químico. Dichas tablas son ampliamente utilizadas en química y otras ciencias.

Tabla Periódica de Elementos: La forma estándar de la tabla periódica, donde los colores representan diferentes categorías de elementos
Los detalles de la Tabla Periódica
Todas las versiones de la tabla periódica incluyen solo elementos químicos, en lugar de mezclas, compuestos o partículas subatómicas. Cada elemento químico tiene un número atómico único que representa el número de protones en su núcleo. La mayoría de los elementos tienen diferentes números de neutrones entre diferentes átomos: estas variantes se conocen como isótopos. Por ejemplo, el carbono tiene tres isótopos naturales. Todos sus átomos tienen seis protones y la mayoría tienen seis neutrones también, pero alrededor del uno por ciento tiene siete neutrones, y una fracción muy pequeña tiene ocho neutrones. Los isótopos nunca se separan en la tabla periódica. Siempre se agrupan bajo un solo elemento. Los elementos sin isótopos estables tienen las masas atómicas de sus isótopos más estables listados entre paréntesis.
Todos los elementos desde los números atómicos '1' (hidrógeno) hasta '118' (ununoccio) han sido descubiertos o sintetizados. De estos, los elementos hasta el californio existen de forma natural; el resto sólo se han sintetizado en laboratorios. Se persigue la producción de elementos más allá del ununoccio. La cuestión de cómo puede ser necesario modificar la tabla periódica para dar cabida a tales adiciones es un tema de debate permanente. Numerosos radionúclidos sintéticos de elementos naturales también se han producido en laboratorios.
Si bien existen precursores, a Dmitri Mendeleev generalmente se le atribuye la publicación de la primera tabla periódica ampliamente reconocida en 1869. Desarrolló su tabla para ilustrar tendencias periódicas en las propiedades de los elementos conocidos en su momento. Mendeleev también predijo algunas propiedades de elementos entonces desconocidos que se esperaba llenaran vacíos en la tabla. La mayoría de sus predicciones resultaron correctas cuando posteriormente se descubrieron los elementos en cuestión. Desde entonces, la tabla periódica de Mendeleev se ha ampliado y perfeccionado con el descubrimiento o síntesis de más elementos nuevos y el desarrollo de nuevos modelos teóricos para explicar el comportamiento químico.

Tabla Periódica de Mendeleev de 1869: La tabla periódica de Mendeleev de 1869 presenta los periodos verticalmente y los grupos horizontalmente.

Dmitri Mendeleev: Dmitri Mendeleev es conocido por publicar una tabla periódica ampliamente reconocida.
Configuraciones de electrones
La configuración electrónica es la distribución de electrones de un átomo o molécula en orbitales atómicos o moleculares.
objetivos de aprendizaje
- Explicar el significado de las configuraciones de electrones
La configuración electrónica es la distribución de electrones de un átomo o molécula en orbitales atómicos o moleculares. Las configuraciones de electrones describen a los electrones como cada uno moviéndose independientemente en un orbital, en un campo promedio creado por todos los demás orbitales.
En los átomos, los electrones llenan orbitales atómicos de acuerdo con el principio de Aufbau (mostrado en), declarado como: un máximo de dos electrones se ponen en orbitales en el orden de aumentar la energía orbital, los orbitales de menor energía se llenan antes de que los electrones se coloquen en orbitales de mayor energía. A modo de ejemplo, la configuración electrónica del átomo de neón es 1s 2 2s 2 2p 6 o [He] 2s 2 2p 6, como se diagrama en. En las moléculas, la situación se vuelve más compleja, ya que cada molécula tiene una estructura orbital diferente. Los orbitales moleculares se marcan según su simetría, en lugar de los marcadores orbitales atómicos utilizados para átomos e iones monoatómicos: por lo tanto, la configuración electrónica de la molécula de oxígeno diatómico, O 2, es 1σ g 2 1σ u 2 2σ g 2 2σ u 2 1π u 4 3σ g 2 1π g 2.

Configuración de electrones del átomo de neón: Configuración electrónica del átomo de neón que muestra solo la capa externa de electrones.
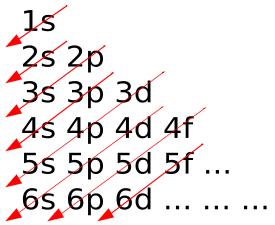
Principio de Aufbau: En el Principio Aufbau, a medida que los electrones se agregan a los átomos, primero se agregan a los orbitales más bajos.
De acuerdo con las leyes de la mecánica cuántica, para los sistemas con un solo electrón, se asocia una energía a cada configuración de electrones y, en ciertas condiciones, los electrones son capaces de moverse de una configuración a otra por emisión o absorción de un cuántico de energía, en forma de fotón.
Para átomos o moléculas con más de un electrón, el movimiento de los electrones se correlaciona y tal imagen ya no es exacta. Se necesita un número infinito de configuraciones electrónicas para describir exactamente cualquier sistema de múltiples electrones, y no se puede asociar energía con una sola configuración. Sin embargo, la función de onda electrónica suele estar dominada por un número muy pequeño de configuraciones y, por lo tanto, la noción de configuración electrónica sigue siendo esencial para los sistemas de múltiples electrones.
La configuración electrónica de las moléculas poliatómicas puede cambiar sin absorción o emisión de fotones a través de acoplamientos vibrónicos.
El conocimiento de la configuración electrónica de diferentes átomos es útil para comprender la estructura de la tabla periódica de elementos. La capa de electrones más externa a menudo se conoce como la capa de valencia y (a una primera aproximación) determina las propiedades químicas. Cabe recordar que las similitudes en las propiedades químicas se remarcaron más de un siglo antes de la idea de configuración electrónica. El concepto de configuración electrónica también es útil para describir los enlaces químicos que mantienen unidos a los átomos. En materiales a granel esta misma idea ayuda a explicar las peculiares propiedades de los láseres y semiconductores.
Puntos Clave
- El hidrógeno es el único átomo en la tabla periódica que tiene un electrón en los orbitales bajo estado fundamental.
- En los átomos multielectrones, la fuerza neta sobre los electrones en las cubiertas externas se reduce debido al blindaje.
- La carga nuclear efectiva en cada electrón puede aproximarse como: Zeff=Z−σZeff=Z−σ, donde ZZ es el número de protones en el núcleo y σσ es el número promedio de electrones entre el núcleo y el electrón en cuestión.
- Una tabla periódica proporciona un marco útil para analizar el comportamiento químico de los elementos.
- Una tabla periódica incluye solo elementos químicos con cada elemento químico asignado un número atómico único que representa el número de protones en su núcleo.
- A Dmitri Mendeleev se le atribuye la publicación de la primera tabla periódica ampliamente reconocida en 1869.
- Los electrones llenan orbitales atómicos según el principio Aufbau en átomos.
- Para los sistemas con un solo electrón, se asocia una energía a cada configuración de electrones y los electrones son capaces de moverse de una configuración a otra por emisión o absorción de un cuántico de energía, en forma de fotón.
- Para átomos o moléculas con más de un electrón, se necesita un número infinito de configuraciones electrónicas para describir exactamente cualquier sistema multielectrónico, y no se puede asociar energía con una sola configuración.
Términos Clave
- similar al hidrógeno: que tiene un solo electrón
- cáscara de electrones: Los estados colectivos de todos los electrones en un átomo que tiene el mismo número cuántico principal (visualizado como una órbita en la que se mueven los electrones).
- caparazón de valencia: la capa más externa de electrones en un átomo; estos electrones participan en la unión con otros átomos
- tabla periódica: Una tabla tabular de los elementos químicos según sus números atómicos para que los elementos con propiedades similares estén en la misma columna.
- Elemento: Cualquiera de las sustancias químicas más simples que no pueda descomponerse en una reacción química o por cualquier medio químico y compuesta por átomos que tengan todos el mismo número de protones.
- número atómico: El número, igual al número de protones en un átomo que determina sus propiedades químicas. Símbolo: Z
- orbital atómico: El comportamiento mecánico cuántico de un electrón en un átomo que describe la probabilidad de la posición y energía particulares del electrón.
LICENCIAS Y ATRIBUCIONES
CONTENIDO CON LICENCIA CC, COMPARTIDO PREVIAMENTE
- Curación y Revisión. Proporcionado por: Boundless.com. Licencia: CC BY-SA: Atribución-CompartirIgual
CC CONTENIDO LICENCIADO, ATRIBUCIÓN ESPECÍFICA
- cáscara de electrones. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/electron_shell. Licencia: CC BY-SA: Atribución-CompartirIgual
- Carga nuclear efectiva. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Effective_Nuclear_Charge. Licencia: CC BY-SA: Atribución-CompartirIgual
- Blindaje de electrones. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Blindaje electrónico. Licencia: CC BY-SA: Atribución-CompartirIgual
- similar al hidrógeno. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/hydrogen-like. Licencia: CC BY-SA: Atribución-CompartirIgual
- concha de valencia. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/valence_shell. Licencia: CC BY-SA: Atribución-CompartirIgual
- Proporcionado por: Wikimedia. Ubicado en: http://upload.wikimedia.org/Wikipedia/commons/thumb/b/b3/Effective_Nuclear_Charge.svg/350px-Effective_Nuclear_Charge.svg.png. Licencia: CC BY-SA: Atribución-CompartirIgual
- número atómico. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/atomic_number. Licencia: CC BY-SA: Atribución-CompartirIgual
- Tabla periódica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Tabla Periódica. Licencia: CC BY-SA: Atribución-CompartirIgual
- elemento. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/element. Licencia: CC BY-SA: Atribución-CompartirIgual
- tabla periódica. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/periodi_table. Licencia: CC BY-SA: Atribución-CompartirIgual
- Proporcionado por: Wikimedia. Ubicado en: http://upload.wikimedia.org/Wikipedia/commons/thumb/b/b3/Effective_Nuclear_Charge.svg/350px-Effective_Nuclear_Charge.svg.png. Licencia: CC BY-SA: Atribución-CompartirIgual
- Proporcionado por: Wikimedia. Ubicado en: http://upload.wikimedia.org/Wikipedia/commons/thumb/8/84/Periodic_table.svg/790px-Periodic_table.svg.png. Licencia: CC BY-SA: Atribución-CompartirIgual
- Proporcionado por: Wikimedia. Ubicado en: http://upload.wikimedia.org/Wikipedia/commons/thumb/b/b3/Medeleeff_by_repin.jpg/482px-Medeleeff_by_repin.jpg. Licencia: CC BY-SA: Atribución-CompartirIgual
- Proporcionado por: Wikimedia. Ubicado en: http://upload.wikimedia.org/Wikipedia/commons/thumb/b/bb/Mendeleev's_1869_periodic_table.png/487px-Mendeleev's_1869_periodic_table.png. Licencia: CC BY-SA: Atribución-CompartirIgual
- Configuración electrónica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Electronic_Configuration. Licencia: CC BY-SA: Atribución-CompartirIgual
- Configuración electrónica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Electron_Configuration. Licencia: CC BY-SA: Atribución-CompartirIgual
- cáscara de electrones. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/electron_shell. Licencia: CC BY-SA: Atribución-CompartirIgual
- orbital atómico. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/atomic_orbital. Licencia: CC BY-SA: Atribución-CompartirIgual
- Proporcionado por: Wikimedia. Ubicado en: http://upload.wikimedia.org/Wikipedia/commons/thumb/b/b3/Effective_Nuclear_Charge.svg/350px-Effective_Nuclear_Charge.svg.png. Licencia: CC BY-SA: Atribución-CompartirIgual
- Proporcionado por: Wikimedia. Ubicado en: http://upload.wikimedia.org/Wikipedia/commons/thumb/8/84/Periodic_table.svg/790px-Periodic_table.svg.png. Licencia: CC BY-SA: Atribución-CompartirIgual
- Proporcionado por: Wikimedia. Ubicado en: http://upload.wikimedia.org/Wikipedia/commons/thumb/b/b3/Medeleeff_by_repin.jpg/482px-Medeleeff_by_repin.jpg. Licencia: CC BY-SA: Atribución-CompartirIgual
- Proporcionado por: Wikimedia. Ubicado en: http://upload.wikimedia.org/Wikipedia/commons/thumb/b/bb/Mendeleev's_1869_periodic_table.png/487px-Mendeleev's_1869_periodic_table.png. Licencia: CC BY-SA: Atribución-CompartirIgual
- Principio de Aufbau. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Aufbau_principle. Licencia: CC BY: Atribución
- Proporcionado por: Wikimedia. Ubicado en: Upload.wikimedia.org/wikipedia/commons/thumb/3/3e/electron_shell_010_neon_-_no_label.svg/600px-electron_shell_010_neon_-_no_label.svg.png. Licencia: CC BY-SA: Atribución-CompartirIgual

