6.2: Gases reales
- Page ID
- 127552
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
¿Qué tan bien se ajustan los gases reales a la ecuación de estado para un gas ideal? La respuesta está bastante bien sobre un amplio rango de P, V y T, siempre que la temperatura esté muy por encima de la temperatura crítica. Habrá que ver en breve qué se entiende por la temperatura crítica; por el momento diremos que se sigue bastante bien la ecuación del gas ideal siempre que la temperatura esté muy por encima de la temperatura a la que se pueda licuar simplemente comprimiéndola. El aire a temperatura ambiente obedece bastante bien a la ley. Los gases en atmósferas estelares también obedecen bien a la ley, porque ahí no hay peligro de que el gas se licue. (En los núcleos de las estrellas, sin embargo, donde las densidades son muy grandes, los gases obedecen a una ecuación de estado muy diferente).
Una medida de lo bien que la ley es obedecida por los gases reales es medir P, V y T, y ver qué tan cerca\( \frac{PV}{RT}\) está de 1. La cantidad\( \frac{RT}{PV}\) se conoce como el factor de compresión, y a menudo se le da el símbolo Z. Para la mayoría de los gases reales a presiones muy altas (unos pocos cientos de atmósferas), se encuentra de hecho que Z es bastante mayor que 1. A medida que se baja la presión, Z se vuelve más baja, y luego, ay, se rebasa y se encuentra que es un poco menor que 1. Entonces a presiones aún más bajas Z vuelve a subir. La forma exacta de la curva Z: P es diferente de gas a gas, al igual que la presión a la que Z es mínima. Sin embargo, para todos los gases, a medida que la presión se acerca a cero, PV/T se acerca a R exactamente. Por esta razón R se llama a veces la Constante Universal de Gas así como la Constante de Gas Ideal. En el límite de presiones muy bajas, todos los gases se comportan muy estrechamente con el comportamiento de un gas ideal. En la Sección 6.3 estaremos examinando más de cerca cómo varía el factor de compresión con la presión.
Otra forma de ver qué tan estrechamente los gases reales obedecen a la ecuación de gas ideal es graficar P versus V para varias temperaturas diferentes. Es decir, dibujamos un conjunto de isotermas. Para un gas ideal, estas isotermas, PV = constante, son hipérbolas rectangulares. Entonces son para gases reales a altas temperaturas. A temperaturas más bajas, se marcan las salidas de la ecuación de gas ideal. Las isotermas típicas se esbozan en la figura VI.1. Ay, mis habilidades limitadas con esta computadora infernal frente a mí me permiten sólo esbozar estas isotermas crudamente a mano.
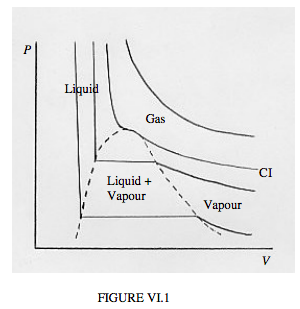
En el plano PV de la figura VI.1, verá varias áreas marcadas como “gas”, “líquido”, “vapor”, “líquido + vapor”. Puedes seguir el comportamiento a una temperatura determinada comenzando en el extremo derecho de cada isoterma, y moviéndote gradualmente hacia la izquierda, es decir, aumentar la presión y disminuir el volumen. La isoterma más caliente es casi hiperboloidal. Nada especial sucede más allá de que el volumen decrezca a medida que aumenta la presión, según la ley de Boyle. A temperaturas ligeramente más bajas, se desarrolla una torcedura en la isoterma, y a la temperatura crítica la torcedura desarrolla un punto de inflexión horizontal local. La isoterma para la temperatura crítica es la isoterma crítica, marcada CI en el boceto. Todavía no pasa nada especial aparte de V decreciente a medida que se incrementa P, aunque ahora no de acuerdo con la ley de Boyle.
Para temperaturas por debajo de la temperatura crítica, nos referimos al gas como vapor. A medida que disminuye el volumen, la presión aumenta gradualmente hasta llegar a la curva discontinua. En este punto, parte del vapor se licua, y, a medida que continúas disminuyendo el volumen, cada vez más del vapor se licua, permaneciendo constante la presión mientras lo hace. Esa es la porción horizontal de la isoterma. En esa región (es decir, delineada por la curva discontinua) tenemos líquido y vapor en equilibrio. Cerca del extremo derecho de la porción horizontal, solo hay una pequeña cantidad de líquido; en el extremo izquierdo, la mayor parte de la sustancia es líquida, con solo una pequeña cantidad de vapor restante.
Después de que todo es líquido, un mayor aumento de presión apenas disminuye el volumen, porque el líquido apenas es compresible en absoluto. La isoterma es entonces casi vertical.
La temperatura de la isoterma crítica es la temperatura crítica. La presión y el volumen molar en el punto de inflexión horizontal de la isoterma crítica son la presión crítica y el volumen molar crítico. El punto de inflexión horizontal es el punto crítico.


