6.4: Gas, Vapor, Líquido y Sólido
- Page ID
- 127562
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Nuestra descripción del comportamiento de una sustancia real en la sección 6.2 fue incompleta en muchos sentidos, sobre todo porque no hacía mención alguna del estado sólido. A temperaturas muy bajas o a presiones muy altas, la mayoría de las sustancias se solidificarán
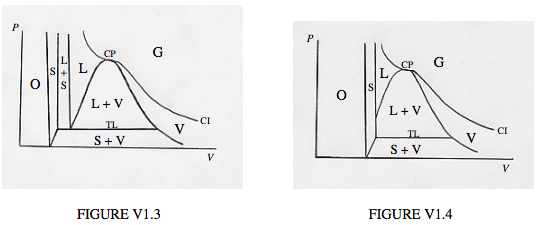
En las figuras VI.3 y 4 he esbozado esquemáticamente, a mano, las diversas regiones del plano PV en las que existe una sustancia en sus diversas etapas. A diferencia de las figuras VI.1 y VI.2, no he dibujado isotermas. Las diversas líneas están destinadas a representar los límites entre fases, y por lo tanto son más similares a las curvas discontinuas de las figuras VI.1 y VI.2. La única excepción es la isoterma crítica, CI, que en efecto es la curva que separa gas de vapor o líquido, pero que también es, por supuesto, una isoterma. La diferencia entre las figuras VI.3 y VI.4 es que la figura VI.3 representa una sustancia que se expande cuando se funde de sólida a líquida, mientras que la figura VI.4 representa una sustancia que se contrae cuando se funde de sólido a líquido (es decir, el sólido es menos denso que el líquido, y flotará sobre él). La mayoría de las sustancias se expanden al fundirse, pero tenemos que incluir aquellas sustancias excepcionales que se contraen al fundirse, porque una de esas sustancias es una de las más importantes de todas: el agua.
Puedes intentar entender un poco las figuras moviéndote a lo largo de una línea horizontal (isobar) o a lo largo de una línea vertical (isófora) y notando dónde ocurren los cambios de fase. ¿Ves, por ejemplo, dónde un sólido cambiará a vapor sin pasar por una fase líquida (sublimación)?
Observará, en las cifras, la isoterma crítica CI, que separa gas de líquido o vapor, y notará que, a temperaturas superiores a la temperatura crítica, la única fase posible es el gas, y la sustancia no puede licuarse meramente por compresión. Se anotará también el punto crítico CP. También verás la triple línea TL, a lo largo de la cual coexisten juntos sólido, líquido y vapor. ¿Qué hay de la región marcada con O? La sustancia no puede existir aquí en fase sólida, líquida o gaseosa. En esa medida, vemos que la ecuación de van der Waals puede ser un poco mejor de lo que pensábamos que era, porque recordarás que subió al infinito a un tercio del volumen crítico. Todo lo que esto significa es que para entonces las moléculas están tan apretadas juntas que simplemente no se pueden comprimir más. Si bien una sustancia no puede existir en una fase sólida, líquida o gaseosa ordinaria en la región marcada con O, si la materia está degenerada será en esta región. La estructura electrónica de los átomos se descompone, por lo que entonces sí se hizo posible atascar los átomos más cerca entre sí. Esto puede significar algo para aquellos de ustedes que están familiarizados con el concepto de materia degenerada. Si no has oído hablar de él, no te preocupes; es poco probable que te encuentres con él a menos que visites una estrella enana blanca, o el núcleo de una estrella masiva, o tengas que hacerte un examen en astrofísica. Por el momento, vamos a mirar para otro lado y pretender que no existe.
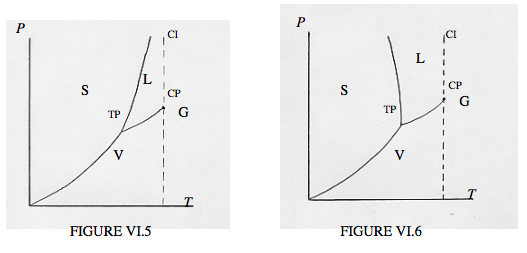
Podemos obtener un poco más de visión mirando el plano PT. La figura VI.5 muestra una sustancia que se expande al fundirse, y la figura VI.6 muestra una sustancia (como el agua) que se expande al congelarse. En el plano PT, el punto triple (donde sólido, líquido y vapor) están en equilibrio entre sí, aparece como el punto triple, TP. (En PVT -espacio es una línea, aunque el punto crítico CP sigue siendo un punto genuino en PVT -espacio.) La línea que separa el líquido del vapor termina en el punto crítico, y la línea a menudo se dibuja como si de alguna manera se dejara colgando en el aire, por lo que no se sabe si un punto dado cerca del punto crítico representa un gas, un vapor o un líquido. Pero en el plano PT, la isoterma crítica es una línea vertical (se muestra como discontinua en las figuras), y el límite líquido/vapor termina en la isoterma crítica, y no hay duda de qué fase está representada por un punto cercano al punto crítico. A la derecha de la isoterma crítica, tenemos un gas. A la izquierda, tenemos ya sea un líquido o un vapor, dependiendo de si estamos por encima o por debajo del límite líquido/vapor. Al cruzar el límite sólido/vapor, por debajo de la temperatura crítica y por debajo de la presión crítica (¡en Marte!) tenemos un cambio de fase directamente de sólido a vapor o vapor a sólido, es decir, sublimación.
(A menudo he escuchado que, por debajo del triple punto, una voluntad sólida “sublime”. Creo que prefiero el verbo “sublimar”.)
Realmente para apreciar estos diagramas hay que ver y manejar un modelo tridimensional en 3- espacio. Mis habilidades para hacer dibujos con mi computadora aún no son lo suficientemente buenas para intentar un dibujo tridimensional, pero el señor Charles Card de la Universidad de Victoria tuvo la amabilidad de fotografiarme una maqueta de la colección de la Universidad, y las reproduzco a continuación como las figuras VI 7,8 y 9.



Ahora doy algunos valores numéricos para la temperatura y presión críticas, el factor de compresión, y la temperatura y presión del punto triple para H 2 O y para CO 2. Estos no se pretenden como valores definitivos. Los busqué en varias fuentes y encontré una gama sorprendentemente amplia de los números citados. Aquí se dan simplemente para darle al lector una idea aproximada de cuáles son los valores para estas dos sustancias. La temperatura cotizada para el punto triple de H 2 O es, por supuesto, exacta, siendo uno de los puntos fijos de la escala Kelvin. Recordemos que una presión atmosférica es de aproximadamente 1.01 × 10 5 Pa.
Al lector le gustaría ver si estos números son compatibles con los números que di para las constantes de van der Waals en la Sección 6.3. No es de esperar un acuerdo exacto, porque las cifras que cito son sólo aproximadas y se obtienen de diversas fuentes y también, por supuesto, tampoco se puede esperar que ni el gas obedezca exactamente a la ecuación de van der Waals. Si los números parecen ser tremendamente discrepantes, por favor hágamelo saber.
Nosotros que vivimos en la superficie de la Tierra estamos familiarizados con el agua en sus formas sólidas, líquidas y de vapor, y esto podría sugerir que las condiciones en la superficie de la Tierra, la temperatura y la presión, deben estar cerca del punto triple del agua. Vemos de la tabla anterior que el punto triple del agua (que se define como 273.16 K = 0.01 ºC en la Escala Internacional de Temperatura), de hecho está cerca de nuestras temperaturas ambiente típicas, pero la presión de triple punto del agua es de 611.73 Pa, que es solo de aproximadamente 0.006 atm. Sin embargo, estamos cerca del punto triple si la presión parcial del vapor de agua en la atmósfera es cercana a 0.006 atm, lo que suele ser. Por lo que efectivamente estamos cerca del triple punto, razón por la cual tantas veces vemos el agua en sus tres fases. Por cierto, el diagrama P: T para el sistema de agua es mucho más complicado que el diagrama ideal de la figura VI.6, particularmente en la región “sólida”, ya que aparentemente hay muchas (alrededor de 15) formas diferentes, o fases, de hielo de agua.
Algunos pensamientos ociosos sobre los vapores. Se plantea la cuestión de cómo deletrear “vapor”. En Estados Unidos, el “vapor” es habitual, y en el Reino Unido el “vapor” lo es habitual. “Vaporizar” es un poco más complicado. La ortografía “vaporizar” es habitual en Estados Unidos, pero ¿qué hacer en el Reino Unido? ¿Se vaporiza, vaporiza, vaporiza o vaporiza? ¿Hay u o no u? ¿Es z o s? Para responder a la primera pregunta: En el Reino Unido, se omite la u, como en Estados Unidos. Solo los deletreadores débiles y aquellos que tratarían de ser “más ingleses que los ingleses” intentarían insertar una u En cuanto a s o z, o bien parece ser utilizado en el Reino Unido. Etimológicamente, z sería la mejor opción, por lo que la ortografía “vaporizar” es perfectamente aceptable a ambos lados del Océano Atlántico.
Pensamientos más ociosos sobre los vapores. ¿Un “vapor” es un “gas”? ¿Qué es un “fluido”? ¿Y el vidrio es un líquido? Algunos autores tratan al “gas” y al “vapor” como si fueran cosas bastante diferentes: un gas no es un vapor, y un vapor no es un gas. Otros consideran que un “vapor” es una especie de gas, es decir, un gas cuya temperatura está por debajo de la temperatura crítica y que puede licuarse aumentando la presión. En ese caso, ¿cómo se llama un gas que está por encima de la temperatura crítica? A menudo se usa el término gas permanente. Así, un vapor es un gas por debajo de su temperatura crítica, y un gas permanente es un gas por encima de su temperatura crítica.
Un fluido es algo que fluye. Así, los líquidos y gases (incluidos los vapores) son fluidos. Hay, se imaginarían, siempre una clara distinción entre un líquido y un gas. Pero, ¿la distinción siempre es tan clara? Admito que nunca he visto realmente el fenómeno que estoy a punto de describir, pero se describe tan a menudo que supongo que alguien lo ha visto! Considera un recipiente cerrado con un líquido en equilibrio con su vapor. El líquido y el vapor están separados por un límite horizontal agudo. Es decir, el sistema está en la línea separando líquido y vapor en las figuras VI.5 y 6. Esta línea se puede considerar, si lo desea, como un gráfico del punto de ebullición versus la temperatura, o igualmente de la presión de vapor frente a la temperatura. Si elevas la presión, el punto de ebullición aumenta; o si aumentas la temperatura, la presión de vapor aumenta. Más líquido entrará en estado de vapor, y, a medida que aumenta la presión del vapor, también lo hace su densidad. El líquido, por otro lado, es casi incompresible, y, debido a la expansión térmica, su densidad disminuye. A medida que avanzamos por la línea que separa el vapor de forma líquida en el plano P:T, la densidad del vapor aumenta y la densidad del líquido disminuye. Sus densidades se vuelven cada vez más iguales hasta que, a medida que nos acercamos al punto crítico, el límite entre líquido y vapor se vuelve cada vez menos distinto, y menos limitado por la gravedad a ser horizontal, hasta que finalmente, en el punto crítico, la distinción entre líquido y vapor se difumina y finalmente desaparece. Entonces, ¿qué tienes entonces? Sin duda es un fluido, pero ¿lo vas a llamar gas, vapor o líquido? Dado que ninguna de estas palabras parecería tener una afirmación más fuerte que ninguna de las otras, algunos autores se refieren a la sustancia cuando un poco por encima y a la derecha del punto crítico en el plano P:T como un fluido supercrítico.
También está la cuestión de si el vidrio es sólido o líquido. Una famosa personalidad de la radio hace muchos años, en un programa de “Brains Trust” transmitido por la British Broadcasting Corporation, el profesor C. E. M. Joad, era famoso por su frase: “Todo depende de lo que quieras decir con...” Así que supongo que la pregunta de si el vidrio es un líquido o un sólido depende de lo que quieras decir con un líquido o sólido. El momento en que se me cae un vaso y se rompe en muchos fragmentos brutalmente afilados no es un buen momento para convencerme de que el vidrio es un líquido. Quienes afirman que el vidrio es un líquido dicen que no tiene una estructura cristalina sólida, y que fluye, aunque muy lentamente. Tiene una viscosidad muy grande. Se nos dice que las ventanas de las antiguas catedrales de la Edad Media son más gruesas en la parte inferior que en la parte superior, como resultado del flujo de líquido viscoso a lo largo de los siglos. No sé si alguna de las muchas personas que me han dicho que realmente han medido personalmente el grosor de una ventana de catedral.
En cualquier caso, antes de comenzar este capítulo, tenía una idea muy clara en su mente sobre las diferencias entre un sólido, un líquido y un gas. Ahora que lo he explicado minuciosamente todo, estás completamente confundido, y ya no estás del todo seguro de que conoces la diferencia.


