8.4: Expansión Adiabática Reversible de un Gas Ideal
- Page ID
- 127592
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Un proceso adiabático es aquel en el que no entra ni sale calor del sistema, y por lo tanto, para un proceso adiabático reversible la primera ley toma la forma dU = − PdV. Pero a partir de la ecuación 8.1.1, C V = (U/T) V. Pero la energía interna de un gas ideal depende sólo de la temperatura y es independiente del volumen (porque no hay fuerzas intermoleculares), y así, para un gas ideal, C V = dU/dt, y así tenemos dU = C V dT. Así, para un proceso adiabático reversible y un gas ideal, C V dT = −PdV. (El signo menos muestra que a medida que aumenta V, T disminuye, como se esperaba). Pero para un mol de un gas ideal, PV = RT = (C P − C V) T, o P = (C P − C V) T/V.
Por lo tanto
\[ C_{v} d T=-\left(C_{P}-C_{V}\right) T d V / V\]
(Quizás se esté preguntando si C y V son cantidades molares, específicas o totales. Si miras la ecuación estarás de acuerdo en que es válida si las capacidades de volumen y calor son molares, específicas o totales.)
Separe las variables y escriba γ para C P/C V:
\[ \frac{d T}{T}+(\gamma-1) \frac{d V}{V}=0.\]
Integrar:
\[ T V^{\gamma-1}=\text { constant }.\]
Esto muestra cómo la temperatura y el volumen de un gas ideal varían durante una expansión o compresión adiabática reversible. Si el gas se expande, la temperatura baja. Si el gas se comprime, se calienta. Por supuesto la presión también varía, y el gas ideal se ajusta a la ecuación PV/T = constante. Sobre la eliminación de T obtenemos
\[ P V^{\gamma}=\text { constant }.\]
Sobre la eliminación de V obtenemos
\[ P^{-(\gamma-1)} T^{\gamma}=\text { constant. }\]
En la figura VIII.1 dibujo, como curvas de luz, cinco isotermas —es decir, las trayectorias que serían tomadas por un gas ideal en el plano PV en procesos isotérmicos a cinco temperaturas. También muestro, como línea más pesada, un adiabat, PV γ = constante, que calculé para γ = 5/3. El adiabat es más empinada que las isotermas, y la curva muestra que, a medida que el gas se expande adiabáticamente, la temperatura baja. Si conoces la temperatura original y los volúmenes antiguos y nuevos, la ecuación 8.4.3 te permitirá calcular la nueva temperatura. Si conoces la temperatura original y las presiones antiguas y nuevas, la ecuación 8.4.5 te permitirá calcular la nueva temperatura. Si bien estos argumentos puramente termodinámicos muestran que un gas se calienta más si lo comprime, esto también es de esperar a nivel microscópico. Así, si una molécula rebota elásticamente contra un pistón que se mueve hacia ella, ganará energía cinética, y perderá energía cinética si rebota en un pistón que se aleja de él.

Calculemos el trabajo realizado por un mol de un gas ideal en una expansión adiabática reversible de (P 1, V 1) a (P 2, V 2):
\[ W=\int_{V_{1}}^{V_{2}} P d V.\]
Para una expansión adiabática reversible, PV γ = K, y por lo tanto
\[ W=K \int_{v_{1}}^{v_{2}} V^{-\gamma} d V=\frac{K}{\gamma-1}\left(V_{1}^{-(\gamma-1)}-V_{2}^{-(\gamma-1)}\right)\]
Es decir,
\[ W=\frac{P_{1} V_{1}-P_{2} V_{2}}{\gamma-1}=\frac{R\left(T_{1}-T_{2}\right)}{\gamma-1}\]
(Obsérvese que T 2 < T 1 en esta expansión adiabática.)
Compárelo con la ecuación 8.3.1 para una expansión isotérmica.
Tenga en cuenta también que, dado que R = C P − C V y C P /C V = γ esto también se puede escribir
\[ W=C_{V}\left(T_{1}-T_{2}\right)\]
Esto también es igual al calor que se perdería si el gas se enfriara de T1 a T2 a volumen constante. ¡Piensa en esto! ¿Es una coincidencia, o debe ser así?
Aquí hay un ejercicio útil. En la figura VIII.2, un gas va de (P 1, V 1) a (P 2, V 2) a través de tres rutas reversibles diferentes:
a) Una expansión isobárica seguida de una disminución isocórica de la presión;
b) Una disminución isocórica de la presión seguida de una expansión isobárica;
c) Una expansión adiabática.
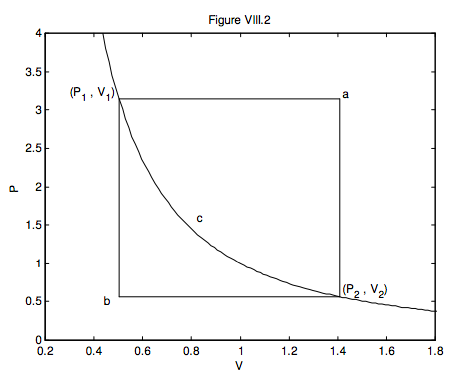
En cada etapa, calcule el trabajo realizado sobre o por el gas, el calor ganado por el gas o perdido del gas, y el aumento o disminución de la energía interna del gas. Este ejercicio ilustrará que U es una función de estado, pero Q y W no lo son. (Espero que las respuestas estén en álgebra; ignore los números en los ejes — no significan nada en particular).


