2.3: Primera Ley de Termodinámica
- Page ID
- 88838
El clima implica calefacción y enfriamiento, aumento de paquetes de aire y caída de lluvia, tormentas eléctricas y nieve, congelación y descongelación. Todo este clima ocurre de acuerdo a las tres leyes de la Termodinámica. La Primera Ley de la Termodinámica nos dice cómo dar cuenta de la energía en cualquier sistema molecular, incluida la atmósfera. Como veremos, el concepto de temperatura está estrechamente ligado al concepto de energía, es decir, la energía térmica, pero no son lo mismo porque hay otras formas de energía que se pueden intercambiar con la energía térmica, como la energía mecánica o la energía eléctrica. Cada paquete aéreo contiene moléculas que tienen energía interna, que al pensar en la atmósfera, es solo la energía cinética de las moléculas (asociada a rotaciones moleculares y, en algunos casos, vibraciones) y la energía potencial de las moléculas (asociada a las fuerzas atractivas y repulsivas entre las moléculas). La energía interna no considera sus enlaces químicos ni la energía nuclear del núcleo porque estos no cambian durante las colisiones entre moléculas de aire. Hacer trabajo en una paquetería aérea implica ya sea expandirla aumentando su volumen o contratándola. En la atmósfera, como en cualquier sistema de moléculas, la energía no se crea ni se destruye, sino que se conserva. Solo necesitamos hacer un seguimiento de dónde viene la energía y hacia dónde va.

\(U\)Sea la energía interna de una parcela aérea,\(Q\) sea la tasa de calentamiento de esa parcela aérea, y\(W\) sea la tasa que se haga el trabajo en la parcela aérea. Entonces:
\[\frac{d U}{d t}=Q+W\]
Las dimensiones de la energía son M L 2 T —2 así que las dimensiones de esta ecuación son M L 2 T —3.
Para darle más sentido a esta ecuación del presupuesto energético, necesitamos relacionar U, Q y W con variables que podamos medir. Una vez que hagamos eso, podremos poner en práctica esta ecuación. Para ello, recurrimos a la Ley de Gas Ideal.
Para procesos como los que ocurren en la atmósfera, podemos relacionar el trabajo, W, con un cambio de volumen porque el trabajo es fuerza tiempos distancia. Imagina un cilindro con un gas dentro. El área de la sección transversal del pistón es\(A\). Si el pistón comprime el gas moviéndose una distancia\(dx\), la cantidad de trabajo que realiza el pistón en el gas es la fuerza (\(pA\)) multiplicada por la distancia (\(dx\)). \(W\)es entonces\(pAdx/dt\). Pero el cambio de volumen es simple\(–Adx/dt\) y así:
\ [
w=-p\ frac {d V} {d t}
\]
Reducir un volumen de gas (dV/dt < 0) requiere energía, por lo que trabajar en una parcela aérea es positivo cuando se reduce el volumen, o dV/dt < 0. Así:
\ [
\ frac {d U} {d t} =q-p\ frac {d V} {d t}
\]
Capacidad de Calor
La capacidad calorífica C es la cantidad de energía necesaria para elevar la temperatura de una sustancia en cierta cantidad. Así,\(C=\frac{Q}{\frac{d T}{d t}}\) y tiene unidades SI de J/K. C depende de la sustancia misma, de la masa de la sustancia, y de las condiciones bajo las cuales se agrega la energía. Consideraremos dos condiciones especiales: volumen constante y presión constante.
Capacidad calorífica a volumen constante
Considera una caja con paredes rígidas y así volumen constante:\(\frac{d V}{d T}=0\). No se está haciendo ningún trabajo y solo la energía interna puede cambiar debido a la calefacción.
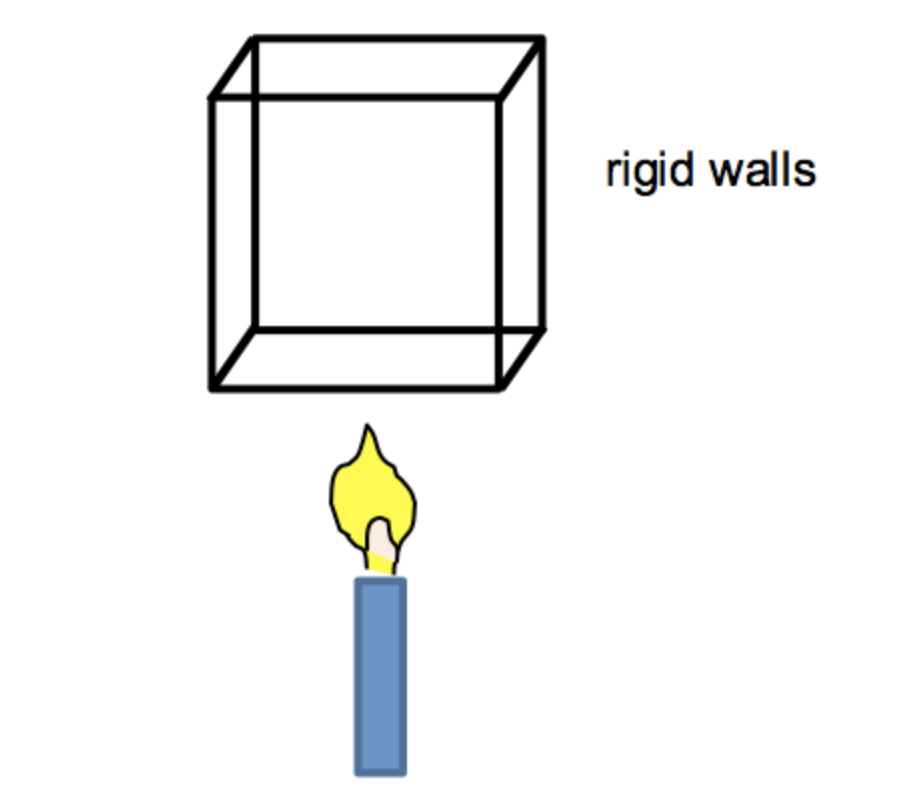
La vela suministra energía a la caja, por lo que Q > 0 y dU/dt > 0. La energía interna puede aumentar a través de aumentos en la cinética molecular y la energía potencial. Sin embargo, para un gas ideal, se pueden ignorar las fuerzas atractivas y repulsivas entre las moléculas (y por lo tanto la energía potencial molecular). Así, la energía cinética molecular y, por lo tanto, la temperatura, deben aumentar:
\ [
\ frac {d T} {d t} >0
\]
Entonces,
\ [
Q_ {\ texto {const}} =\ frac {d U} {d t} =C_ {V}\ frac {d T} {d t}
\]
C V, la constante que relaciona Q con el cambio de temperatura, se denomina capacidad calorífica a volumen constante. La capacidad calorífica cuenta con unidades de J K -1.
Recuerda que\(C_{v} \frac{d T}{d t}\) es el cambio en la energía interna de la paquetería aérea.
La capacidad calorífica, C V, depende de la masa y del tipo de material. Así podemos escribir C V como:
\ [
C_ {V} =\ nombreoperador {masa}\ cdot c_ {V}
\]
donde c V se llama la capacidad calorífica específica. El adjetivo “específico” significa la cantidad de algo por unidad de masa. Cuanto mayor sea la capacidad calorífica, menor será el cambio de temperatura para una cantidad dada de calentamiento.
Algunos valores específicos de la capacidad calorífica se incluyen en la siguiente tabla:
| gas | c V (@ 0 o C) J kg —1 K —1 |
|---|---|
| aire seco | 718 |
| vapor de agua | 1390 |
| dióxido de carbono | 820 |
Resuelve el siguiente problema por tu cuenta. Después de llegar a su propia respuesta, haga clic en el enlace para verificar su trabajo.
Ejercicio
Considera una bóveda sellada con un volumen interno de 10 m 3 lleno de aire seco (p = 1013 hPa; T = 273 K). Si la bóveda se está calentando a una velocidad constante desde el exterior a una velocidad de 1 kW (1,000 J s —1), ¿cuánto tiempo tardará en subir la temperatura 30 o C?
- Haga clic para responder
-
La 1ª Ley puede ser reescrita como:
\(Q=\frac{d U}{d t}+p \frac{d V}{d t}=C_{V} \frac{d T}{d t}+p \frac{d V}{d t}=\operatorname{mass} \cdot c_{V} \frac{d T}{d t}+p \frac{d V^{2.27} ]}{d t}\)
Sin embargo, dV/dt = 0 porque el volumen de la bóveda no está cambiando. Entonces, podemos usar la ecuación, reorganizarla e integrarla:
\(Q=\operatorname{mass} \cdot c_{V} \frac{d T}{d t}\)
¿Cómo encontramos la masa del aire dentro de la bóveda? ¡Usa la Ley de Gas Ideal para encontrar el número de moles y luego multiplicar por la masa por mol!
masa\(=M_{\text {dryair}} \cdot n=M_{\text {dryair}} \cdot \frac{p V}{R^{*} T}=0.029 \cdot \frac{1.013 \times 10^{5} \cdot 10}{8.314 \cdot 273}=12.9 \mathrm{kg}\)
\(\Delta t=\frac{\text {mass} \cdot c_{V} \cdot \Delta T}{O}=\frac{12.9 \cdot 718 \cdot 30}{10^{3}}=278 \mathrm{s}(\sim 5 \mathrm{min})\)
Muchas veces no tenemos un volumen bien definido, sino solo una masa de aire. Podemos medir fácilmente la presión y temperatura de la masa de aire, pero no podemos medir fácilmente su volumen. A menudo podemos calcular la velocidad de calentamiento por volumen (o masa) de aire. Así:
\ [
\ frac {Q} {m a s s}\ equiv q=\ frac {m a s s\ cdot c_ {V}\ frac {d T} {d t} {d t}} {m a s} =c_ {V}\ frac {d T} {d t};\ quad q=c_ {V}\ frac {d T} {d t}
\]
donde q es la velocidad de calentamiento específica (unidades SI: J kg —1 s —1).
Capacidad de Calor Presión Constante
La atmósfera no es una caja sellada y cuando el aire se calienta puede expandirse. Ya no podemos ignorar el cambio de volumen. Por otro lado, a medida que cambia el volumen, cualquier cambio de presión se amortiga rápidamente, lo que hace que la presión en una parcela aérea sea aproximadamente constante incluso a medida que cambian la temperatura y el volumen. Este proceso de presión constante se llama isobárico.
\ [
Q=\ frac {d U} {d t} +p\ frac {d V} {d t}
\]
Ahora el cambio en la energía interna podría deberse a cambios de temperatura o cambios de volumen. Resulta que la energía interna no cambia con los cambios de volumen. Sólo cambia debido a cambios de temperatura. Pero ya sabemos cómo se relacionan los cambios en la energía interna con los cambios de temperatura a partir del ejemplo de calentar la caja cerrada. Es decir, los cambios internos de energía están relacionados por el volumen constante de capacidad calorífica, C v. Así:
\ [
Q=C_ {V}\ frac {d T} {d t} +p\ frac {d V} {d t}
\]
Tenga en cuenta que cuando el volumen es constante, obtenemos la expresión de calentar un volumen constante.
Supongamos que sacamos la tapa de la caja y ahora el paquete aéreo está abierto al resto de la atmósfera. ¿Qué sucede cuando calentamos el paquete de aire? ¿Cuánto sube la temperatura?
Es difícil de decir porque es posible que el volumen de la parcela aérea pueda cambiar además del aumento de temperatura. Entonces podríamos sospechar que, para una velocidad de calentamiento fija Q, el aumento de temperatura en la caja abierta será menor que el aumento de temperatura en la caja sellada donde el volumen es constante porque el volumen puede cambiar así como la temperatura.
Entalpía
La entalpía (H) es una cantidad de energía que da cuenta no solo de la energía interna sino también de la energía asociada al trabajo. Es una manera útil de tomar en consideración ambas formas en que la energía puede cambiar en una colección de moléculas, por cambios internos de energía y por cambios de volumen que dan como resultado que se realice un trabajo
entalpía\(\equiv H=U+p V\)
La entalpía es la energía total de la parcela aérea, incluidos los efectos de los cambios de volumen. Podemos hacer algo de álgebra y usar la Regla de Cadena para escribir la Primera Ley de la Termodinámica en términos de la entalpía:
\ [
Q=\ frac {d U} {d t} +p\ frac {d V} {d t} =\ frac {d U} {d t} +\ frac {d (p V)} {d t} -V\ frac {d p} {d t} =\ frac {d (u+p V)} {d t} -V\ frac {d p} d t} =\ frac {d H} {d t} -V\ frac {d p} {d t}
\]
Si la presión es constante, lo cual es cierto para muchos procesos de paquetería aérea, entonces dp/dt = 0 y:
\ [
Q=\ frac {d H} {d t}
\]
Resumen
- En un proceso de volumen constante, el calentamiento cambia solo la energía interna, U.
- En un proceso de presión constante, el calentamiento cambia la entalpía, H (tanto de energía interna como de trabajo).
En analogía con el proceso de volumen constante, para un proceso de presión constante, podemos escribir:
\(Q_{\text { constant }}=\frac{d H}{d t}=C_{p} \frac{d T}{d t}\)
donde C p es la capacidad calorífica a presión constante y c p es la capacidad calorífica específica a presión constante.
Tenga en cuenta que c p toma en cuenta la energía requerida para aumentar el volumen así como para aumentar la energía interna y por lo tanto la temperatura.
¿Cuál es la diferencia entre c p y c v? Verás la derivación de la relación, pero solo voy a presentar los resultados:
- por mole:c (p, m) =\(c_{(p, m)}=c_{(V, m)}+R^{*}\)
- en masa para aire seco:\(c_{p d}=c_{V d}+R_{d}\)
- en masa para vapor de agua:\(c_{p v}=c_{V v}+R_{v}\)
| gas | c V (@ 0 o C) J kg —1 K —1 | c p (@ 0 o C) J kg —1 K —1 |
|---|---|---|
| aire seco | 718 | 1005 |
| vapor de agua | 1390 | 1858 |
Desde c p > c v, el cambio de temperatura a presión constante será menor que el cambio de temperatura a volumen constante debido a que parte de la energía va a aumentar el volumen así como a aumentar la temperatura.
Resumen de Formas de la Primera Ley de la Termodinámica
\(Q=C_{V} \frac{d T}{d t}+p \frac{d V}{d t}\)
\(Q=C_{p} \frac{d T}{d t}-V \frac{d p}{d t}\)
\(Q=\frac{d U}{d t}+p \frac{d V}{d t}\)
\(Q=\frac{d H}{d t}-V \frac{d p}{d t}\)
y\(c_{p}=c_{V}+R, C_{p}=c_{p} m=c_{p} \rho V, C_{v}=c_{v} m=c_{v} \rho V ; a=V / M(\text { specific }\) volumen)
Podemos observar cantidades específicas, donde dividimos las variables por masa.
\(q=c_{V} \frac{d T}{d t}+p \frac{d \alpha}{d t}\)
\(q=c_{p} \frac{d T}{d t}-\alpha \frac{d p}{d t}\)
\(q=\frac{d u}{d t}+p \frac{d \alpha}{d t}\)
Puedes averiguar qué formulario usar siguiendo tres pasos:
- Definir el sistema. (es decir, ¿cuál es la paquetería aérea y cuáles son sus características?)
- Determinar el (los) proceso (es decir, ¿presión constante, volumen constante, calentamiento, enfriamiento?). Elige la forma de la ecuación haciendo que desaparezca un término con una cantidad conservada (es decir, dp/dt = 0 o dV/dt = 0) porque entonces tienes una ecuación más simple con la que lidiar.
- Mira qué variables tienes y luego elige la ecuación que tiene esas variables.
Ejercicio
Considere la capa superficial atmosférica que tiene 100 m de profundidad y tiene una densidad promedio de 1.2 kg m —3. El sol temprano de la mañana calienta la superficie, lo que calienta el aire con una velocidad de calentamiento de F = 50 W m —2. ¿Qué tan rápido aumenta la temperatura en la capa? ¿Por qué es importante este aumento?
- ¿Cuál es el sistema? Capa de aire. Ya que conocemos la calefacción por unidad de área, trabajamos el problema por unidad de área.
- ¿Cuál es el proceso? Presión constante y calentamiento por el sol.
- ¿Qué variables tenemos? \(Q=C_{p} \frac{d T}{d t}\)
- Haga clic para obtener la respuesta.
-
\(Q=F A=50 W m^{-2} A\)
\(C_{p}=c_{p} \rho V=c_{p} \rho \Delta z A\)
\(Q=F A=c_{p} \rho \Delta z A \frac{d T}{d t}\)\(\frac{d T}{d t}=\frac{F A}{c_{p} \rho \Delta z A}=\frac{F}{c_{p} \rho \Delta z}=\frac{50}{10051.2100}=4.2 \times 10^{-4} K s^{-1}=1.5 K h r^{-1}\)
Este aumento de temperatura es importante porque es uno de los factores más importantes para determinar si la convección ocurrirá más tarde en el día. Pronto hablaremos más sobre la inestabilidad.
Aquí hay un video (1:30) explicación del problema anterior:
Calefacción de aire seco
- Haga clic aquí para ver la transcripción del Video de Calefacción de Aire Seco.
-
Pasemos por este problema considerando el calentamiento del aire en la parte más baja de la atmósfera, que se llama límite atmosférico. El sol calienta la tierra, y luego la tierra calienta el aire en contacto con ella. Para ver qué tan rápido se calentará el aire, necesitamos conocer la velocidad de calentamiento, pero también necesitamos conocer la capacidad de la parcela aérea. La velocidad de calentamiento se da en vatios por metro cuadrado, entonces podemos multiplicar por alguna área arbitraria para obtener la tasa de calentamiento total. Casi siempre, el calentamiento y enfriamiento atmosférico ocurre a presión constante. La capacidad calorífica, entonces, depende de la capacidad calorífica específica a presión constante. Pero también depende de la masa de la parcela aérea, que es densidad por volumen. Entonces necesitamos encontrar la densidad, si no nos la da. Para eso puedes usar la ley de gas ideal. El volumen es solo la altura multiplicada por el área. Entonces ponemos la velocidad de calentamiento en el lado izquierdo y el efecto de la calefacción en la parcela a la derecha. Estamos asumiendo un paquete aéreo bastante uniforme, así que vemos que realmente no necesitábamos multiplicar por área en absoluto, ya que simplemente se cancela. Podemos reorganizar esta ecuación para obtener el cambio de temperatura por tiempo a la izquierda y todas las variables conocidas a la derecha. Y entonces podemos meter los números, y podemos averiguar cuál es el cambio de temperatura con el tiempo.
Ejercicio
Considere la capa superficial atmosférica que tiene 100 m de profundidad y tiene una densidad promedio de 1.2 kg m —3. Es de noche y oscuridad y la tierra en contacto con el aire se está enfriando a 50 W m —2. Si la temperatura al inicio de la noche era de 25 o C, ¿cuál es la temperatura 8 horas después?
- ¿Cuál es el sistema? Capa de aire. Ya que conocemos el enfriamiento por unidad de área, trabajamos el problema por unidad de área.
- ¿Cuál es el proceso? Presión constante y enfriamiento por la tierra irradiando energía al espacio y la refrigeración por aire al estar en contacto con la tierra.
- ¿Qué variables tenemos? \(Q=C_{p} \frac{d T}{d t}\)
- Haga clic para obtener la respuesta.
-
\(Q=F A=-50 W m^{-2} A\)
\(C_{p}=c_{p} \rho V=c_{p} \rho \Delta z A\)
\(Q=F A=c_{p} \rho \Delta z A \frac{d T}{d t}\)\(\frac{d T}{d t}=\frac{F A}{c_{p} \rho \Delta z A}=\frac{F}{c_{p} \rho \Delta z}=\frac{-50}{10051.2100}=-4.2 x 10^{-4} K s^{-1}=-1.5 K h r^{-1}\)
Dado que el enfriamiento continúa por 8 horas, la cantidad total de enfriamiento es de —1.5 K/hr x 8 hr = 12 K o 12 o C. Así, la temperatura 8 horas después será de 13 o C.
Este enfriamiento cerca de la superficie crea una capa de aire frío cerca de la superficie con una capa de aire más cálido por encima de ella. La estratificación del aire caliente sobre el aire más frío crea una inversión de temperatura, que suprime la convección y bloquea los contaminantes en la capa de aire cerca de la superficie de la Tierra.


