9.2: Medidas de la Capacidad de Fluir de Cargas
- Page ID
- 81798
La idea de flujo de cargas es fundamental tanto para la ingeniería eléctrica como para la química. Sin embargo, los ingenieros eléctricos y químicos hacen diferentes suposiciones, y utilizan diferentes notaciones para describir fenómenos estrechamente relacionados. Los ingenieros prefieren trabajar con sólidos porque los sólidos son duraderos. Los ingenieros eléctricos suponen que todas las discusiones involucran sólidos a menos que se especifique lo contrario Los químicos, sin embargo, están bastante interesados en, y asumen que todas las discusiones involucran, líquidos, con especial énfasis en soluciones acuosas. Las baterías y las pilas de combustible generalmente implican flujo de carga a través de líquidos y sólidos, por lo que para entender estos dispositivos, tenemos que estar familiarizados con las notaciones y suposiciones de ambos campos de estudio.
En conductores sólidos, los electrones de valencia fluyen. Se supone que los electrones de la capa interna están tan fuertemente unidos a los átomos que sus movimientos pueden ser ignorados. Los núcleos son tanto más pesados que los electrones que sus movimientos también pueden ser ignorados. En semiconductores sólidos fluyen tanto electrones de valencia como huecos. Los ingenieros eléctricos miden la capacidad de las cargas para fluir en los materiales por la conductividad eléctrica.
Los iones positivos y negativos pueden fluir más fácilmente en líquidos que en sólidos, por lo que los químicos se preocupan por el flujo tanto de electrones como de iones. Los físicos semiconductores tienden a usar los términos conductividad eléctrica, resistividad, nivel de Fermi y brecha de energía. Los químicos están tan interesados en la capacidad de fluir de las cargas que tienen muchas medidas interrelacionadas para describirla. Discutiremos las siguientes medidas:
- Electronegatividad de Mulliken
- Energía de ionización
- Afinidad electrónica
- Electronegatividad
- Potencial químico
- Dureza química
- Potencial redox
- pH
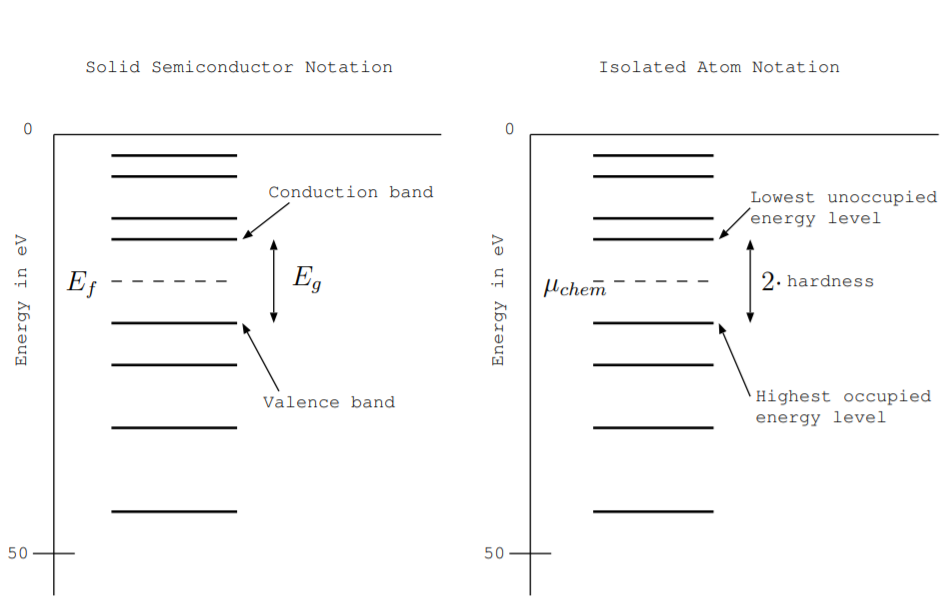
Se revisaron la conductividad eléctrica, el nivel de energía de Fermi y la brecha de energía
\(\sigma\)La conductividad eléctrica se mide en unidades\(\frac{1}{\Omega \cdot m}\), y se discutió en la Sec. 8.6.2. La inversa es la resistividad\(\rho = \frac{1}{\sigma}\) medida en\(\Omega \cdot m\). La conductividad eléctrica y la resistividad son medidas de la capacidad de los electrones para fluir a través de un material. Como se describe en la Ecuación 8.5.10, la conductividad eléctrica es directamente proporcional al número de cargas presentes y a la movilidad de las cargas. Los conductores tienen una gran conductividad eléctrica y los aisladores tienen una conductividad eléctrica pequeña. Estas medidas pueden describir líquidos y gases así como sólidos. Además, los gases, líquidos y sólidos pueden clasificarse como conductores, dieléctricos o semiconductores.
El nivel de energía de Fermi, la brecha de energía, la banda de valencia y la banda de conducción se definieron en la Sección 6.3. La parte izquierda de la Fig. \(\PageIndex{1}\)muestra un diagrama de nivel de energía ampliado para que solo se muestren algunos niveles, y estos términos se ilustran en la figura. A\(T = 0\) K, los niveles de energía se llenan hasta algún nivel llamado la banda de valencia. El nivel de energía por encima de él, que está sin llenar o parcialmente sin llenar, se llama banda de conducción. La cantidad de energía necesaria para eliminar completamente un electrón de la banda de valencia se representa por la distancia vertical desde ese nivel de energía hasta el estado fundamental, etiquetado 0 eV, en la parte superior de la figura. La brecha de energía\(E_g\),, es la distancia vertical entre las bandas de valencia y conducción. Representa la cantidad mínima de energía necesaria para excitar un electrón. El nivel de energía de Fermi representa el nivel de energía en el que la probabilidad de encontrar un electrón es de 0.5. En\(T = 0\) K, está en la mitad de la brecha energética. En la figura, se muestra como una línea punteada. Cualitativamente, representa la cantidad de energía necesaria para eliminar el siguiente electrón. Ningún electrón tiene exactamente esa energía porque no hay estados permitidos en la brecha. Para un semiconductor dopado, un semiconductor con defectos cristalinos, o un semiconductor no a temperatura absoluta cero, el nivel de Fermi está cerca pero no del todo en la mitad del hueco.
La parte derecha de la figura muestra el mismo diagrama de nivel de energía etiquetado usando términos más comúnmente utilizados por los químicos para describir átomos aislados que por físicos para describir semiconductores sólidos. Los químicos a veces usan el término nivel de energía ocupado más alto en lugar de banda de valencia. Este término se usa con mayor frecuencia para referirse a los niveles de energía de átomos o moléculas aisladas porque algunos autores reservan el término banda para un nivel de energía compartido entre átomos vecinos. De manera similar, los químicos a veces usan el término nivel de energía desocupada más bajo en lugar de la banda de conducción. Como se analiza a continuación en las Secs. 9.2.3 y 9.2.4,\(\mu_{chem}\) se usa el término potencial químico en lugar del nivel de energía de Fermi\(E_f\), y la brecha de energía\(E_g\) puede denominarse el doble de dureza química.
Electronegatividad Mulliken
Una medida que los químicos utilizan para describir la capacidad de flujo de las cargas es la electronegatividad, y este término tiene múltiples definiciones en la literatura. Una definición es de Mulliken en 1934 [130], y esta medida será referida como la electronegatividad de Mulliken. Mulliken aproximó la energía en un enlace químico promediando la energía de ionización\(I_{ioniz}\) y la afinidad electrónica\(A_{af\,f}\). Se define la electronegatividad de Mulliken
\[\chi_{Mulliken} = \frac{I_{ioniz} + A_{af\,f}}{2}. \label{9.2.1} \]
La energía de ionización es la energía necesaria para eliminar un electrón de un átomo o ion, y la afinidad electrónica es el cambio de energía cuando se agrega un electrón a un átomo o ion [12]. Todas estas cantidades,,\(\chi_{Mulliken}\)\(I_{ioniz}\), y\(A_{af\,f}\), se miden en las unidades SI de\(\frac{J}{atom}\) u ocasionalmente en otras unidades como\(\frac{eV}{atom}\) o\(\frac{kJ}{mol}\).
Esta definición es más simple que otras definiciones de electronegatividad, y la referencia [131] llama a esta definición “operativa y aproximada”. Es útil porque implica la fuerza de los enlaces químicos, y podemos relacionarlo con las medidas utilizadas por los investigadores de semiconductores. Cualitativamente, la energía de ionización está representada por la energía necesaria para arrancar un electrón. En la Fig. \(\PageIndex{1}\), es la distancia vertical desde la banda de valencia o estado ocupado más alto hasta el estado fundamental en la parte superior de la figura. A veces los químicos llaman a esta cantidad de energía la función de trabajo en su lugar [60, ch. 6] [108]. En la Fig. \(\PageIndex{1}\), la afinidad electrónica se representa por la distancia vertical desde la banda de conducción o estado desocupado más bajo hasta el estado fundamental en la parte superior de la figura. La magnitud de la electronegatividad de Mulliken es el promedio de estas dos energías, por lo que es la magnitud de la energía Fermi en\(T = 0\) K. Por convención, tiene el signo contrario.
\[\chi_{Mulliken} = \left. -E_f \right|_{T=0}K \nonumber \]
Fundamentalmente, la ingeniería eléctrica es el estudio del flujo de cargas. La química es el estudio de la fuerza de los enlaces químicos. La conductividad eléctrica de un material es alta cuando los enlaces químicos que mantienen ese material juntos se rompen fácilmente para que muchas cargas libres puedan fluir. La conductividad eléctrica de un material es baja cuando los enlaces químicos que mantienen los átomos juntos requieren mucha energía para romperse. La electronegatividad es una medida de la energía requerida para romper los enlaces químicos, por lo que fundamentalmente, nos dice información similar a la conductividad eléctrica.
Potencial Químico y Electronegatividad
Otra forma de definir la electronegatividad sigue la definición introducida por Pritchard en 1956 [132]. Esta definición es una de las más comunes, y es utilizada tanto por los químicos [131] [133] como por otros científicos [2, p. 124.]. La electronegatividad de un átomo se define como
\[\chi = \left. - \left( \frac{\partial \mathbb{U}}{\partial N} \right) \right|_{V,S,} \label{9.2.3} \]
donde\(\mathbb{U}\) es la energía interna relativa a un átomo neutro y\(N\) representa el número de electrones alrededor del átomo. Un átomo está compuesto por un núcleo cargado y electrones cargados que se mueven alrededor del núcleo, por lo que hay un campo eléctrico, y de ahí un potencial eléctrico\(V\) en voltios, alrededor de un átomo. Este potencial depende significativamente del número de electrones alrededor del átomo. Además, cuando el átomo está a una temperatura por encima del cero absoluto, los electrones y núcleos están en movimiento, por lo que el átomo tiene cierta entropía\(S\). La electronegatividad implica\(\frac{\partial \mathbb{U}}{\partial N}\) a potencial eléctrico constante y entropía. Se aplica si los átomos son parte de un sólido, líquido o gas.
El potencial químico\(\mu_{chem}\) se define como el negativo de esta electronegatividad.
\[\mu_{chem} = -\chi \nonumber \]
En las unidades SI, tanto el potencial químico como la electronegatividad se miden en\(\frac{J}{atom}\), pero a veces también se expresan en\(\frac{eV}{atom}\) o\(\frac{kJ}{mol}\). Como si los tres nombres, potencial químico, negativo de la electronegatividad, y nivel de energía de Fermi, no fueran suficientes, esta cantidad también se conoce como la energía parcial libre molar [60, p. 145].
La electronegatividad se usa para describir una colección de átomos, moléculas o iones todos del mismo estado de ionización [131]. Se requiere menos energía para extraer el primer electrón de un átomo que el segundo o tercer electrón. La definición de electronegatividad es específica del potencial\(V\), en voltios, debido al núcleo y electrones alrededor de un átomo. Por ejemplo, podemos hablar de la electronegatividad, energía requerida para arrancar el electrón, de un átomo de magnesio neutro. También podemos hablar de la electronegatividad, energía requerida para arrancar un electrón, de un\(^+\) ion Mg. El campo eléctrico, y por lo tanto el potencial\(V\), alrededor de un átomo de Mg neutro y el campo eléctrico, y por lo tanto el potencial\(V\), alrededor de un ion magnesio Mg\(^+\) son necesariamente diferentes debido al número de electrones presentes. Las energías requeridas para arrancar el siguiente electrón de estos átomos también serán necesariamente diferentes. Entonces, la electronegatividad de un material siempre se refiere a un estado de ionización específico. La electronegatividad incorpora tanto la energía requerida o ganada al arrancar un electrón como la energía requerida o ganada al adquirir un electrón. Cualitativamente, es el promedio de la energía de ionización requerida para arrancar un electrón y la afinidad electrónica liberada cuando se captura un electrón. En el caso del átomo de Mg del ejemplo anterior, la energía ganada al liberar un electrón es el término significativo, pero ese no siempre es el caso.
En la mayoría de los dispositivos de conversión de energía, y en la mayoría de las reacciones químicas, solo nos interesan los electrones de valencia. Entonces, aunque un átomo tenga docenas de electrones a su alrededor y la energía para arrancar cada electrón es diferente, solo nos interesan los primeros electrones de valencia. Veremos que las baterías y las pilas de combustible involucran energía almacenada en enlaces químicos. Solo los electrones de valencia están involucrados en las reacciones de baterías y pilas de combustible, por lo que al estudiar baterías y pilas de combustible, estamos más interesados en la electronegatividad de átomos neutros o ionizados individualmente.
La ecuación\ ref {9.2.3} define la electronegatividad como la energía requerida para arrancar el siguiente electrón del átomo. De nuevo considere la Fig. \(\PageIndex{1}\). El nivel de energía conocido como la banda de valencia para los físicos semiconductores y el estado más alto ocupado para los químicos está lleno de electrones. La siguiente banda más alta, llamada ya sea la banda de conducción por los físicos semiconductores o el estado más bajo desocupado por los químicos, no está llena de electrones. La electronegatividad según esta definición es la energía requerida para arrancar el siguiente electrón. En promedio, nuevamente está representado gráficamente por el nivel Fermi.
Tanto la electronegatividad definida por la Ecuación\ ref {9.2.3} como la electronegatividad Mulliken definida por la Ecuación\ ref {9.2.1} tienen las mismas unidades. Sin embargo, se pueden encontrar otras múltiples definiciones de electronegatividad en la literatura. Una de las definiciones más antiguas se debe a Pauling en 1932 [134], y esa definición se mide en cambio en las unidades de raíz cuadrada de julios en una escala relativa. La referencia [135] amplió la definición de Pauling para mostrar variación con el estado de ionización y el radio atómico. La referencia [133] también contiene una definición diferente de electronegatividad también con sus propias unidades.
Dureza Química
Los químicos a veces usan el término dureza cuando los físicos semiconductores usarían el término la mitad de la brecha de energía. La dureza química no tiene nada que ver con la dureza mecánica. Al igual que con la electronegatividad, existen múltiples definiciones relacionadas de dureza. La dureza Mulliken se define como [131]
\[\text{Mulliken hardness} = \frac{I_{ioniz} − A_{af\,f}}{2}. \nonumber \]
Una definición más cuidadosa de dureza química es [131] [136, p. 93]
\[\text{hardness} = \left. \frac{1}{2} \left( \frac{\partial \mu_{chem}}{\partial N} \right) \right|_{V,S,}. \nonumber \]
Es la mitad del cambio en el potencial químico para el siguiente electrón, y cualitativamente está representado por la mitad de la brecha de energía. Al igual que con la electronegatividad, se especifica para un potencial dado en voltios alrededor del átomo y una entropía dada. Los líquidos pueden clasificarse como duros o blandos. Los ácidos duros y las bases duras tienen grandes brechas de energía, por lo que son aisladores eléctricos. Los ácidos blandos y las bases blandas tienen pequeñas brechas de energía, por lo que son conductores eléctricos. No se introducirá ninguna variable adicional para la dureza debido a que esta cantidad puede ser representada por la mitad de la brecha de energía,\(\frac{E_g}{2}\).
Potencial redox
\(V_{rp}\)El potencial redox (de reducción-oxidación) es otra medida utilizada por los químicos para describir la capacidad de los electrones de ser arrancados de sus átomos y fluir en presencia de un voltaje aplicado, químico cercano, campo óptico u otra fuente de energía. Como se definió anteriormente, el proceso de arrancar electrones se llama oxidación. El proceso de obtención de electrones se llama reducción. Juntos, forman reacciones redox. En lugar de medirse en julios como la electronegatividad, se mide en voltios donde un voltio es un joule por culomb. El potencial redox representa la energía almacenada en un enlace químico por unidad de carga. Es más utilizado por experimentalistas que teóricos, y a menudo se usa para describir sólidos en lugar de líquidos. El potencial redox es una propiedad macroscópica, que describe una pieza más grande de material en lugar de describir solo un átomo individual. También a veces se le llama potencial de oxidación-reducción o el potencial de electrodo estándar [137]. Es una medida relativa de la capacidad de una sustancia para perder un electrón. Se puede encontrar una lista de potenciales redox en las referencias [60, p. 158] y [137]. Existen diferentes formas de definir el potencial redox en la literatura. Las definiciones varían en su elección de un voltaje de referencia de tierra, y varían en sus convenciones de signo. Los investigadores estadounidenses y europeos tienden a utilizar diferentes definiciones.
El potencial redox se mide en una escala relativa. Para medir el potencial redox [138], se colocan electrodos en el sistema en estudio. Se aplica un potencial para equilibrar el voltaje interno. Al medir esta tensión aplicada externamente, se determina el potencial de un electrodo con respecto a un electrodo de referencia. A menudo, el potencial de un electrodo de platino se usa como referencia y se dice que tiene cero voltios en condiciones estándar de\(T = 25 ^{\circ}C\) y\(\mathbb{P} = 1\) atm. La reacción en el electrodo de platino es
\[\text{H}_2 \rightarrow 2\text{H}^+ + 2e^-. \nonumber \]
pH
El pH es una medida sin unidades de la probabilidad de que una molécula de agua esté unida o haya sido ionizada en una solución líquida. Se utiliza para clasificar líquidos como ácidos o básicos. Al discutir el pH, asumimos que el material bajo prueba es una solución líquida a una temperatura\(25 ^{\circ}C\) y una presión de 1 atm [12] [81]. Una solución líquida es una mezcla de agua y otro material llamado soluto. Más específicamente, el pH se define como
\[\text{pH} = \log_{10} \left( \frac{a}{[\text{H}^+]} \right). \nonumber \]
La cantidad\([\text{H}^+]\) es la cantidad concentración de iones hidrógeno en las unidades de mol L [68, p. 39].
\[[\text{H}^+] = \frac{\text{concentration H}^+ \text{ions, mol}}{\text{volume of solution in L}} \nonumber \]
Esta cantidad antiguamente se llamaba molaridad o concentración molar, pero estos términos ya no se recomiendan para su uso [68, p. 39]. El pH es una medida utilizada a menudo por los experimentalistas.
El concepto de pH está fundamentalmente relacionado con el flujo de cargas, concepto que es muy importante para los ingenieros eléctricos. El agua está compuesta por moléculas de H\(_2\) O. En agua pura, algunas de estas moléculas se desmoronan, ionizando en\(^+\) iones H (protones) e\(^-\) iones OH. Sin embargo, la mayoría de las moléculas permanecen intactas. Si se mezclan algunos solutos con el agua, se ionizarán más moléculas de H\(_2\) O que en agua pura. Por ejemplo, el dióxido de carbono se unirá con\(^-\) los iones OH formando ácido carbónico HCO\(_3^-\) provocando un aumento en\(^+\) los iones H. Dado que el pH es el log negativo de la actividad del\(^+\) ion H, aumentar la concentración de\(^+\) iones H equivale a una disminución del pH. Si se agrega amoníaco\(_3\), NH, al agua,\(_4^{+}\) se forma NH, y el número de\(^-\) iones OH aumenta dando como resultado un aumento en el pH. Dado que el agua es un líquido, tanto estos portadores de carga de iones positivos como negativos pueden moverse con relativa facilidad. Si se aplica un voltaje externo a través del líquido, los iones fluirán. La conductividad eléctrica será mayor en un líquido con más iones presentes que en líquidos con menos iones presentes.
Como ejemplo, considere lo que sucede cuando se agregan átomos de sodio neutros al agua. (Por razones obvias, no intentes esto en casa [139].) Es energéticamente favorable que los átomos de sodio se ionicen a Na\(^+\) cediendo un electrón. En el proceso, algunas moléculas de agua más se ionizan y algunos\(^+\) iones H se convierten en átomos de H neutros.
\[\mathrm{Na}+\mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{Na}^{+}+\mathrm{H}+\mathrm{OH}^{-} \nonumber \]
Al agregar el soluto de sodio, la solución tiene menos\(^+\) iones H. Considera lo que sucede cuando se agregan átomos de cloro neutro al agua. Es energéticamente favorable que un átomo de cloro adquiera un electrón a una forma de\(^-\) ion Cl.
\[\mathrm{Cl}+\mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{Cl}^{-}+\mathrm{H}^{+}+\mathrm{OH} \nonumber \]
Al agregar el cloro soluto, la solución tiene más\(^+\) iones H. Si bien estos ejemplos implican agregar átomos neutros, el concepto de pH se aplica a los solutos que también son moléculas.
Las soluciones con pH inferior a 7 se denominan ácidas. Si una solución tiene una alta concentración de\(^+\) iones H, tendrá un pH bajo y será ácida. En soluciones fuertemente ácidas, las moléculas del soluto desgarran muchas moléculas de agua, por lo que hay muchos iones presentes. Las soluciones con pH mayor a 7 se denominan alcalinas o básicas. Si una solución tiene una baja concentración de\(^+\) iones H, y de ahí una alta concentración de\(^-\) iones OH, tendrá un pH alto y será alcalina. En soluciones fuertemente alcalinas, las moléculas del soluto desgarran muchas moléculas de agua, por lo que nuevamente están presentes muchos iones. Las soluciones neutras tienen un pH cercano a 7, y algunas soluciones neutras pueden ser aislantes eléctricos. Las soluciones con un pH muy inferior o muy superior a 7 necesariamente tienen muchos iones presentes, y son buenos conductores eléctricos.
Como ejemplo, encontremos el pH de una solución con\(10^{15}\) iones de H\(^+\) en 1 L de agua.
\[\left[\mathrm{H}^{+}\right]=\frac{10^{15} \text { ions }}{1 \mathrm{L}} \cdot \frac{1}{6.022 \cdot 10^{23} \frac{\mathrm{ions}}{\mathrm{mol}}}=1.66 \cdot 10^{-9} \frac{\mathrm{mol}}{\mathrm{L}} \nonumber \]
\[\mathrm{pH}=\log \left(\frac{1}{1.66 \cdot 10^{-9}}\right) \approx 9 \nonumber \]
Observe que el exponente de\([\text{H}^+]\) es -9, y el pH es 9. Cualitativamente, el pH nos dice lo negativo del orden de magnitud de la cantidad concentración de iones hidrógeno. La solución en este ejemplo es alcalina.
Como ejemplo relacionado, vamos a encontrar el pH de una solución con\(10^{20}\) iones de H\(^+\) en 1 L de agua.
\[\left[\mathrm{H}^{+}\right]=\frac{10^{20} \text { ions }}{1 \mathrm{L}} \cdot \frac{1}{6.022 \cdot 10^{23} \frac{\mathrm{ions}}{\mathrm{mol}}}=1.66 \cdot 10^{-4} \frac{\mathrm{mol}}{\mathrm{L}} \nonumber \]
\[\mathrm{pH}=\log \left(\frac{1}{1.66 \cdot 10^{-4}}\right) \approx 4 \nonumber \]
Este ejemplo tiene más iones hidrógeno en la solución, por lo que es más ácido. El pH de 4 nos dice que la solución tiene aproximadamente\(10^{-4} \frac{mol}{L}\) de iones hidrógeno.
¿Cuántos iones hidrógeno se encuentran en una solución de 1 L con un pH de 7?
\[7=\log \left(\frac{1}{\left[\mathrm{H}^{+}\right]}\right) \nonumber \]
\[\left[\mathrm{H}^{+}\right]=10^{-7} \frac{\mathrm{ions}}{\mathrm{mol}} \nonumber \]
\[10^{-7} \frac{\mathrm{mol}}{\mathrm{L}} \cdot 1 \mathrm{L} \cdot 6.022 \cdot 10^{23} \frac{\mathrm{ions}}{\mathrm{mol}}=6.022 \cdot 10^{16} \mathrm{ions} \mathrm{H}^{+} \nonumber \]
Una solución neutra, con un pH de 7, aún contiene\(^+\) iones H.


