6.2.1: Algunos aspectos sobre la termodinámica
- Page ID
- 87162
Antes de analizar las características y ecuaciones de los elementos del motor a reacción, expliquemos brevemente algunos conceptos básicos respecto a la termodinámica (útiles para entender lo que sigue en la sección). Para mayor conocimiento, el lector es referido a cualquier libro de texto de pregrado sobre termodinámica.
La primera ley de la termodinámica se puede afirmar de la siguiente manera:
\[\Delta E = Q + W.\label{eq6.2.1.1}\]
donde\(E\) denota la energía del sistema,\(Q\) denota de calor y\(W\) denota el trabajo. En otras palabras, un aumento (disminución) en la energía del sistema da como resultado calor y trabajo.
La energía del sistema se puede expresar como:
\[E = U + \dfrac{mV^2}{2} + mgz,\]
donde\(U\) denota la energía interna, el término\(\tfrac{mV^2}{2}\) denota la energía cinética, y el término\(mgz\) denota la energía patencial (\(z\)siendo la altitud). En el caso de un motor a reacción,\(z\) puede considerarse casi constante, y el término potencial así descuidado. También, es típico utilizar valores de estancamiento para la presión y temperatura del gas, es decir, los valores que el gas tendría considerando\(V = 0\) como ya se presentó en el Capítulo 3. Bajo este supuesto, también se pueden descuidar los términos cinéticos. Por lo tanto, la ecuación (\(\ref{eq6.2.1.1}\)) se puede expresar como:
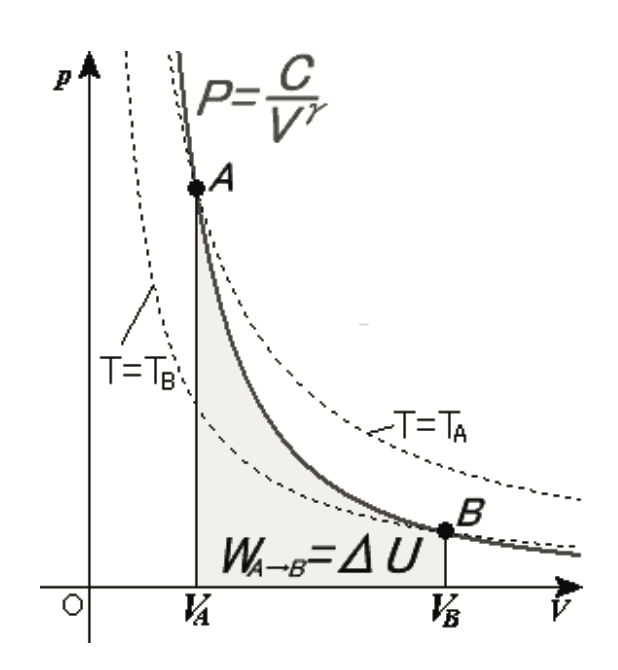
Figura 6.3: Croquis de un proceso adiabático. © Yuta Aoki/Wikimedia Commons/CC-BY-SA-3.0.
\[\Delta U = Q + W.\]
Ahora bien, la obra se puede dividir en dos términos: trabajo mecánico (\(W_{mech}\)) y trabajo necesario para expandir/contraer el gas (\(\Delta (PV)\)), es decir,
\[W = W_{mech} + \Delta (PV).\]
Además, la entalpía (\(h\)) del sistema se puede definir como:\(h = U + PV\). En suma, la ecuación de energía (Ecuación (\(\ref{eq6.2.1.1}\))) se puede expresar de la siguiente manera:
\[\Delta h = Q + W_{mech}.\]
Un aumento de la entalpía se puede expresar de la siguiente manera:
\[\Delta h = c \cdot \Delta T;\]
donde\(c\) está el calor específico del gas y\(T\) es la temperatura.
Además, exponemos ahora cómo se relacionan los valores de estancamiento con los valores reales:
\[h_t = h + \dfrac{V^2}{2};\]
\[p_t = p + \dfrac{1}{2} \cdot \rho \cdot V^2.\]
Observe que, si el proceso es adiabático entonces\(Q = 0\), y así el aumento (disminución) de la entalpía se convierte todo en trabajo mecánico. Se asumirán procesos adiabáticos para las etapas en el compresor y la turbina. Además, para un proceso adiabático existen algunas relaciones entre presión y temperatura para un gas ideal, es decir,
\[P \cdot V^{\gamma} = constant \to \dfrac{p_a}{p_b} = \left (\dfrac{T_a}{T_b} \right )^{\tfrac{\gamma}{\gamma - 1}},\]
ser\(a\) y condiciones de\(b\) estado dentro del proceso adiabático y\(\gamma\) la relación de calores específicos. 2
2. Esta relación también se conoce como relación de capacidad calorífica o índice adiabático.


