7.4: Modelos de Sustancias
- Page ID
- 86265
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Al aplicar la ecuación de conservación de energía para modelar un dispositivo físico, debemos evaluar frecuentemente los cambios en la energía interna o entalpía (en - thal '- py). Estos a su vez están relacionados con las propiedades directamente medibles como la presión, la temperatura y el volumen o densidad específicos. El estudio de cómo se relacionan las propiedades termofísicas es uno de los principales objetivos del estudio de la termodinámica.
Para nuestro presente estudio consideraremos solo dos modelos de sustancias. Estos modelos se presentarán sin desarrollo ni explicación significativa. Esto se cubrirá en un curso posterior. Cada modelo de sustancia nos proporciona una ecuación de estado para una clase importante de sustancias. Los principales resultados de ambos modelos se resumen en la Sección 7.4.3, y se le anima a omitir y obtener una imagen general antes de comenzar las descripciones más detalladas de cada modelo.
7.4.1 Modelo de gas ideal con calores específicos a temperatura ambiente
El modelo de gas ideal es familiar para la mayoría de los estudiantes de física y química; sin embargo, lo usaremos más extensamente de lo que la mayoría de ustedes han hecho anteriormente. El modelo de gas ideal es solo eso: un conjunto de ecuaciones constitutivas que modelan con precisión el comportamiento de los gases y vapores bajo ciertas condiciones restringidas.
Supuestos básicos
El modelo de gas ideal se basa en tres supuestos:
- La presión, el volumen y la temperatura obedecen a la ecuación ideal del gas:\[P V=N R_{u} T=m R T \quad \text { where } R=\frac{R_{u}}{M} \nonumber \]
- La energía interna específica solo depende de la temperatura:\[u=u(T) \nonumber \]
- La masa molar de un gas ideal es idéntica a la masa molar real de la sustancia:\[M_{\text {ideal gas }}=M_{\text {real stuff }} \nonumber \] Además, agregaremos una suposición adicional que simplificará enormemente nuestra introducción al uso de las propiedades ideales del gas.
- Los calores específicos son independientes de la temperatura. (En general, los calores específicos de hecho cambian con la temperatura, y esta variación se considerará más adelante para aumentar la precisión del modelo de gas ideal). Sin embargo, como una primera aproximación y una suposición bastante precisa para pequeños cambios de temperatura cerca de la temperatura ambiente, asumiremos que los calores específicos son constantes e iguales a los valores a temperatura ambiente.
Nos referiremos a nuestro modelo de gas ideal que se basa en las cuatro suposiciones como el “modelo de gas ideal con calores específicos a temperatura ambiente”.
\(P \text{-} \upsilon \text{-} T\)Relación
Un gas ideal por definición satisface la ecuación de gas ideal, Ec. \(\PageIndex{1}\). Normalmente nos parece más útil reorganizar esta ecuación para que solo incluya propiedades intensivas:\[P=\rho R T \quad \text { or } \quad P \upsilon = R T \nonumber \] donde\(R\) está la constante de gas específica\(\left(=R_{u} / M\right)\) con unidades de\(\mathrm{kJ} /(\mathrm{kg} \cdot \mathrm{K})\) o\((\mathrm{ft} \cdot \mathrm{lbf}) /\left(\mathrm{lbm} \cdot{ }^{\circ} \mathrm{R}\right)\). Esta ecuación se discutió extensamente en el Capítulo 3 y se le anima a revisar este material.
Cambios en\(u\) y\(h\)
El cambio diferencial en la energía interna específica\(u\) para un gas ideal se calcula usando la relación:\[d u=c_{v} \ d T \quad \text { [Ideal gas] } \nonumber \] donde\(c_{v}\) se llama “ver-sub-vee” o el calor específico a volumen constante (ver nota). Para calcular el cambio finito en\(u\) un gas ideal con calores específicos constantes, integramos la Ec. \(\PageIndex{5}\)entre el estado 1 y el estado 2 y obtener la ecuación:\[\Delta u=u_{2}-u_{1}=c_{v}\left(T_{2}-T_{1}\right) \quad \left[\begin{array}{c} \text { Ideal gas, } \\ \text { constant } c_{v} \end{array}\right] \nonumber \] Esta ecuación se puede utilizar para calcular\(\Delta u\) para cualquier proceso. No se restringe a procesos de volumen constante.
El cambio diferencial en la entalpía específica\(h\) para un gas ideal se calcula usando la relación:\[d h=c_{p} \ dT \quad \text { [Ideal gas] } \nonumber \] donde\(c_{p}\) se llama “ver-sub-pipí” o el calor específico a presión constante (ver nota). Para calcular el cambio finito en\(h\) un gas ideal con calores específicos constantes, integramos la Ec. \(\PageIndex{7}\)entre el estado 1 y el estado 2 y obtener la ecuación:\[\Delta h=h_{2}-h_{1}=c_{P}\left(T_{2}-T_{1}\right) \quad\left[\begin{array}{c} \text { Ideal gas, } \\ \text { constant } c_{p} \end{array}\right] \nonumber \] Esta ecuación se puede utilizar para calcular\(\Delta h\) para cualquier proceso. No se restringe a procesos de presión constante.
Los calientan específicos\(c_{P}\) y\(c_{v}\) se definen matemáticamente como las siguientes derivadas parciales:\[c_{v} \equiv \left(\frac{\partial u}{\partial T}\right)_{v} \quad \text { and } \quad c_{P} \equiv \left(\frac{\partial h}{\partial T}\right)_{P} \nonumber \] donde la frase “volumen constante” o “presión constante” se refiere específicamente a lo que se mantiene constante durante la diferenciación.
Relaciones específicas de calor
Los calores específicos para un gas ideal están relacionados con la constante de gas específica mediante la siguiente ecuación:\[c_{P}-c_{v}=R \quad \text { [Ideal gas] } \nonumber \] A veces lo único que sabemos (o recordamos para un gas es su relación térmica específica. La relación térmica específica se define como\[k \equiv \frac{c_{P}}{c_{v}} \nonumber \]
Combinando Eqs. \(\PageIndex{9}\)y\(\PageIndex{10}\) tenemos las siguientes ecuaciones que relacionan los calores específicos, la constante de gas específica y la relación de calores específicos. \[c_{v}=\frac{1}{k-1} R \quad \text { and } \quad c_{P}=\frac{k}{k-1} R \quad \text { [Ideal gas] } \nonumber \]Estas relaciones son frecuentemente útiles porque la relación de calores específicos es una función fuerte de la estructura molecular del gas, es decir, si es monatómico, etc., y una función más débil de su temperatura.
7.4.2 Modelo de Sustancia Incompresible con Calores Específicos a Temperatura Ambiente
El modelo de sustancia incompresible no es tan familiar como el modelo de gas ideal. Este modelo se basa en observaciones de cómo se comportan los líquidos y sólidos. Supondremos que este es un modelo preciso para la mayoría de líquidos y sólidos. No incorpora cambios de energía debido a la deformación elástica de los sólidos.
Supuestos básicos
El modelo de sustancia incompresible se basa en tres supuestos:
- El volumen específico de una sustancia incompresible es una constante:\[v=\text { constant } \nonumber \] Los valores de volumen específico se evaluarán a temperatura ambiente.
- La energía interna específica solo depende de la temperatura:\[u=u(T) \nonumber \]
- La masa molar de sustancia incompresible para una sustancia es idéntica a la masa molar real de la sustancia:\[M_{\text {incompressible substance}}=M_{\text {real stuff }} \nonumber \] Además, agregaremos una suposición adicional que simplificará enormemente nuestra introducción al modelo de sustancia incompresible.
- Los calores específicos son independientes de la temperatura. (En general, los calores específicos de hecho cambian con la temperatura; sin embargo, los cambios con la temperatura para la mayoría de los sólidos y líquidos son pequeños y esta es una suposición precisa). Supondremos que los calores específicos son constantes e iguales a los valores a temperatura ambiente.
Nos referiremos a nuestro modelo de sustancias incompresibles que se basa en las cuatro suposiciones como el “modelo de sustancia incompresible con calores específicos a temperatura ambiente”.
\(P \text{-} \upsilon \text{-} T\)Relaciones
Para una sustancia incompresible no existe relación entre la presión, el volumen específico y la temperatura de la sustancia. El valor del calor específico depende de la sustancia.
Las densidades de sólidos y líquidos de hecho cambian ligeramente con la temperatura. Cualquiera que haya llenado en exceso una bandeja de cubitos de hielo o se haya ocupado de una pipa congelada entiende este efecto. Para nuestros propósitos, asumiremos que el valor del volumen específico (o densidad) puede ser evaluado en condiciones de temperatura ambiente.
Cambios en\(u\) y\(h\)
El cambio diferencial en la energía interna específica\(u\) para una sustancia incompresible se calcula usando la relación:\[d u=c_{v} \ dT \quad \text { [Incompressible substance] } \nonumber \] donde\(c_{v}\) se llama “ver-sub-vee” o el calor específico a volumen constante (Ver nota anterior). Para calcular el cambio finito en\(u\) una sustancia incompresible con calores específicos constantes, integramos la Ec. \(\PageIndex{15}\)entre el estado 1 y el estado 2 y obtener la ecuación:\[\Delta u = u_{2}-u_{1} = c_{v}\left(T_{2}-T_{1}\right) \quad\left[\begin{array}{c} \text { Incompressible substance, } \\ \text {constant } c_{v} \end{array}\right] \nonumber \] Esta ecuación se puede utilizar para calcular\(\Delta u\) para cualquier proceso. No se restringe a procesos de volumen constante.
El cambio diferencial en la entalpía específica\(h\) para una sustancia incompresible se calcula usando la relación:\[dh = d(u+P \upsilon) = du + \upsilon \ dP \quad \text { [Incompressible substance] } \nonumber \] donde\(c_{p}\) se llama “see-sub-pee” o el calor específico a presión constante. Para calcular el cambio finito en\(h\) una sustancia incompresible con calores específicos constantes, integramos la Ec. \(\PageIndex{17}\)entre el estado 1 y el estado 2 y obtener la ecuación:\[\begin{array}{l} \Delta h &= u_{2}-u_{1} + \upsilon\left(P_{2}-P_{1}\right) \\ &= c_{v}\left(T_{2}-T_{1}\right) + \upsilon\left(P_{2}-P_{1}\right) \quad\left[\begin{array}{c} \text { Incompressible substance, } \\ \text { constant } c_{v} \end{array}\right] \end{array} \nonumber \] Esta ecuación se puede utilizar para calcular\(\Delta h\) para cualquier proceso.
Relaciones específicas de calor
Utilizando los supuestos básicos para la sustancia incompresible, se puede demostrar que dos calor específico a presión constante y volumen constante son iguales:\[c_{P}=c_{v}=c \quad \text { [Incompressible substance] } \nonumber \] donde a veces\(c\) se llama simplemente el calor específico. Por lo general, las tablas de datos para sólidos y líquidos solo enumerarán los valores\(c_{p}\) porque es la más fácil de medir.
7.4.3 Resumen de nuestros modelos de sustancias
Los supuestos básicos y las ecuaciones clave para cada uno de nuestros modelos de sustancias se resumen en la siguiente tabla. Una vez que haya seleccionado un modelo de sustancia para aplicarlo en un problema dado, esta tabla da todas las ecuaciones necesarias para aplicar el modelo. Los valores de temperatura ambiente para las propiedades termofísicas de varios gases, líquidos y sólidos se dan en las siguientes dos tablas. Una tabla da valores en SI y otra da valores en USCS.
Se requieren modelos de sustancias para relacionar propiedades en el balance energético como\(h\) y\(u\) con propiedades que son fáciles de medir como presión, temperatura y volumen específico.
| Dos Modelos de Sustancias (Relaciones Constitutivas) | ||
|---|---|---|
| Ecuación de Estado | ||
| Modelo de gas ideal con calores específicos a temperatura ambiente |
Modelo de Sustancia Incompresible con calores específicos a temperatura ambiente |
|
| Se utiliza para modelar el comportamiento de | gases y vapores | Líquidos y sólidos |
| Supuestos básicos del modelo |
|
|
| \(P \text{-} T \text{-} \rho\)y\(P \text{-} T \text{-} \upsilon\) relaciones | \(P = \rho RT\)y\(P \upsilon = RT\) donde\(R=R_{u} / M\) |
\(\upsilon = 1 / \rho = \text{constant}\) Evaluado a temperatura ambiente |
| Relaciones de calor específicas | \(c_{P} = c_{v} = R; \quad k = c_{P} / c_{v}\) | \(c_{p} = c_{v} = c, \text{ a constant}\) |
| \(c_{P}\)y\(c_{V}\) valores | Evaluado a temperatura ambiente | Evaluado a temperatura ambiente |
| \(\Delta u\)— energía interna específica | \(\Delta u = u_{2}-u_{1} = c_{v}\left(T_{2}-T_{1}\right)\) | \(\Delta u = u_{2}-u_{1} = c\left(T_{2}-T_{1}\right)\) |
| \(\Delta h\)— entalpía específica | \(\Delta h = h_{2}-h_{1} = c_{P}\left(T_{2}-T_{1}\right)\) | \[ \begin{aligned} \Delta h &= h_{2}-h_{1} \\ &= \left(u_{2}+P_{2} \upsilon\right) - \left(u_{1}+P_{1} \upsilon\right) \\ &= \left(u_{2}-u_{1}\right) + \upsilon \left(P_{2}-P_{1}\right) \\[4pt] \text{thus } \Delta h &= \Delta u + \upsilon \Delta P = c \Delta T + \upsilon \Delta T \end{aligned} \nonumber \] |
|
\(\Delta s\)— entropía específica Nota: Todas las temperaturas son valores absolutos, es decir\({ }^{\circ} \mathrm{R}\),\(\mathrm{K}\) o, en las relaciones de entropía |
\[ \begin{aligned} \Delta s &= s_{2}-s_{1} \\ &= c_{P} \ln \left(T_{2}-T_{1}\right) - R \ln \left(P_{2}-P_{1}\right) \\ &= c_{v} \ln \left(T_{2}-T_{1}\right) + R \ln \left(\upsilon_{2}-\upsilon_{1}\right) \end{aligned} \nonumber \] | \[ \begin{aligned} \Delta s &= s_{2}-s_{1} \\ &= c \ln \left(T_{2}-T_{1}\right) \end{aligned} \nonumber \] |
| Gases (at\(25 ^{\circ} \mathrm{C}\) y\(1 \mathrm{~atm}\)) | ||||||||
|---|---|---|---|---|---|---|---|---|
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\)) ">Sustancia | Masa molar | \(\dfrac{R}{\left[ \dfrac{\mathrm{kJ}}{\mathrm{kg} \cdot \mathrm{K}}\right]}\) | \(\dfrac{c_{v}}{\left[ \dfrac{\mathrm{kJ}}{\mathrm{kg} \cdot \mathrm{K}}\right]}\) | \(\dfrac{c_{P}}{\left[ \dfrac{\mathrm{kJ}}{\mathrm{kg} \cdot \mathrm{K}}\right]}\) | \(k\) | \(\dfrac{T_{c}}{\mathrm{K}}\) | \(\dfrac{P_{c}}{\mathrm{bar}}\) | |
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Acetileno | \(\mathrm{C}_2 \mathrm{H}_2\) | \(26.04\) | \(0.3193\) | \(1.37\) | \(1.69\) | \(1.23\) | \(309\) | \(62.4\) |
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Aire | — | \(28.97\) | \(0.2870\) | \(0.718\) | \(1.005\) | \(1.40\) | \(133\) | \(37.7\) |
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Amoniaco | \(\mathrm{NH}_3\) | \(17.04\) | \(0.4879\) | \(1.66\) | \(2.15\) | \(1.30\) | \(406\) | \(112.8\) |
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Dióxido de carbono | \(\mathrm{CO}_2\) | \(44.01\) | \(0.1889\) | \(0.657\) | \(0.846\) | \(1.29\) | \(304.2\) | \(73.9\) |
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Monóxido de carbono | \(\mathrm{CO}\) | \(28.01\) | \(0.2968\) | \(0.744\) | \(1.04\) | \(1.40\) | \(133\) | \(35.0\) |
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Etano | \(\mathrm{C}_2 \mathrm{H}_6\) | \(30.07\) | \(0.2765\) | \(1.48\) | \(1.75\) | \(1.18\) | \(305.4\) | \(48.8\) |
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Etileno | \(\mathrm{C}_2 \mathrm{H}_4\) | \(28.05\) | \(0.2964\) | \(1.23\) | \(1.53\) | \(1.24\) | \(283\) | \(51.2\) |
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Helio | \(\mathrm{He}\) | \(4.003\) | \(2.077\) | \(3.12\) | \(5.19\) | \(1.67\) | \(5.2\) | \(2.3\) |
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Hidrógeno | \(\mathrm{H}_2\) | \(2.016\) | \(4.124\) | \(10.2\) | \(14.3\) | \(1.40\) | \(33.2\) | \(13.0\) |
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Metano | \(\mathrm{CH}_4\) | \(16.04\) | \(0.5183\) | \(1.70\) | \(2.22\) | \(1.31\) | \(190.7\) | \(46.4\) |
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Nitrógeno | \(\mathrm{N}_2\) | \(28.01\) | \(0.2968\) | \(0.743\) | \(1.04\) | \(1.40\) | \(126.2\) | \(33.9\) |
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Oxígeno | \(\mathrm{O}_2\) | \(32.00\) | \(0.2598\) | \(0.658\) | \(0.918\) | \(1.40\) | \(154.4\) | \(50.5\) |
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Propano | \(\mathrm{C}_3 \mathrm{H}_8\) | \(44.09\) | \(0.1886\) | \(1.48\) | \(1.67\) | \(1.13\) | \(370\) | \(42.5\) |
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Refrigerante 134a | \(\mathrm{C}_2 \mathrm{F}_4 \mathrm{H}_2\) | \(102.03\) | \(0.08149\) | \(0.76\) | \(0.85\) | \(1.12\) | \(374.3\) | \(40.6\) |
| \ (25 ^ {\ circ}\ mathrm {C}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Agua (Vapor) | \(\mathrm{H}_2 \mathrm{O}\) | \(18.02\) | \(0.4614\) | \(1.40\) | \(1.86\) | \(1.33\) | \(647.3\) | \(220.9\) |
| Líquidos | Sólidos * | |||||
|---|---|---|---|---|---|---|
| Sustancia | Temp\(({ }^{\circ} \mathrm{C})\) | \( \dfrac{\rho}{\left[ \dfrac{\mathrm{kg}}{\mathrm{m}^3}\right]} \) | \(\dfrac{c_{P}}{\left[ \dfrac{\mathrm{kJ}}{\mathrm{kg} \cdot \mathrm{K}}\right]}\) | Sustancia | \( \dfrac{\rho}{\left[ \dfrac{\mathrm{kg}}{\mathrm{m}^3}\right]} \) | \(\dfrac{c_{P}}{\left[ \dfrac{\mathrm{kJ}}{\mathrm{kg} \cdot \mathrm{K}}\right]}\) |
| Amoníaco | \(25\) | \(602\) | \(4.80\) | Aluminio | \(2,700\) | \(0.902\) |
| Benceno | \(20\) | \(879\) | \(1.72\) | Latón, amarillo | \(8,310\) | \(0.400\) |
| Salmuera\(( 20 / % \mathrm{NaCl})\) | \(20\) | \(1,150\) | \(3.11\) | Ladrillo (común) | \(1,922\) | \(0.79\) |
| Etanol | \(25\) | \(783\) | \(2.46\) | Concreto | \(2,300\) | \(0.653\) |
| Alcohol etílico | \(20\) | \(789\) | \(2.84\) | Cobre | \(8,900\) | \(0.386\) |
| Etilenglicol | \(20\) | \(1,109\) | \(2.84\) | Vidrio, ventana | \(2,700\) | \(0.800\) |
| Queroseno | \(20\) | \(820\) | \(2.00\) | Hierro | \(7,840\) | \(0.45\) |
| Mercurio | \(25\) | \(13,560\) | \(0.139\) | Plomo | \(11,310\) | \(0.128\) |
| Aceite (ligero) | \(25\) | \(910\) | \(1.80\) | Plata | \(10,470\) | \(0.235\) |
| Refrigerante 134a | \(25\) | \(1,206\) | \(1.42\) | Acero (suave) | \(7,830\) | \(0.500\) |
| Agua | \(25\) | \(997\) | \(4.18\) | * Evaluado a temperatura ambiente. | ||
| Valores adaptados de K. Work, Jr. y D. E. Richards, Termodinámica, 6a ed. (McGraw-Hill, Nueva York, 1999) e Y. A. Cengul y M. A. Boles, Termodinámica, 4ta ed. (McGraw-Hill, Nueva York, 2002). | ||||||
| Gases (at\(77 ^{\circ} \mathrm{F}\) y\(1 \mathrm{~atm}\)) | ||||||||
|---|---|---|---|---|---|---|---|---|
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\)) ">Sustancia | Masa molar | \(\dfrac{R}{\left[ \dfrac{\mathrm{ft} \cdot \mathrm{lbf}}{\mathrm{lbm} \cdot { }^{\circ} \mathrm{R}}\right]}\) | \(\dfrac{c_{v}}{\left[ \dfrac{\mathrm{Btu}}{\mathrm{lbm} \cdot { }^{\circ} \mathrm{R}}\right]}\) | \(\dfrac{c_{P}}{\left[ \dfrac{\mathrm{Btu}}{\mathrm{lbm} \cdot { }^{\circ} \mathrm{R}}\right]}\) | \(k\) | \(\dfrac{T_{c}}{ \text{}^{\circ} \mathrm{R}}\) | \(\dfrac{P_{c}}{\mathrm{atm}}\) | |
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Acetileno | \(\mathrm{C}_2 \mathrm{H}_2\) | \(26.04\) | \(59.33\) | \(0.328\) | \(0.404\) | \(1.23\) | \(556\) | \(61.6\) |
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Aire | — | \(28.97\) | \(59.33\) | \(0.171\) | \(0.240\) | \(1.40\) | \(239\) | \(37.2\) |
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Amoniaco | \(\mathrm{NH}_3\) | \(17.04\) | \(90.67\) | \(0.397\) | \(0.514\) | \(1.30\) | \(730\) | \(111.3\) |
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Dióxido de carbono | \(\mathrm{CO}_2\) | \(44.01\) | \(35.11\) | \(0.156\) | \(0.202\) | \(1.29\) | \(548\) | \(72.9\) |
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Monóxido de carbono | \(\mathrm{CO}\) | \(28.01\) | \(55.16\) | \(0.178\) | \(0.249\) | \(1.40\) | \(239\) | \(34.5\) |
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Etano | \(\mathrm{C}_2 \mathrm{H}_6\) | \(30.07\) | \(51.38\) | \(0.353\) | \(0.419\) | \(1.19\) | \(549\) | \(48.2\) |
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Etileno | \(\mathrm{C}_2 \mathrm{H}_4\) | \(28.05\) | \(55.08\) | \(0.294\) | \(0.365\) | \(1.24\) | \(510\) | \(50.5\) |
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Helio | \(\mathrm{He}\) | \(4.003\) | \(386.0\) | \(0.744\) | \(1.24\) | \(1.67\) | \(9.3\) | \(2.26\) |
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Hidrógeno | \(\mathrm{H}_2\) | \(2.016\) | \(766.4\) | \(2.43\) | \(3.42\) | \(1.40\) | \(59.8\) | \(12.8\) |
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Metano | \(\mathrm{CH}_4\) | \(16.04\) | \(96.32\) | \(0.407\) | \(0.531\) | \(1.30\) | \(344\) | \(45.8\) |
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Nitrógeno | \(\mathrm{N}_2\) | \(28.01\) | \(55.16\) | \(0.178\) | \(0.248\) | \(1.39\) | \(227\) | \(33.5\) |
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Oxígeno | \(\mathrm{O}_2\) | \(32.00\) | \(48.28\) | \(0.157\) | \(0.219\) | \(1.40\) | \(278\) | \(49.8\) |
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Propano | \(\mathrm{C}_3 \mathrm{H}_8\) | \(44.09\) | \(35.04\) | \(0.355\) | \(0.400\) | \(1.13\) | \(666\) | \(42.1\) |
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Refrigerante 134a | \(\mathrm{C}_2 \mathrm{F}_4 \mathrm{H}_2\) | \(102.03\) | \(15.14\) | \(0.184\) | \(0.203\) | \(1.10\) | \(672.8\) | \(40.1\) |
| \ (77 ^ {\ circ}\ mathrm {F}\) y\(1 \mathrm{~atm}\))” class="LT-ENG-81508">Agua (Vapor) | \(\mathrm{H}_2 \mathrm{O}\) | \(18.02\) | \(87.74\) | \(0.335\) | \(0.445\) | \(1.33\) | \(1165\) | \(218.0\) |
| Líquidos | Sólidos * | |||||
|---|---|---|---|---|---|---|
| Sustancia | Temp\(({ }^{\circ} \mathrm{F})\) | \( \dfrac{\rho}{\left[ \dfrac{\mathrm{lbm}}{\mathrm{ft}^3}\right]} \) | \(\dfrac{c_{P}}{\left[ \dfrac{\mathrm{Btu}}{\mathrm{lbm} \cdot { }^{\circ} \mathrm{R}}\right]}\) | Sustancia | \( \dfrac{\rho}{\left[ \dfrac{\mathrm{lbm}}{\mathrm{ft}^3}\right]} \) | \(\dfrac{c_{P}}{\left[ \dfrac{\mathrm{Btu}}{\mathrm{lbm} \cdot { }^{\circ} \mathrm{R}}\right]}\) |
| Amoníaco | \(80\) | \(37.5\) | \(1.135\) | Aluminio | \(170\) | \(0.215\) |
| Benceno | \(68\) | \(54.9\) | \(0.411\) | Latón, amarillo | \(519\) | \(0.0955\) |
| Salmuera\(( 20 / % \mathrm{NaCl})\) | \(68\) | \(71.8\) | \(0.743\) | Ladrillo (común) | \(120\) | \(0.189\) |
| Etanol | \(77\) | \(48.9\) | \(0.588\) | Concreto | \(144\) | \(0.156\) |
| Alcohol etílico | \(68\) | \(49.3\) | \(0.678\) | Cobre | \(555\) | \(0.0917\) |
| Etilenglicol | \(68\) | \(69.2\) | \(0.678\) | Vidrio, ventana | \(169\) | \(0.191\) |
| Queroseno | \(68\) | \(51.2\) | \(0.478\) | Hierro | \ (490) | \(0.107\) |
| Mercurio | \(77\) | \(847\) | \(0.033\) | Plomo | \(705\) | \(0.030\) |
| Aceite (ligero) | \(77\) | \(56.8\) | \(0.430\) | Plata | \(655\) | \(0.056\) |
| Refrigerante 134a | \(32\) | \(80.9\) | \(0.318\) | Acero (suave) | \(489\) | \(0.119\) |
| Agua | \(68\) | \(62.2\) | \(1.00\) | * Evaluado a temperatura ambiente. | ||
| Valores adaptados de K. Work, Jr. y D. E. Richards, Termodinámica, 6a ed. (McGraw-Hill, Nueva York, 1999) e Y. A. Cengul y M. A. Boles, Termodinámica, 4ta ed. (McGraw-Hill, Nueva York, 2002). | ||||||
Un tanque rígido contiene\(0.80 \mathrm{~g}\) aire inicialmente en\(295 \mathrm{~K}\) y\(1.5 \mathrm{~bars}\) y un cable de resistencia eléctrica. La resistencia eléctrica dentro del tanque tiene una masa de\(0.05 \mathrm{~g}\) y se energiza pasando una corriente de\(0.6 \mathrm{~A}\) for\(30 \mathrm{~s}\) desde una\(12.0 \mathrm{V}\) fuente. Durante el mismo intervalo de tiempo,\(156 \mathrm{~J}\) de energía se pierde a través de las paredes del tanque por transferencia de calor. Supongamos que el aire se puede modelar como un gas ideal con calores específicos a temperatura ambiente y que el alambre de resistencia de acero dulce se puede modelar como una sustancia incompresible con calores específicos a temperatura ambiente.
Determinar (a) la temperatura final del gas, en kelvin, y (b) la presión final del gas, en bares.
Solución
Conocido: Se utiliza una resistencia eléctrica para calentar el aire contenido en un tanque rígido.
Encuentra: (a) La temperatura final del gas, en\(\mathrm{K}\).
b) La presión final del gas, en bares.
Dado:
.png)
Figura\(\PageIndex{1}\): Un cable eléctrico pasa a un contenedor rígido de aire, que contiene una resistencia.
Análisis:
Estrategia\(\rightarrow\) Porque estamos tratando con transferencia de calor y trabajo eléctrico y se nos pide encontrar la temperatura final, usar conservación de energía. (Las preguntas que involucran cambios en la presión y temperatura de una sustancia frecuentemente requieren el uso de la conservación de energía y alguna ecuación de estado para describir cómo se relacionan las propiedades termofísicas de la sustancia).
Sistema\(\rightarrow\) Debido a que nos hablaron de la transferencia de calor del gas al tanque, tratemos todo dentro del tanque, gas y resistencia, como un sistema cerrado. (Ver línea discontinua dibujada en la figura anterior.)
Propiedad a contar\(\rightarrow\) Queremos saber la temperatura pero la energía es la propiedad para la que tenemos un principio de conservación y sabemos que la energía y la temperatura están relacionadas, así que vamos a contar la energía.
Intervalo de tiempo Forma\(\rightarrow\) de tiempo finito ya que nos dan el intervalo de tiempo de 30 segundos.
Debido a que es posible que no recordemos el formulario de tiempo finito para un sistema cerrado, volvamos a desarrollarlo rápidamente:\[\begin{aligned} &\frac{d E_{\text{sys}}}{dt} = \dot{Q}_{\text{net, in}} + \dot{W}_{\text{net, in}} + \underbrace{ \cancel{\sum_{\text{in}} \dot{m}_{i} \left(h_{i}+\frac{V_{i}^{2}}{2}+g z\right) - \sum_{\text{out}} \dot{m}_{e} \left(h_{e}+\frac{V_{e}^{2}}{2}+g z\right)}^{=0} }_{\text {Closed system}} \\ & \int\limits_{t_{1}}^{t_{2}} \left(\frac{d E_{\text{sys}}}{dt}\right) dt = \int\limits_{t_{1}}^{t_{2}} \left(\dot{Q}_{\text {net, in}} + \dot{W}_{\text {net, in}}\right) dt \quad \rightarrow \quad \boxed{\Delta E_{\text{sys}} = Q_{\text {net, in}} + W_{\text {net, in}}} \end{aligned} \nonumber \]
Ahora que tenemos la forma correcta del balance energético, necesitamos evaluar los diversos términos de la siguiente manera:\[\underbrace{ \cancel{\Delta E_{\text{sys}}}^{= \Delta U_{\text{sys}}} }_{\begin{array}{c} \text{No changes in kinetic} \\ \text{and gravitational \\ \text{potential energy} \end{array}} = \underbrace{ \cancel{Q_{\text {net, in}}}^{=-Q_{\text {out}}} }_{\begin{array}{c} \text{Use given information} \\ \text{about heat transfer out} \\ \text{of the system} \end{array}} +\underbrace{ \cancel{W_{\text {net, in}}}^{=W_{\text {electric, in}}} }_{\begin{array}{c} \text{Only one type of work} \\ \text{because the system} \\ \text{is contained in a rigid tank.} \end{array}} \quad\quad \rightarrow \quad\quad \Delta U_{\text {sys}} = -Q_{\text {out}} + W_{\text {electric, in}} \nonumber \]
Primero, examinemos el cambio en la energía interna del sistema. Debemos reconocer que el cambio en la energía interna para todo el sistema puede calcularse como la suma del cambio en la energía interna para cada uno de sus subsistemas. (Recordemos que esta es una característica clave de una propiedad extensa como la energía). \[\Delta U_{\text{sys}} = \Delta U_{\text{gas}} + \Delta U_{\text{resistor}} = m_{\text{gas}} \Delta u_{\text{gas}} + m_{\text{resistor}} \Delta u_{\text{resistor}} \nonumber \]
\[ \begin{aligned} &\text{but } \quad &\Delta u_{\text{gas}} = c_{v, \text { gas}} \left(T_{2}-T_{1}\right)_{\text {gas}} \quad\quad &| \text{ Ideal gas with room temperature specific heats} \\ &\text{and } \quad &\Delta u_{\text{resistor}} = c_{\text{resistor}} \left(T_{2}-T_{1}\right)_{\text{resistor}} \quad &| \text{ Incomp. substance with room temperature specific heats} \end{aligned} \nonumber \]
\[ \text{So,} \quad\quad \Delta U_{\text{sys}} = \left[m c_{v} \left(T_{2}-T_{1}\right)\right]_{\text{gas}} + \left[m c \left(T_{2}-T_{1}\right)\right]_{\text{resistor}} \nonumber \]
Segundo, debemos evaluar el trabajo eléctrico. Podemos recuperar la ecuación necesaria a partir de la definición de energía eléctrica:\[\begin{aligned} W_{\text {electric, in}} &= \int\limits_{t_{1}}^{t_{2}} \dot{W}_{\text {electric, in}} \ dt = \int\limits_{t_{1}}^{t_{2}}(i \Delta V) dt = (i \Delta V) \int\limits_{t_{1}}^{t_{2}} dt = (i \Delta V) \Delta t \\ &= (0.60 \mathrm{~A}) \cdot (12.0 \mathrm{~V}) \cdot (30 \mathrm{~s}) = 216 \mathrm{~W} \cdot \mathrm{s} = 216 \mathrm{~J} \end{aligned} \nonumber \] Combinando toda esta información tenemos el siguiente resultado:\[\Delta U_{\text{sys}} = -Q_{\text {out}} + W_{\text {electric, in}} \quad \rightarrow \quad \left[m c_{v}\left(T_{2}-T_{1}\right)\right]_{\text{gas}} + \left[m c \left(T_{2}-T_{1}\right)\right]_{\text{resistor}} = [-156+216] \mathrm{~J} \nonumber \]
Antes de que podamos resolver por las temperaturas, debemos hacer una suposición sobre las temperaturas del gas y la resistencia. Parecería razonable que la resistencia y el gas tengan las mismas temperaturas si el sistema está en equilibrio térmico al principio y al final. Además, también debemos encontrar valores de temperatura ambiente para los calores específicos consultando las tablas apropiadas:\(c_{v}, \text{ gas} = 0.718 \mathrm{~kJ} /(\mathrm{kg} \cdot\mathrm{K})\) y\(c_{\text {resistor}} = 0.500 \mathrm{~kJ} /(\mathrm{kg} \cdot \mathrm{K})\).
Usando esto en el balance energético ahora podemos resolver para la temperatura final de la siguiente manera:\[\begin{gathered} {\left[mc_{v} \left(T_{2}-T_{1}\right)\right]_{\text{gas}} + \left[m c\left(T_{2}-T_{1}\right)\right]_{\text{resistor}} = [-156+216] \mathrm{~J}} \\[4pt] \left(m_{\text {gas }} c_{v, \text { gas}} + m_{\text {resistor }} c_{\text {resistor}}\right)\left(T_{2}-T_{1}\right) = 60 \mathrm{~J} \quad \rightarrow \quad \mathrm{T}_{2}-T_{1} = \frac{60 \mathrm{~J}}{\left(m_{\text {gas }} c_{v, \text { gas}} + m_{\text {resistor }} c_{\text {resistor}}\right)} \\[4pt] T_{2}-T_{1}=\frac{60 \mathrm{~J}}{\left[(0.80 \mathrm{~g}) \cdot \left(0.718 \ \dfrac{\mathrm{J}}{\mathrm{g} \cdot \mathrm{K}}\right) + (0.05 \mathrm{~g}) \cdot \left(0.500 \ \dfrac{\mathrm{J}}{\mathrm{g} \cdot \mathrm{K}}\right)\right]} = \frac{60 \mathrm{~J}}{\left[(0.574+0.025) \ \dfrac{\mathrm{J}}{\mathrm{K}}\right]} = 100 \mathrm{~K} \\[4pt] T_{2}=T_{1}+100 \mathrm{~K} = 295 \mathrm{~K} + 100 \mathrm{~K} = 395 \mathrm{~K} \end{gathered} \nonumber \]
La resolución de la presión final se realiza aplicando la ecuación de gas ideal de la siguiente manera:\[\begin{gathered} \left.\begin{array}{l} P_{1} V\kern-1.0em\raise0.3ex-_{1} = m_{1} R_{\text {air }} T_{1} \\ P_{2} V\kern-1.0em\raise0.3ex-_{2} = m_{2} R_{\text {air }} T_{2} \end{array}\right\} \quad\rightarrow\quad \frac{P_{1} V\kern-0.8em\raise0.3ex-_{1}}{P_{2} V\kern-0.8em\raise0.3ex-_{2}} = \frac{m_{1} R_{\text {air }} T_{1}}{m_{2} R_{\text {air }} T_{2}} \quad\rightarrow\quad \left(\frac{P_{1}}{P_{2}}\right) \cancel{\left(\frac{V\kern-0.8em\raise0.3ex-_{1}}{V\kern-0.8em\raise0.3ex-_{2}}\right)}^{=1} = \cancel{\left(\frac{m_{1}}{m_{2}}\right)}^{=1} \cdot \cancel{\left(\frac{R_{\text{air}}}{R_{\text {air}}}\right)}^{=1} \cdot \left(\frac{T_{1}}{T_{2}}\right) \\{4pt} P_{2} = P_{1}\left(\frac{T_{2}}{T_{1}}\right) = (1.5 \text { bars})\left(\frac{395 \mathrm{~K}}{295 \mathrm{~K}}\right) = 2.01 \text { bars} \end{gathered} \nonumber \]
Comentario:
(1) Al aplicar el balance energético, pasamos de\(\Delta U\) a\(m \Delta u\). Esto es necesario porque nuestros modelos de sustancias solo nos permiten calcular el cambio en la energía interna específica:\(\Delta u\), no\(\Delta U\). Además, así es como la temperatura entra en la imagen.
(2) Al aplicar la ecuación de gas ideal para encontrar la presión, observe cómo hicimos uso de las relaciones. Esto simplifica enormemente los cálculos y nos permite manejar fácilmente diferentes unidades. En lugar de resolver simbólicamente y reconocer las relaciones, la presión final podría haberse obtenido de la siguiente manera:
Paso 1: Resolver\(V\kern-1.0em\raise0.3ex-_{1} \quad V\kern-1.0em\raise0.3ex-_{1} = \dfrac{m_{1} R_{\text {air }} T_{1}}{P_{1}}\)
Paso 2: Reconocer eso\(V\kern-1.0em\raise0.3ex-_{2} = V\kern-0.8em\raise0.3ex-_{1}\) y aquello\(m_{2}=m_{1}\)
Paso 3: Resolver para\(P_{2} \quad P_{2}=\dfrac{m_{2} R_{\text {air }} T_{2}}{V_{2}} = \dfrac{m_{1} R_{\text {air }} T_{2}}{V_{1}}\)
Las relaciones pueden acelerar y simplificar los cálculos en gran medida. Además, reduce los errores, por ejemplo, evitando la necesidad de encontrar\(R_{\mathrm{gas}}\) en unidades que funcionen con barras más el número extra de punzonado en su calculadora.
(3) Si no hubiéramos hecho la suposición de que la resistencia y el gas tenían temperaturas iguales, hubiera sido imposible resolver el problema sin suposiciones o información adicionales.
(4) ¿Qué interacciones de transferencia de calor y trabajo ocurrieron entre la resistencia y su entorno durante este proceso? ¿Entre el gas y sus alrededores?
Se utiliza una bomba para mover queroseno entre dos puntos en un sistema de tuberías. La bomba se encuentra entre los dos puntos. El queroseno ingresa al sistema de tuberías a una elevación de\(5 \mathrm{~ft}\), una presión\(15 \mathrm{~psia}\) y una temperatura de\(70^{\circ} \mathrm{F}\) y sale del sistema de tuberías a una elevación\(20 \mathrm{~ft}\) y una presión de\(60 \mathrm{~psia}\). Durante el proceso de bombeo adiabático, el queroseno experimenta un\(0.5^{\circ} \mathrm{F}\) aumento de temperatura. Determine la potencia requerida para operar la bomba\(\mathrm{ft} \cdot \mathrm{lbf} / \mathrm{lbm}\).

Figura\(\PageIndex{2}\): El queroseno se bombea a mayor elevación.
Solución
Conocido: El queroseno se bombea constantemente en un sistema de tuberías
Encuentra: La potencia requerida para operar la bomba en\(\mathrm{ft} \cdot \mathrm{lbf} / \mathrm{lbm}\).
Dado:
Queroseno Estado 1:\(z_{1}=5 \mathrm{ft}; \ P_{1}=15 \mathrm{~psia} ; \ T_{1}=70^{\circ} \mathrm{F}\)
Queroseno Estado 2:\(z_{2}=20 \mathrm{ft}; \ P_{2}=60 \mathrm{~psia}\)
Proceso 1-2: Adiabático, estado estacionario
\(T_{2}-T_{1}=0.5^{\circ} \mathrm{F}\)
Análisis:
Estrategia\(\rightarrow\) Usar conservación de energía
Sistema Sistema abierto\(\rightarrow\) no deformante que incluye tubería, bomba y contenido.
Propiedad\(\rightarrow\) Energía (y posiblemente masa) Intervalo de
tiempo\(\rightarrow\) Desde estado estacionario, periodo de tiempo infinitesimal.
Escribir el balance energético para el sistema abierto da lo siguiente:\[ \begin{aligned} \underbrace{ \cancel{\frac{d E_{\text{sys}}}{dt}}^{=0} }_{\begin{array}{c} \text{Steady-state} \\ \text{conditions} \end{array}} = \underbrace{ \cancel{\dot{Q}_{\text{net, in}}}^{=0} }_{\text{Adiabatic}} + \dot{W}_{\text{net, in}} + \dot{m}_{1} \left(h_{1} \frac{V_{1} { }^{2}}{2} + gz_{1}\right) - \dot{m}_{2} \left(h_{2} \frac{V_{2} { }^{2}}{2} + gz_{2}\right) \\ 0 &= \dot{W}_{\text{pump, in}} \dot{m}_{1} \left(h_{1} \frac{V_{1} { }^{2}}{2} + gz_{1}\right) - \dot{m}_{2} \left(h_{2} \frac{V_{2} { }^{2}}{2} + gz_{2}\right) \end{aligned} \nonumber \]
Para ir más allá hay que decir algo sobre los caudales másicos. Si aplicamos la conservación de la masa a este sistema de estado estacionario, de una entrada/una salida, encontramos que los caudales másicos son iguales. Usando este resultado, la ecuación anterior se convierte en:\[\frac{\dot{W}_{\text {pump, in}}}{\dot{m}} = \left(h_{2}-h_{1}\right) + \left(\frac{V_{2}{ }^{2}}{2}-\frac{V_{1}{ }^{2}}{2}\right) + g\left(z_{2}-z_{1}\right) \nonumber \] El término del lado izquierdo es la cantidad que estamos buscando. Es la potencia por unidad de flujo másico o el trabajo por unidad de masa. (Como se indicó anteriormente, es muy común resolver problemas de sistema abierto sobre una base por unidad-masa. Entonces si solo cambiamos el caudal másico no tenemos que resolver el problema, a menos que cambie algo más.)
El cambio en la entalpía específica puede manejarse asumiendo que el queroseno puede modelarse como una sustancia incompresible con calores específicos a temperatura ambiente; así,\[h_{2}-h_{1} = u_{2}-u_{1} + \upsilon\left(P_{2}-P_{1}\right) = c\left(T_{2}-T_{1}\right) + \upsilon\left(P_{2}-P_{1}\right) \nonumber \] dónde\(c=0.478 \mathrm{~Btu} / \left(\mathrm{lbm}{ }^{\circ} \mathrm{R}\right)\) y\(\upsilon = 1 / \rho=1 /\left(51.2 \mathrm{~lbm} / \mathrm{ft}^{3}\right)\)
No tenemos información sobre la velocidad del queroseno ni en la entrada ni en la salida. Sin hacer alguna suposición sobre las velocidades no podemos resolver para el poder. No necesitamos asumir valores absolutos para la velocidad, sino solo que su cambio, en realidad, el cambio en la energía cinética, es insignificante.
Usando estos resultados ahora podemos resolver para el poder:\[\begin{aligned} \frac{\dot{W}_{\text {pump, in}}}{\dot{m}} &= \left(h_{2}-h_{1}\right) + \underbrace{ \cancel{\left{\frac{V_{2}{ }^{2}}{2} - \frac{V_{1}{ }^{2}}{2}\right)}^{=0} }_{\begin{array}{c} \text{Assume change is} \\ \text{negligible} \end{array}} + g\left(z_{2}-z_{1}\right) \\ &=c\left(T_{2}-T_{1}\right)+v\left(P_{2}-P_{1}\right)+g\left(z_{2}-z_{1}\right)=c\left(T_{2}-T_{1}\right)+\frac{\left(P_{2}-P_{1}\right)}{\rho}+g\left(z_{2}-z_{1}\right) \end{aligned} \nonumber \]
Ahora resolvemos para los términos individuales en el balance energético de la siguiente manera:\[c\left(T_{2}-T_{1}\right) = \left(0.478 \ \frac{\mathrm{Btu}}{\mathrm{lbm} \cdot{ }^{\circ} \mathrm{R}}\right) \left(0.5^{\circ} \mathrm{F}\right) = 0.239 \ \frac{\mathrm{Btu}}{\mathrm{lbm}} = \left(0.239 \ \frac{\mathrm{Btu}}{\mathrm{lbm}}\right) \times \left(778 \ \frac{\mathrm{ft} \cdot \mathrm{lbf}}{\mathrm{Btu}}\right) = 185.9 \ \frac{\mathrm{ft} \cdot \mathrm{lbf}}{\mathrm{lbm}} \nonumber \]
donde reconocemos el\({ }^{\circ} \mathrm{R}\) y el\({ }^{\circ} \mathrm{F}\) cancelar, porque ambos representan diferencias de temperatura y no temperaturas:\[\begin{aligned} &\frac{\left(P_{2}-P_{1}\right)}{\rho} = \frac{(60-15) \mathrm{~psia}}{51.2 \ \dfrac{\mathrm{lbm}}{\mathrm{ft}^{3}}} = 0.8789 \ \frac{\mathrm{psia} \cdot \mathrm{ft}^{3}}{\mathrm{lbm}} = \left(0.8789 \ \frac{\mathrm{psia} \cdot \mathrm{ft}^{3}}{\mathrm{lbm}}\right) \times \left(\frac{\mathrm{lbf} / \mathrm{in}^{2}}{\mathrm{psia}}\right) \times \left(\frac{144 \mathrm{~in}^{2}}{1 \mathrm{~ft}^{2}}\right) = 126.6 \ \frac{\mathrm{ft} \cdot \mathrm{lbf}}{\mathrm{lbm}} \\ { } \\ & g\left(z_{2}-z_{1}\right) = \left(32.174 \ \frac{\mathrm{ft}}{\mathrm{s}^{2}}\right) \cdot [(20-5) \mathrm{~ft}] = 482.6 \ \frac{\mathrm{ft}^{2}}{\mathrm{~s}^{2}} = \left(482.6 \ \frac{\mathrm{ft}^{2}}{\mathrm{~s}^{2}}\right) \times \left(\frac{\mathrm{lbm}}{\mathrm{lbm}}\right) \times \left(\frac{1 \mathrm{~lbf}}{32.174 \ \dfrac{\mathrm{lbm} \cdot \mathrm{ft}}{\mathrm{s}^{2}}}\right) = 15.0 \ \frac{\mathrm{ft} \cdot \mathrm{lbf}}{\mathrm{lbm}} \end{aligned} \nonumber \]
Combinar estos resultados dan\[\frac{\dot{W}_{\text {pump, in}}}{\dot{m}} = \underbrace{c\left(T_{2}-T_{1}\right)}_{=57 \%} + \underbrace{\frac{1}{\rho}\left(P_{2}-P_{1}\right)}_{=39 \%} + \underbrace{g\left(z_{2}-z_{1}\right)}_{=4 \%} = (185.9+126.6+15.0) \ \frac{\mathrm{ft} \cdot \mathrm{lbf}}{\mathrm{lbm}} = 328 \ \frac{\mathrm{ft} \cdot \mathrm{lbf}}{\mathrm{lbm}} \nonumber \]
Comentarios:
(1) Obsérvese cómo se descompone el poder. Suponiendo que aumentar la presión y la elevación son los efectos deseados para una bomba, aproximadamente\(57 \%\) de la energía se “desperdicia” en el cambio de\(0.5^{\circ} \mathrm{F}\) temperatura en el líquido. ¿Cuál sería el poder si el proceso hubiera sido isotérmico?
(2) ¿Y si el único cambio en el problema hubiera sido que la temperatura del queroseno disminuyera en\(0.5^{\circ} \mathrm{F}\)? ¿Cuál habría sido la entrada de energía?
[Esto es bastante impresionante. Primero, enganchas una pipa a un poco de queroseno en condiciones de habitación. Entonces aumenta la elevación y presión del queroseno, “enfría” el queroseno en un proceso adiabático, y te da algo de salida de energía. Probablemente podría hacer que el queroseno elevado de alta presión fluya a través de una turbina hidráulica y haga aún más ejercicio. Por muy atractivo que esto pueda ser, ¡pronto descubriremos que sería imposible! Si encuentra una manera de hacer esto, por favor no se lo diga a nadie más que contacte a su instructor y ¡ambos podrán retirarse a las Bahamas!]
(3) Ahora bien, si la bomba hubiera sido realmente un compresor y en vez de queroseno estábamos comprimiendo aire, ¿cuál habría sido la potencia? (Supongamos que los cambios en la energía cinética son insignificantes.) ¿La presión incluso encaja en tus cálculos? [Respuesta:\(108 \mathrm{~ft} \cdot \mathrm{lbf} / \mathrm{lbm}\)]
[En breve descubriremos que este proceso también es imposible. Bajo las condiciones más ideales, la temperatura del aire aumentaría aproximadamente\(258^{\circ} \mathrm{F}\) si se comprimiera adiabáticamente entre el estado de entrada dado y la presión final.]
El tanque A contiene\(1.0 \mathrm{~kg}\)\(\left(\mathrm{N}_{2}\right)\) gas nitrógeno inicialmente en\(150 \mathrm{~kPa}\) y\(300 \mathrm{~K}\). Unido a este tanque a través de una válvula adecuada se encuentra un segundo tanque B que contiene\(2.0 \mathrm{~kg}\) del mismo gas en\(300 \mathrm{~kPa}\) y\(400 \mathrm{~K}\). Ambos tanques son rígidos y aislados. Supongamos que el gas nitrógeno se puede modelar como un gas ideal con calores específicos a temperatura ambiente.
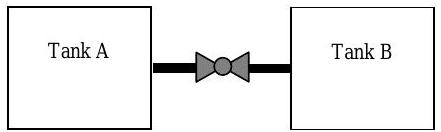
Figura\(\PageIndex{3}\): Configuración de dos tanques conectados.
Si se abre la válvula y se alcanza el equilibrio, determine
(a) la temperatura final de la mezcla, en\(\mathrm{K}\), y
(b) la presión final de la mezcla, en\(\mathrm{kPa}\).
Solución
Conocido: Se mezclan los contenidos de dos tanques que contienen nitrógeno cada uno.
Encontrar: (a) temperatura final de la mezcla, en\(\mathrm{K}\), y (b) presión final de la mezcla en\(\mathrm{kPa}\).
Dado:
| Estado Inicial (1) | Estado Final (2) | |||
|---|---|---|---|---|
| Tanque A | Tanque B | Tanque A | Tanque B | |
| \[\begin{gathered} 1.0 \mathrm{~kg} \\ 150 \mathrm{~kPa} \\ 300 \mathrm{~K} \end{gathered} \nonumber \] | \[\begin{gathered} 2.0 \mathrm{~kg} \\ 300 \mathrm{~kPa} \\ 400 \mathrm{~K} \end{gathered} \nonumber \] | \(T_{2} \text{ and } P_{2}\) | \(T_{2} \text{ and } P_{2}\) | |
Análisis:
Estrategia\(\rightarrow\) Conservación de energía
Sistema\(\rightarrow\) Tratar el contenido de ambos tanques como un solo sistema cerrado.
Propiedad para contar\(\rightarrow\) Energía y masa Intervalo de
tiempo\(\rightarrow\) Tiempo finito desde la información inicial dada y la información final deseada.
Escribiendo la forma de tiempo finito de la conservación de energía para un sistema cerrado tenemos lo siguiente:\[ \underbrace{ \cancel{\Delta E_{\text{sys}}}^{=\Delta U_{\text{sys}}} }_{\begin{array}{c} \text{Changes in } E_{K} \text{ and} \\ E_{GP} \text{ are negligible} \end{array}} = \underbrace{ \cancel{Q_{\text{net, in}}}^{=0} }_{\begin{array}{c} \text{Tanks specified} \\ \text{as adiabatic} \end{array}} + \underbrace{ \cancel{W_{\text{net, in}}}^{=0} }_{\begin{array}{c} \text{Rigid tanks and no other} \\ \text{work interactions identified} \end{array}} \quad \rightarrow \quad \Delta U_{\text{sys}} = U_{\text{sys, } 2} - U_{\text{sys, } 1} = 0 \nonumber \]
Ahora para evaluar las energías internas del sistema cerrado da lo siguiente, asumiendo que el aire puede modelarse como un gas ideal con calores específicos a temperatura ambiente:
\[\begin{aligned} 0 &= U_{\text{sys,} 2}-U_{\text{sys,} 1} \\[4pt] &=\left(m_{\text{sys}} u\right)_{2} - \left(m_{A} u_{A}+m_{B} u_{B}\right)_{1} \quad \text { but } \quad m_{\text{sys}} = m_{A, 2}+m_{B, 2}=m_{A, 1}+m_{B, 1} \\[4pt] &= \left[\left(m_{A, 1}+m_{B, 1}\right) u_{2}\right]-\left[m_{A, 1} u_{A, 1}+m_{B, 1} u_{B, 1}\right] \\[4pt] &=m_{A, 1}\left(u_{2}-u_{A, 1}\right)+m_{B, 1}\left(u_{2}-u_{B, 1}\right) \quad\quad\quad \mid \text { collecting the } m_{A} \text { and } m_{B} \text { terms to get } \Delta u \\[4pt] &=m_{A, 1} c_{v}\left(T_{2}-T_{A, 1}\right)+m_{B, 1} c_{v}\left(T_{2}-T_{B, 1}\right) \quad\quad \mid \text { applying the ideal gas model } \end{aligned} \nonumber \]
Debido a que nuestro modelo de gas ideal asume que todos los calores específicos se evalúan a temperatura ambiente, son constantes y se cancelarán cuando resolvamos para la temperatura final:\[\begin{gathered} 0=m_{A, 1} c_{v} \left(T_{2}-T_{A, 1}\right) + m_{B, 1} c_{v}\left(T_{2}-T_{B, 1}\right) \quad \rightarrow \quad T_{2} = \frac{m_{A, 1} c_{v} T_{A, 1}+m_{B, 1} c_{v} T_{B, 1}}{m_{A, 1} c_{v}+m_{B, 1} c_{v}} = \frac{m_{A, 1} T_{A, 1}+m_{B, 1} T_{B, 1}}{m_{A, 1}+m_{B, 1}} \\[4pt] T_{2}=\frac{(1.0 \mathrm{~kg})(300 \mathrm{~K})+(2.0 \mathrm{~kg})(400 \mathrm{~K})}{(1.0+2.0) \mathrm{~kg}} = 367 \mathrm{~K} \end{gathered} \nonumber \]
Ahora para resolver la presión final, aplicamos el modelo de gas ideal:\[\begin{aligned} \left.\begin{array}{l} P_{2}=\dfrac{m_{2} R_{\text {air }} T_{2}}{V\kern-1.0em\raise0.3ex-_{2}} \\[4pt] V\kern-1.0em\raise0.3ex-_{2} = V\kern-1.0em\raise0.3ex-_{A}+V\kern-0.8em\raise0.3ex-_{B} \\[4pt] V\kern-1.0em\raise0.3ex-_{A}=\dfrac{m_{A, 1} R_{\text {air }} T_{A, 1}}{P_{A, 1}} \\[4pt] V\kern-1.0em\raise0.3ex-_{B}=\dfrac{m_{B, 1} R_{\text {air }} T_{B, 1}}{P_{B, 1}} \end{array}\right\} \quad \rightarrow \quad & P_{2}=\frac{m_{2} R_{\text {air }} T_{2}}{V\kern-0.8em\raise0.3ex-_{2}} = \frac{m_{1} R_{\text {air }} T_{2}}{V\kern-1.0em\raise0.3ex-_{A}+V\kern-0.8em\raise0.3ex-_{B}} = \frac{\left(m_{A, 1}+m_{B, 1}\right) R_{\text {air }} T_{2}}{\dfrac{m_{A, 1} R_{\text {air }} T_{A, 1}}{P_{A, 1}}+\dfrac{m_{B, 1} R_{\text {air }} T_{B, 1}}{P_{B, 1}}} = \frac{\left(m_{A, 1}+m_{B, 1}\right) T_{2}}{\dfrac{m_{A, 1} T_{A, 1}}{P_{A, 1}}+\dfrac{m_{B, 1} T_{B, 1}}{P_{B, 1}}} \\ & P_{2}=\frac{(1.0+2.0)(367)}{(1.0)\left(\dfrac{300}{150 \mathrm{~kPa}}\right) + (2.0)\left(\dfrac{400}{300 \mathrm{~kPa}}\right)} = 236 \mathrm{~kPa} \end{aligned} \nonumber \]
Comentario:
(1) Observe cómo una vez más hemos utilizado la idea de relaciones para resolver la presión final sin calcular nunca los volúmenes del tanque. Obviamente, como cheque se podría encontrar el volumen de cada tanque, agregarlos para encontrar el volumen total, y luego usar la ecuación de gas ideal. Esta sería una buena comprobación.
(2) Bajo nuestro modelo para gases ideales, el valor calorífico específico se cancela. Con un modelo más preciso para manejar cambios de temperatura mayores, los valores de calor específicos no caerían fuera del proceso. Tenga en cuenta que la temperatura final no es solo el promedio de las temperaturas iniciales.
Los modelos de sustancias introducidos en esta sección tienen una validez limitada. Bajo ciertas condiciones, el queroseno que bombeamos podría de hecho comenzar a vaporizarse o hervir. De manera similar, bajo ciertas condiciones cuando se comprime un gas, las gotitas de líquido pueden condensarse o las partículas sólidas pueden precipitar. Los cambios de fase ocurren repentinamente y nada sobre nuestro modelo nos permite predecir cuándo ocurrirá esto. Para conocer más sobre estos importantes fenómenos, estudiaremos el comportamiento de sustancias reales en un curso posterior (ES202 — Fluid & Thermal Systems). Una vez que hayamos hecho esto tendremos una mejor base para decidir cuándo nuestros modelos de sustancias son precisos.
Como indicación de estas limitaciones, se suele suponer que el modelo de gas ideal es válido a temperaturas “altas” y presiones “bajas”. Pero, ¿qué tan alto es “alto” y qué tan bajo es “bajo”? Bueno, las dos últimas columnas de los datos de propiedad termofísica para gases nos dan alguna orientación. Los puntos de referencia para los gases son la presión crítica\(P_{\mathrm{c}}\) y la temperatura crítica\(T_{\mathrm{c}}\). Como aprenderemos más adelante, la ecuación ideal del gas\(P \upsilon=R T\) está en error por menos que\(5 \%\) cuando\(P / P_{\mathrm{c}}<0.05\) y\(T / T_{\mathrm{c}}>0.75\). Para verificar esto, compare estas proporciones para agua, nitrógeno y helio en condiciones de habitación, digamos\(300 \mathrm{~K}\) y 1 bar. ¿Cuáles suelen pensar como gases en las condiciones de la habitación?


