3.1: Curva de presión de vapor
- Page ID
- 81378
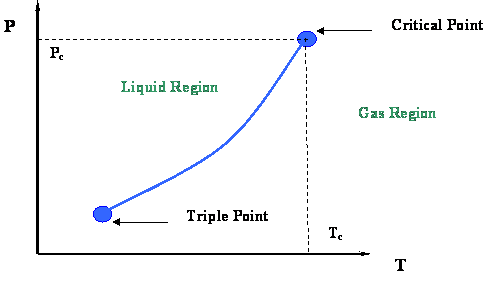
Del último módulo se recordará que se examinó la curva vapor-presión (Figura 2.2.3) y sus extremidades. Esa cifra se presenta en este módulo en la Figura 3.1.1. Se concluyó que dos puntos termodinámicos muy importantes enlazaron la curva de presión de vapor: el Punto Crítico en su extremo superior y el Punto Triple en su extremo inferior.
Ahora echemos un segundo vistazo a esta cifra. Podemos entender mejor la información representada por la curva de presión de vapor observando el proceso de calentamiento isobárico. Esto se ilustra por la línea ACB en la Figura 3.1.2. El término “isobárico” se refiere a un proceso de presión constante. Por proceso de calentamiento isobárico, entonces nos referimos a una “adición de calor a presión constante en un sistema”.
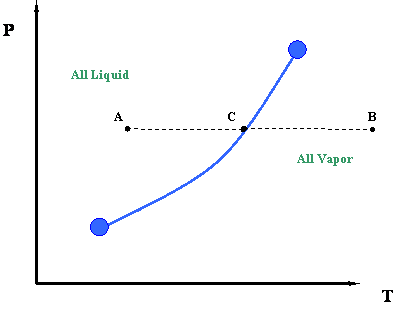
Tal proceso puede describirse de la siguiente manera. Comenzando en el punto A y moviéndonos hacia el punto C a presión constante, agregamos calor al sistema. Al agregar este calor, provocamos un aumento de temperatura en el sistema (Temperatura a C > Temperatura a A.). En el punto C, que se encuentra por encima de la curva de presión de vapor o punto de ebullición, encontramos un cambio de fase. A la izquierda del punto C, a temperaturas más bajas, solo existe líquido. A la derecha del punto C, a temperaturas más altas, solo hay vapor. Por lo tanto, existe una discontinuidad brusca en la densidad en el punto C. Durante esta transición, de líquido a vapor, notaremos que el calor que agregamos al sistema no provoca ningún aumento de temperatura, y de hecho, las condiciones de temperatura y presión permanecen constantes durante la transición representado por la curva de vapor. Es decir, a pesar de que estamos agregando calor, el sistema permanece a la presión y temperatura asociadas con el punto C hasta que se haya producido la transición de fase completa, es decir, hasta que todo el vapor se convierta en líquido. En lugar de trabajar para aumentar la temperatura del líquido, este calor sirve para separar las moléculas de líquido hasta que todo el líquido se haya convertido en vapor.
Hasta este punto, vimos que el calor agregado antes de que el sistema alcanzara la transición de fase se utilizó para elevar la temperatura de la sustancia. Sin embargo, el calor que estamos agregando en estos momentos, durante la transición de fase, no está provocando ningún aumento de temperatura (de ahí se dice que es calor oculto o calor latente de vaporización). Por lo tanto, diferenciamos entre dos tipos de calor: calor sensible y calor latente.
- Calor Sensible: Su propósito principal es provocar un aumento en la temperatura del sistema.
- Calor Latente: Sirve solo para un propósito: convertir el líquido en vapor. No provoca un aumento de temperatura.
De hecho, el nombre “latente” sugiere “oculto”. Aquí, estamos agregando calor al sistema pero no estamos viendo su efecto en términos de aumento de temperatura. El calor que se necesita para transformar un mol de líquido saturado en vapor se conoce como el calor molar latente de vaporización:\( (\Delta \tilde{H}_{vap}) \)
Una vez que hayamos convertido todo el líquido en vapor (es decir, suministramos todo el calor latente necesario para lograrlo), es posible que sigamos agregando más calor. Si lo hacemos, la temperatura volverá a subir y terminaremos en el punto B (Figura 3.1.2). Este calor también es sensible ya que está provocando que la temperatura del sistema suba.
Es interesante señalar que, para revertir el proceso del punto B al punto A, tendremos que eliminar la cantidad exacta de calor que habíamos agregado antes. Esta es una consecuencia básica de un principio de balance energético. Llamamos a tal proceso inverso un proceso de enfriamiento isobárico. Tendremos que eliminar algo de calor sensible para poder enfriar el vapor del punto B al C, y luego retiraremos todo el calor latente del vapor para condensarlo en líquido (transición en el punto C). Finalmente, también necesitaremos eliminar el calor más sensible del sistema para el enfriamiento del líquido del punto C al punto A.
En los dos procesos anteriores, de A a B o viceversa, tuvimos que cruzar el límite de fase representado por la curva de presión de vapor. Sin embargo, este no es el único camino termodinámico que tenemos disponible para ir de A a B. La Figura 3.1.3 representa otro camino posible.
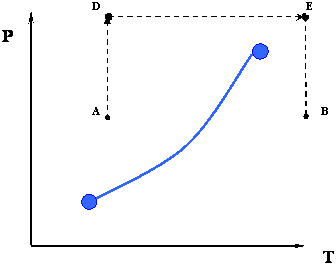
En lugar de hacer todo el proceso isobáricamente, podemos idear un nuevo camino que también pueda lograr el objetivo de llevar el sistema de una condición 'A' a una condición 'B' Considere la ruta ADEB que se muestra en la Figura 3.1.3.
Secuencia de Caminos
- Ruta AD: Compresión isotérmica
- Ruta DE: Calentamiento isobárico
- Ruta EB: Expansión isotérmica
Hay algo notable en este nuevo camino. A diferencia del camino anterior, observe que no cruzamos el límite de fase en absoluto. Las consecuencias de tomar este nuevo camino pueden parecer asombrosas a primera vista: pasamos de una condición totalmente líquida (punto A) a una condición completamente de vapor (punto B) sin ninguna transición de fase aguda. De hecho, a lo largo del camino ADEB NO hay transición de fase porque nunca cruzamos el límite de fase. Dado que el límite de fase representa una discontinuidad aguda en la densidad (y otras propiedades físicas), el hecho de que no lo estemos cruzando nos dice que a medida que avanzamos, en realidad hay una gradación en la densidad (de un líquido como, o de alta densidad en el punto A a un gas como, o baja densidad en punto B) en lugar de un cambio brusco de la alta densidad de líquido a la baja densidad de gas.
Pudimos hacerlo porque fuimos por encima de las condiciones críticas. En las proximidades y más allá de las condiciones críticas, ya no podemos etiquetar claramente la condición monofásica como “líquida” o “gas”. Bajo estas condiciones, cualquier transición se lleva a cabo gradualmente sin ninguna diferenciación entre una fase 'líquida' y una 'gaseosa'. Llamamos a este fluido, que no podemos definir ni como líquido ni como gas, fluido supercrítico. En términos de densidad, un fluido supercrítico puede describirse, al mismo tiempo, como un líquido ligero (su densidad no es tan alta como la densidad del líquido) y un gas pesado (su densidad no es tan baja como la densidad de gas típica de la sustancia dada). El comportamiento del fluido alrededor de esta zona es un área activa e interesante de investigación actual.
En resumen, para una sustancia pura, se puede evitar tener una transición de fase abrupta (como la descrita por el camino ACB) dando la vuelta al punto crítico (trayectoria ADEB). Tenga en cuenta que cualquier trayectoria que cruce la curva de presión de vapor (ACB) sufrirá una transición de fase.


