3.2: Diagrama fotovoltaico para sistemas puros
- Page ID
- 81367
En la discusión anterior, se utilizó el diagrama P-T y no nos preocupamos por los cambios en el volumen del sistema. Si queremos seguir los cambios de volumen, podemos construir diagramas P-v o T-v, en los que mantengamos constante la temperatura (T) o la presión (P). Consideremos el caso de un Diagrama P-v (Figura\(\PageIndex{4}\)).
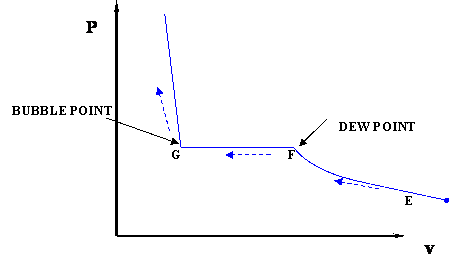
En este caso la temperatura se mantiene constante; nuestra sustancia se encuentra sometida a un proceso de compresión isotérmica. Comenzando en E (condición de todo vapor), un aumento en la presión dará como resultado una reducción bastante significativa en el volumen ya que la fase gaseosa es compresible. Si seguimos comprimiendo isotérmicamente, terminaremos en el punto F, donde se saturará el gas y aparecerá la primera gotita de líquido. Hemos llegado a la condición bifásica, donde el líquido (L) y el vapor (V) coexisten en equilibrio, por primera vez, aunque una cantidad infinitesimal de líquido.
Una vez que alcanzamos la condición bifásica, lo que sucede no es intuitivo. Mientras seguimos comprimiendo disminuyendo el volumen (trayectoria F-G) la presión del sistema permanece constante; esta condición continúa hasta que todo el vapor se ha convertido en líquido. El punto G representa la última condición de coexistencia de líquido y vapor (L+V), condición de líquido saturado (líquido en equilibrio con una cantidad infinitesimal de vapor). Una vez que solo tenemos líquido, si seguimos comprimiendo (es decir, intentando reducir el volumen de líquido) observaremos un rápido aumento de presión, como lo indica la pendiente pronunciada en el diagrama P-v. Esto se debe a que el líquido es prácticamente incompresible, por lo tanto, se necesita una gran cantidad de presión para provocar una pequeña reducción en el volumen.
Es importante reconocer algunos puntos de este proceso. Si recordamos nuestras definiciones anteriores de conceptos básicos, reconoceremos el punto F, donde solo existe una pequeña cantidad de líquido en un sistema por lo demás completamente gaseoso (el punto de rocío del sistema a la temperatura dada). Del mismo modo, el punto G es el punto de burbuja; solo existe una burbuja infinitesimalmente pequeña de vapor en un sistema que de otro modo sería líquido.
Pero espera un segundo. Intentemos comparar la Figura 3.2.4 con la Figura 3.1.2. ¿Podemos relacionarlos entre sí? ¿Dónde se representa el camino F-G en la Figura 3.2.4 en la Figura 3.1.2 (repetido a continuación)?
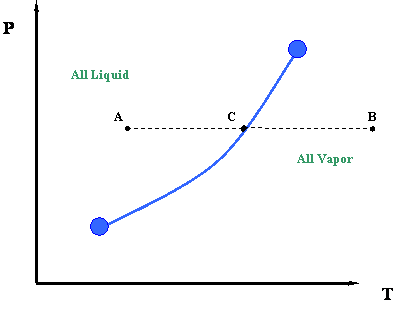
La respuesta es que la trayectoria F-G está representada por un punto en la Figura 3.1.2; es decir, el punto C. Recordemos, para un sistema de un solo componente, los puntos de rocío y los puntos de burbuja son idénticos. Durante una transición de fase, tanto la presión como la temperatura deben permanecer constantes para los componentes puros.
Ahora bien, si queremos generar todos los puntos posibles que conforman la curva de presión de vapor en la Figura 3.1.2, necesitaríamos repetir el experimento para diferentes temperaturas. Terminaríamos con una familia de isotermas (cada una similar a la presentada en la Figura 3.2.4). Esto se representa en la Figura 3.2.5.
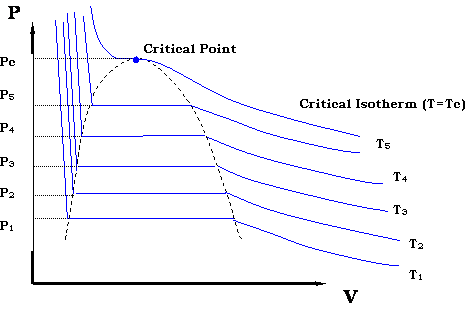
La zona donde las isotermas se vuelven planas delinea la región bifásica. Se ve claramente que trazando todos los pares en esa zona (P 1, T 1), (P 2, T 2)... (P c, T c) podremos reproducir la Figura 3.1.2.
Si ahora dibujamos una línea a través de todos los Puntos de Burbuja en la Figura 3.2.5, y luego dibujamos una línea que conecta todos los Puntos de Rocío, terminaremos con la Curva de Punto de Burbuja y la Curva de Punto de Rocío, respectivamente Es claro que las dos curvas se encuentran en el punto crítico (P c, T c). Además, las dos curvas delinean la envolvente de fase, que contiene la región bifásica en su interior. Si “limpiamos” un poco la Figura 3.2.5, terminamos con la envolvente de fase que se muestra en la Figura 3.2.6.
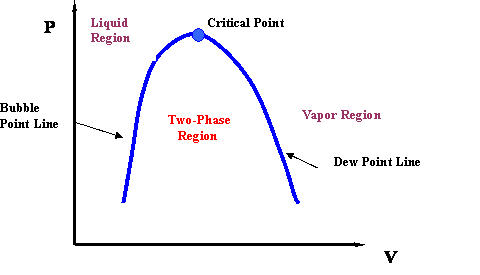
Si sigues cuidadosamente la tendencia de la isoterma crítica (@ T = T c en la Fig. 3.2.5), te darás cuenta de que tiene un punto de inflexión (cambio de curvatura) en el punto crítico. Además, el punto crítico también representa el punto máximo (vértice) de la envolvente P-v. Matemáticamente, esta información es transportada por las expresiones:
\[ \left( \frac{\partial P}{\partial V} \right)_{Pc,Tc} = \left( \frac{\partial^2 P}{\partial V^2} \right)_{Pc,Tc} = 0 \nonumber \]
que generalmente se conocen como las condiciones de criticidad. Estas condiciones siempre se satisfacen en el punto crítico. Comentaremos más sobre esto después de comenzar la discusión sobre Ecuaciones de Estado (EOS) — relaciones semiempíricas que modelan matemáticamente el comportamiento P-v-t de los fluidos.


