6.3: Comportamiento ideal
- Page ID
- 81706
Un gas ideal es un gas imaginario que satisface las siguientes condiciones:
- Interacciones insignificantes entre las moléculas,
- Sus moléculas no ocupan volumen (volumen molecular insignificante),
- Las colisiones entre moléculas son perfectamente elásticas — esto es, no se pierde energía después de colisionar.
Reconocemos que este fluido es imaginario porque —estrictamente hablando— no hay gases ideales. En cualquier fluido, todas las moléculas son atraídas entre sí hasta cierto punto. Sin embargo, la aproximación ideal funciona mejor en algunas condiciones limitantes, donde las fuerzas de atracción pueden considerarse débiles. De hecho, el comportamiento ideal puede ser abordado por gases reales a bajas presiones (cercanas a la atmosférica) y altas temperaturas. Tenga en cuenta que a bajas presiones y altas temperaturas, la distancia entre cualquier par de moléculas de gas es grande. Dado que las fuerzas de atracción se debilitan con la distancia, hemos elegido una condición donde las fuerzas de atracción pueden ser descuidadas. En conclusión, consideramos un gas ideal cuando cada molécula se comporta como si estuviera sola — las moléculas están tan alejadas entre sí que no se ven afectadas por la existencia de otras moléculas.
El comportamiento de los gases ideales ha sido estudiado exhaustivamente y puede ser ampliamente descrito por relaciones matemáticas.
Para una masa dada de un gas ideal, el volumen es inversamente proporcional a la presión a temperatura constante, es decir,
\[ v\alpha\frac{1}{P} (at\,constant\,temperature) \label{Boyle} \]
A esta relación se le conoce como Ley de Boyle. Adicionalmente, el volumen es directamente proporcional a la temperatura si la presión se mantiene constante, es decir,
\[ v\alpha T (at\,constant\,pressure) \label{Charles} \]
A esta relación se le conoce como Ley de Charles. Al combinar ambas leyes y reconocer “R” (la constante de gas universal) como la constante de proporcionalidad, terminamos con la ecuación muy familiar:
\[ Pv = nRT \label{EOS} \]
Esto representa la ecuación de estado (EOS) de un gas ideal. Los valores numéricos de “R” dependen del sistema de unidades que se utilice:
\[ R = 10.731\dfrac{psia ft^3}{lbmol R} = 8.3144\dfrac{Joule}{gmole K} = 1.9872\dfrac{cal}{gmole K} \nonumber \]
\[ R = 1.314\dfrac{atm ft^3}{lbmol K} = 0.7302\dfrac{atm ft^3}{lbmol R} = 1.9869\dfrac{BTU}{lbmol R} \nonumber \]
Si construimos el diagrama p-V para un gas ideal a una temperatura dada, terminamos con la isoterma mostrada en la Figura 6.3.2.
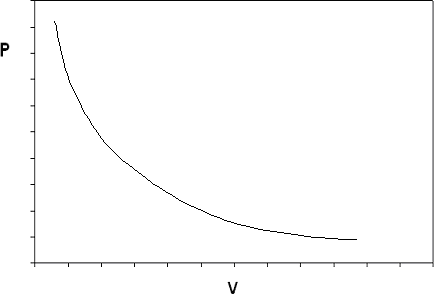
El modelo de gas ideal predice dos comportamientos limitantes de fluidos: primero, que el volumen del gas se vuelve muy grande a presiones muy bajas\( v \rightarrow \infty \) como\( P \rightarrow 0 \), concepto que concuerda con lo que conocemos de nuestra experiencia en el mundo físico). Y segundo,\( v \rightarrow \infty \) como\( P \rightarrow 0 \) (el volumen de materia simplemente “desaparece” si la presión es lo suficientemente alta: este concepto no estaríamos tan dispuestos a aceptar). Estos dos comportamientos son consecuencia de los supuestos hechos en el modelo de gas ideal.


