6.4: Gases reales
- Page ID
- 81707
En realidad, ningún gas se comporta idealmente. Por lo tanto, la EOS ideal no es útil para aplicaciones prácticas, aunque es importante como base de nuestra comprensión del comportamiento del gas. Aunque el modelo ideal no es confiable para aplicaciones de ingeniería reales, tenemos que tener en cuenta que el gas ideal EOS es el punto de partida de todos los enfoques modernos.
Si miramos hacia atrás en la Figura 6.3.2 y recordamos nuestras discusiones sobre el comportamiento P-v de sustancias puras, algo debería llamar su atención. La Figura 6.4.3 nos muestra el comportamiento típico de P-v de una sustancia pura para facilitar nuestra discusión.
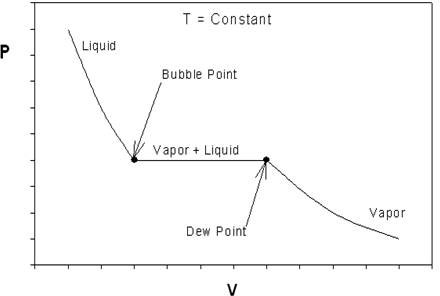
¿Qué podemos concluir sobre la EOS ideal mientras se contrasta la Figura 6.3.2 a 6.4.3? La curva en la Figura 6.3.2 es continua; la Figura 6.4.3 presenta una obvia discontinuidad (en la transición vapor+líquido). De ahí que una cosa que ya podemos decir es que la EOS ideal es al menos cualitativamente incorrecta. Para una sustancia real, a medida que aumenta la presión, debe haber un punto de discontinuidad que represente el cambio de fase. El gas ideal no se condensa, no importa a qué presión esté sometido, independientemente de la temperatura del sistema. En otras palabras, no podemos esperar reproducir el comportamiento p-V de la Figura 6.4.3 usando la ecuación ideal (\(6.3.3\)) ya que no se encuentra discontinuidad. Sin embargo, la isoterma real de p-V se puede aproximar por el comportamiento ideal a bajas presiones, como podemos ver en las parcelas.
También podemos establecer algunas diferencias cuantitativas entre el comportamiento ideal y el comportamiento real de la PVT. Por ejemplo, para la mayoría de las condiciones de interés a un volumen y temperatura dados, el modelo de gas ideal sobrepredice la presión del sistema:
\[ P_{Ideal\,Gas} > P_{Real\,Gas} \]
Podemos explicar esta diferencia recordando que un gas real sí tiene fuerzas de interacción entre moléculas. En segundo lugar, recordamos que el concepto de “presión” de un gas es consecuencia del número de colisiones moleculares por unidad de área contra la pared del contenedor. Dicho número de colisiones es, a su vez, una medida de la libertad de las moléculas para viajar dentro del gas. El gas ideal es un estado de completa libertad molecular donde las moléculas ni siquiera conocen la existencia de las otras. De ahí que un gas ideal hipotético ejerza una presión mayor que un gas real a cualquier volumen y temperatura dados. Cuando las moléculas se unen (gas real), se reduce el espacio libre disponible para las moléculas y se reduce la presión.
Adicionalmente, el modelo ideal asume que el espacio físico que ocupan las propias moléculas es insignificante. En realidad las moléculas son partículas físicas y sí ocupan espacio. Una vez que encontremos una forma de contabilizar el espacio que ocupan las propias moléculas, podríamos calcular un volumen libre “real” disponible para que las moléculas viajen a través del gas. En el caso ideal, este volumen libre es igual al volumen del propio contenedor ya que no se contabiliza el volumen molecular. En el caso real, este volumen libre debe ser menor que el volumen del propio contenedor después de dar cuenta del espacio físico que ocupan las moléculas. Por lo tanto:
\[ V_{real, free} < V_{Ideal} = V_{Container} \]
\[ V_{real, free} < V_{Container} = V_{occupied\,by\,molecules}\]


