8.1: Principio de Estados Correspondientes (PCS)
- Page ID
- 81504
El principio de Estados Correspondientes (PCS) fue declarado por van der Waals y dice: “Las sustancias se comportan igual en los mismos estados reducidos. Las sustancias a los mismos estados reducidos se encuentran en los estados correspondientes”. Es decir,
“Las sustancias en los estados correspondientes se comportan igual”.
Las propiedades reducidas se utilizan para definir los estados correspondientes. Las propiedades reducidas proporcionan una medida de la “salida” de las condiciones de la sustancia de sus propias condiciones críticas y se definen de la siguiente manera:
\[P_{r}=\frac{P}{P_{c}} \label{8.1a}\]
\[T_{r}=\frac{T}{T_{c}} \label{8.1b}\]
\[\bar{v}_{r}=\frac{\bar{v}}{\bar{v}_{c}} \label{8.1c}\]
Si\(P_r = T_r = v_r = 1\), la sustancia se encuentra en su estado crítico. Si estamos más allá de las condiciones críticas, T r > 1, P r > 1 y v r > 1. De la misma manera, si todas las condiciones son subcríticas, T r < 1, P r < 1 y v r < 1. Las condiciones críticas se convierten en el factor de escalado por el cual las sustancias pueden compararse entre sí en términos de su “desviación de la criticidad” o propiedades reducidas.
El PCS dice que todos los gases se comportan igual en las mismas condiciones reducidas. Es decir, si dos gases tienen la misma “desviación relativa” de la criticidad (es decir, se encuentran en las mismas condiciones reducidas), el principio estatal correspondiente exige que se comporten igual. En este caso, las dos condiciones “corresponden” entre sí, y debemos esperar que esos gases tengan las mismas propiedades.
El Principio de Estado Correspondiente puede derivarse de VdW EOS. Si recordamos,
\[\left(P+\frac{a}{\bar{v}}\right)(v-b)=R T \label{8.2a}\]
donde:
\[a=\frac{24}{64} \frac{R^{2} T^{2} c}{P_{c}} \label{8.2b}\]
\[b=\frac{R T_{c}}{8 P_{c}} \label{8.2c}\]
Definimos las condiciones reducidas como:
\[P_{r}=\frac{P}{P_{c}} \label{8.3a}\]
\[T_{r}=\frac{T}{T_{c}} \label{8.3b}\]
\[\bar{v}_{r}=\frac{\bar{v}}{\bar{v}_{c}} \label{8.3c}\]
Si sustituimos todo esto por VdW EOS,
\[\left(P_{c} P_{r} \frac{27 R^{2} T_{c}^{2}}{64 P_{c} \bar{v}^{-2} \bar{v}_{r}^{2}}\right)\left(\bar{v}_{c} \bar{v}_{r}-\frac{R T_{c}}{8 P_{c}}\right)=R T_{c} T_{r} \label{8.4}\]
Simplificando la expresión y empleando las expresiones:
\[\bar{v}_{c}=\frac{3 R T_{c}}{8 P_{c}} \label{8.5a}\]
\[Z_{c}=3 / 8=0.375 \label{8.5b}\]
Obtenemos:
\[\left(P_{r} \frac{3}{\bar{v}_{r}^{2}}\right)\left(3 \bar{v}_{r}-1\right)=8 T_{r} \label{8.6}\]
La ecuación\ ref {8.6} es la forma reducida de VdW EOS. Vea como esta ecuación es “universal”. No le importa de qué fluidos estamos hablando. Simplemente dale las condiciones reducidas “P r, T r” y te devolverá v r — independientemente del fluido. Por lo tanto, si calcula v r para un cierto fluido ingresando P r y T r para ese fluido en VdW EOS reducido (Ecuación\ ref {8.6}), calculará el mismo v r, para cualquier otro fluido en las mismas condiciones de P r y T r. No hay otra posibilidad. Estrictamente hablando, el Principio de Estados Correspondientes de van der Waals dice: “los fluidos a las mismas presiones y temperaturas reducidas tienen el mismo volumen reducido”. Es así como van der Waals descubrió el Principio de los Estados Correspondientes. Mientras dos gases estén en los estados correspondientes (mismas condiciones reducidas), no importa de qué componentes estés hablando, o cuál es la naturaleza de las sustancias de las que estás hablando; se comportarán igual.
El punto crítico proporciona el escalado perfecto para la aplicación del principio estatal correspondiente debido a la existencia de las condiciones de criticidad. De hecho, la ecuación (7.13) hace posible la aplicación de los estados correspondientes para las ecuaciones de estado.
\[\left(\frac{\alpha P}{\partial v}\right)_{P_{c}, T_{c}}=\left(\frac{\alpha^{2} P}{\partial v}\right)_{P_{c}, T_{c}}=0 \label{7.13}\]
En efecto, para llegar a la Ecuación\ ref {8.6}, necesitábamos usar Ecuaciones\ ref {8.2a} -\ ref {8.2c} — que a su vez fueron el resultado de la aplicación de las condiciones de criticidad a la ecuación de estado de van der Waals. Como resultado, los gases que tienen la misma desviación relativa de su propia condición crítica tienen las mismas propiedades.
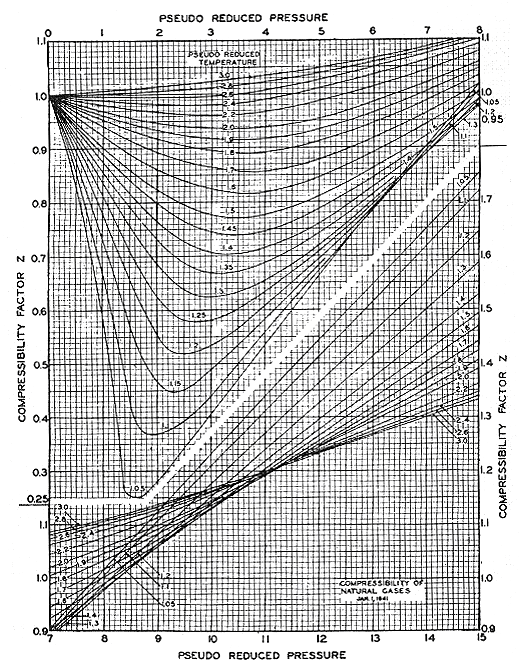
¿Cuál es el uso de este principio? Básicamente, se utiliza para correlaciones termodinámicas, su aplicación más poderosa. La mayoría de las correlaciones termodinámicas se han hecho viables y generales debido a la aplicación del principio de estados correspondientes. Un excelente ejemplo es el popular gráfico Z de Standing y Katz, mostrado en la Figura 8.1. De hecho, la mayoría de las correlaciones que utilizamos en la termodinámica se basan en este principio. Esto explica por qué “P r” y “T r” aparecen tan a menudo en las correlaciones termodinámicas. La razón principal para usar “P r” y “T r” es obtener la correlación más generalizada posible, de manera que sea adecuada para su uso con la mayoría de las sustancias.
Contributors and Attributions
Michael Adewumi (The Pennsylvania State University) Vice Provost for Global Program, Professor of Petroleum and Natural Gas Engineering


