6.4: Comportamiento ondulatorio de la materia
- Page ID
- 1938
Objetivos
-
Comprender la dualidad onda-partícula de la materia
Los fotones lumínicos propuestos por Einstein eran paquetes de energía con ciertas características de partícula. Recuerda que la colisión de un fotón de suficiente energía con un electrón (una partícula), puede eyectar a este último de la superficie del metal. Cualquier exceso de energía incrementa la velocidad del electrón (o fotoelectrón) eyectado, como bien describe la ecuación del efecto fotoeléctrico. La hipótesis de Einstein de que la energía esta concentrada en paquetes, sin embargo, contradecía la noción clásica de que la energía se esparce uniformemente en la onda. Ahora describiremos la teoría de Einstein que relaciona masa y energía, una teoría que otros continuaron y utilizaron para desarrollar el modelo actual del átomo.
El caracter ondulatorio de la materia
Inicialmente Einstein asumió que los fotones tenían masa cero, lo cual los convierte en partículas especiales. En 1905, sin embargo, publica su teoríia de la relatividad especial, la cual relacionaba masa y energía a través de la ecuación
\[ E=h\nu=h\dfrac{c}{\lambda }=mc^{2} \label{6.4.1} \]
De acuerdo con esta teoría, un fotón de longitud de onda \(λ\) y frecuencia \(\nu\) tiene masa distinta de zero, y es descripto por la ecuación:
\[ m=\dfrac{E}{c^{2}}=\dfrac{h\nu }{c^{2}}=\dfrac{h}{\lambda c} \label{6.4.2}\]
Es decir que la luz, que había sido considerada una onda, tambien posee propiedades típicas de las partículas, condición denominada dualidad onda-partícula (y establece que materia y energía poseen propiedades de onda y particula). En otras palabras, dependiendo de las condiciones, la luz puede ser vista como onda o como partícula.
En 1922, el físico Americano Arthur Compton (1892-1962) reportó los resultados experimentales sobre la colisión de rayos-x y electrones que avalaban la naturaleza particulada de la luz. Por esa época, un joven estudiante Frances, Louis de Broglie (1892-1972), comenzó a preguntarse si lo inverso era cierto: las ondas poseen propiedades de particulas pero...¿Podrían las partículas exhibir propiedades de onda? En su tesis posdoctoral enviada a la Sorbona, en 1924, de Broglie propone que una partícula como el electron podría ser descripta como una onda cuya longitud de onda esta dada por
\[\lambda =\dfrac{h}{mv} \label{6.4.3}\]
donde
- \(h\) es la constante de Planck,
- \(m\) es la masa de la particula, y
- \(v\) es la velocidad de la particula.
Esta idea revolucionaria fue rápidamente confirmada por los físicos Americanos Clinton Davisson (1881-1958) y Lester Germer (1896-1971), quienes mostraron que los haces de electrones, considerados como partículas, eran difractados por un cristal de cloruro de sodio de la misma manera que los rayos-x, los cuales eran considerados ondas. Se probó experimentalmente que los electrones sí exhibían propiedades de ondas. Por su trabajo, de Broglie recibió el premio Nobel de física en 1929.
Si las partículas exhiben propiedades de ondas ¿Por qué nadie los habia observado antes? La respuesta se encuentra en el numerador de la ecuacion \(\ref{6.4.3}\), el cual es extremadamente pequeño. Tal como calcularás en el ejemplo 6.4.1, la constante de Planck (6.63 × 10−34 J•s) es tan pequeña que la longitud de onda de una partícula con gran cantidad de masa es demasiado corta (menor al diámetro del nucleo atómico) para ser detectada.
EJEMPLO \(\PageIndex{1}\): LONGITUD DE ONDA DE UNA BOLA DE BÉISBOL EN MOVIMIENTO
Calcula la longitud de onda de una bola de beisbol, cuya masa es 149 g y su velocidad 100 mi/h.
Datos: masa y velocidad el objeto.
Se pide: longitud de onda.
Estrategia:
- Convertir la velocidad a de la bola de béisbol a las unidades apropiadas del SI: metros por segundo.
- Sustituir los valores en la ecuación \(\ref{6.4.3}\) y calcular la longitud de onda.
Solución:
La longitud de onda de la partícula está dada por \(λ = h/mv\). Sabemos que m = 0.149 kg, nos queda averiguar la velocidad del objeto:
\( v=\left ( \dfrac{100\; \cancel{mi}}{\cancel{h}} \right )\left ( \dfrac{1\; \cancel{h}}{60\; \cancel{min}} \right )\left ( \dfrac{1.609\; \cancel{km}}{\cancel{mi}} \right )\left ( \dfrac{1000\; m}{\cancel{km}} \right ) \)
B Recuerda que el joule es una unidad compuesta por (kg•m2)/s2. Entonces la longitud de onda del objeto es
\[ \lambda =\dfrac{6.626\times 10^{-34}\; J\cdot s}{\left ( 0.149\; kg \right )\left ( 44.69\; m\cdot s \right )}= \dfrac{6.626\times 10^{-34}\; \cancel{kg}\cdot m{^\cancel{2}\cdot \cancel{s}{\cancel{^{-2}}\cdot \cancel{s}}}}{\left ( 0.149\; \cancel{kg} \right )\left ( 44.69\; \cancel{m}\cdot \cancel{s^{-1}} \right )}=9.95\times 10^{-35}\; m \]
(DeberÍas verificar que las unidades se cancelan y el resultado es en metros). Dado que el diámetro del núcleo del átomo es aproximadamente 10−14 m, la longitud de la onda de la bola de éeisbol es casi inimaginablemente pequeña.
EJERCICIO \(\PageIndex{1}\): lONGITUD DE ONDA DE UN NEUTRóN EN MOVIMIENTO
Calcula la longitud de onda de un neutron moviéndose a 3.00 × 103 m/s.
Answer: 1.32 Å, or 132 pm
Tal como calculaste en el ejemplo 6.4.1, los objetos como una bola de béisbol o un neutrón poseen longitudes de onda tan cortas que son preferentemente considerados partículas. En contraste, objetos con masa muy pequeña (como fotones) poseen longitudes de onda largas y pueden ser vistos preferentemente como ondas. Objetos con masas intermedias, tal como los electrones, exhiben propiedades duales, tanto de ondas como de partículas. Aunque nosotros usualmente pensamos a los electrones como partículas, la naturaleza dual de los electrones es empleada en los microscopios electrónicos, que han revelados mucho de lo que se conoce sobre la estructura microscópica de organismos vivos y materiales. Debido a que la longitud de onda de un haz de electrones es mucho más corta de la de un haz de luz visible, el instrumento puede resolver muchas mas detalles que un micróscopio lumínico (Figura 6.4.1)
Figure \(\PageIndex{1}\): Comparación de iáagenes obtenidas con micróscopio lumínico y electrónico. Debido a su longitud de onda más corta, los electrones de alta energía tienen mayor poder resolutivo que la luz visible. Consecuentemente, un microscopio electrónico (b) puede resolver detalles más finos que uno lumínico (a). (La Radiolaria, mostrada aquí, es un protista unicelular.)
UNA PROPIEDAD ONDULATORIA IMPORTANTE: FASE
Una onda es una perturbación que se desplaza por el espacio. La magnitud de la onda en cualquier punto del espacio y tiempo varía sinusoidalmente. Mientras que el valor absoluto de la magnitud de una onda en cualquier punto no es demasiado importante, el desplazamiento relativo entre dos ondas, llamado diferencia de fase, es de vital importancia porque determina si las ondas se refuerzan o interfieren. Figura \(\PageIndex{2A}\) muestra una diferencia de fase arbitraria entre dos ondas y la Figura \(\PageIndex{2B}\) muestra lo que sucede si la diferencia de fase es de 180 grados. La linea verde es su suma. La Figura \(\PageIndex{2C}\) muestra lo que sucede cuando dos líneas estan en fase, exactamente superpuestas entre si. Una vez mas, la línea verde es la suma de las intensidades.
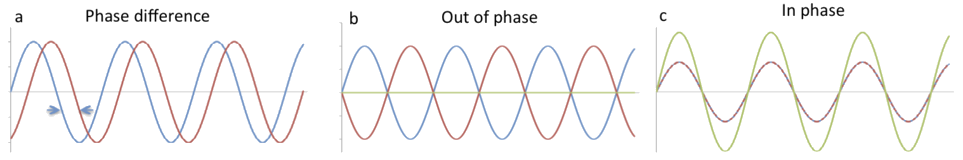
Figure \(\PageIndex{2}\): Fase. (a) Las dos ondas se desplazan juntas con una diferencia de fase. (b) Si la diferencia de fase es 180° se cancelan entre si. (c) Si la diferencia de fase es 0° entonces hay refuerzo.
Para revisar aspectos de la fase en sinusoides, chequea math Libretexts library.
Ondas estacionarias
De Broglie también investigó porqué solo ciertas órbitas del modelo de Bohr para el átomo de hidrógeno estaban permitidas. El hipotetizó que el electrón se comporta como una onda estacionaria: una onda que no viaja en el espacio. Un ejemplo de onda estacionaria es el movimiento de una cuerda de violín o guitarra. Cuando se frota la cuerda, vibra a ciertas frecuencias fijas porque esta sujeta de ambos extremos (Figura \(\PageIndex{3}\)). Si la longitud de la cuerda es \(L\), entonces la vibración mínima energía (o fundamental) tiene longitud de onda
\[ \begin{align} \dfrac{\lambda }{2} & =L \nonumber \\ \lambda &= 2L \nonumber \end{align} \label{6.4.4}\]
Vibraciones de mayor energía que la fundamental son llamadas sobretonos y son producidas cuando la cuerda es frotada con mas fuerza; tienen longitudes de onda dadas por
\[ \lambda=\dfrac{2L}{n} \label{6.4.5}\]
donde n es un número natural. Entonces la energía vibracional de resonancia esta cuantizada. Al frotar, todas las otras frecuencias enmudecen. Solo las resonantes son oídas. Por analogía, podemos pensar en las frecuencias resonantes como si estuvieran cuantizadas. Nota que en la Figura \(\PageIndex{21}\) todos los sobretonos poseen uno o más nodos o puntos donde la amplitud de la onda es cero (la cuerda no se mueve).
Figure \(\PageIndex{3}\): Ondas estacionarias en una cuerda vibrando. La vibración con \(n = 1\) es la fundamental y no contiene nodos. Vibraciones con valores mayores de n se denominan sobretonos; y contienen \(n − 1\) nodos.
Vibraciones y sobretonos que a la vez contienen nodos y estan cuantizados, no están restrictos a sistemas unidimensionales, tales como las cuerdas. Una superficie bidimensional, como un parche de batería, también posee vibraciones cuantizadas. De manera similar, cuando los extremos de una cuerda forman un círculo, las únicas frecuencias permitidas son
\[2πr = nλ \label{6.4.6}\]
donde \(r\) es el radio del círculo. De Broglie argumentaba que las órbitas permitidas de Bohr podrían entenderse si se consideraba que el electrón se comportaba como una onda estacionaria circular (Figura \(\PageIndex{4}\)). La onda estacionaria podría existir solo si la circunferencia del círculo era un entero múltiplo de la longitud de onda, tal que las ondas que se propagaban estuvieran todas en fase; incrementando asi la amplitud y causando refuerzo (o interferencia constructiva). De otro modo, las ondas propagadas estarian fuera de fase, resultando en un decrecimiento de la amplitud. ¡Las ondas no resonantes interfieren consigo mismas! Dicha idea, propuesta por De Broglie explicaba las órbitas permitidas y los niveles de energía de Bohr de manera elegante: en el nivel de mínima energía, correspondiente a \(n = 1\) en la ecuación \(\ref{6.4.6}\), una longitud de onda completa cerraría el círculo. Niveles de energía mayores tendrían sucesivamente mayores valores de n, correspondiente al número de nodos.
Seiches sísmicos
Las ondas estacionarias son usualmente observadas en ríos, reservorios, lagunas y lagos cuando las ondas sísmicas de un terremoto viajan por el area. Tales ondas se denominas seiches sísmicos, término utilizado por primera vez en 1955 cuando los niveles del lago en Inglaterra y Noruega oscilaron de lado a lado, debido a un terremoto en Assam, en el Tibet (1950). Fueron descriptos por primera vez en los Procedimientos de la Sociedad Real en 1755 cuando fueron vistos en puertos ingleses y lagunas tras un terremoto en Lisboa, Portugal.
Seiche en Lago Genova, Suiza. Un seiche es un vaivén de un cuerpo de agua cerrado debido al agitamiento de la tierra. Las piletas suelen presentar seiches durante los terremotos. Imagen utilizada bajo permiso (Prof. Brennan, Geneseo State Univ. of New York).
Seiches sísmicos fueron también observados en diversos lugares de Norte América tras el terremoto de Alaska de Marzo 28, 1964. Aquellos que ocurrieron en reservorios occidentales duraron por dos horas o mas, y las aplitudes alcanzaron los 6 pies en la Costa del Golfo. La altura de un seiche es aproximadamente proporcional al espesos de los sedimentos superficiales; un canal más profundo producirá un seiche mayor.
Aún como analogías, aunque el modelo de la onda estacionaria nos ayuda a entender mucho sobre el modelo de Bohr, también, si se lo lleva demasiado lejos, puede confundir.
Figura \(\PageIndex{4}\): Onda estacionaria circular e interferencia destructiva. (a) Para una onda estacionaria circular con \(n = 5\), la circunferencia del círculo corresponde exactamente a cinco longitudes de onda, lo cual resulta en interferencia constructiva de la onda consigo misma cuando el solapamiento ocurre. (b) Si la circunferencia del círculo no es igual a un múltiplo entero de longitudes de onda, entonces la onda no se solapa exactamente consigo misma, y la onda la interferencia destructiva resultante resultará en la cancelación de la onda. Consecuentemente, la onda estacionaria no puede existir en estas condiciones.
Tal como verás, algunas de las ideas planteadas por de Broglie se mantienen en la teoría moderna de la estructura electrónica del átomo: el comportamiento ondulatorio del electrón y la presencia de nodos que incrementan hacia estados más energéticos. Desafortunadamente, su explicación (y la de Bohr) contienen una característica que sabemos incorrecta: en el modelo actualmente aceptado, el electrón de una misma órbita no está siempre a una distancia fija del núcleo.
Principio de incerteza de Heisenberg
Debido a que una onda es una perturbación que viaja en el espacio, no tiene una posición fija. En este sentido, si una partícula exhibe comportamiento ondulatorio, podría esperarse que fuera difícil especificar su posición exacta. Una característica de la luz es que puede 'doblar' al interferir con una rendija estrecha, como se muestra en el video de abajo. Esto puede comprobarse cerrando un ojo y mirando través de las pestañas. Así se reduce el brillo de la imagen y se desfigura un poco, pero la luz dobla en las pestañas y provee una imagen completa más que un puñado de franjas o barras en la imagen. Este fenómeno se denomina difracción.
Este comportamiento de las ondas es capturado en las ecuaciones de Maxwell para ondas electromagnéticas (alrededor de 1870) y está bien entendido. El principio de Incerteza de Heisenberg es, si se quiere, meramente una conclusión sobre la naturaleza electromagnética de ondas, nada nuevo. Su idea de partículas con característica de ondas implica que partículas como electrones exhibirán propiedades de onda, y también difractará al atravesar rendijas cuya apertura es del orden de la longitud de onda del electrón.
Esta situación fue descripta matemáticamente por el físico alemán Werner Heisenberg (1901–1976; Premio Nobel de fisica, 1932), quien relacionó la posición de una partícula a su velocidad o momento. En referencia al electrón Heisenber enuncio que 'en cada instante la posicion y la velocidad del electrón son imprecisas, y entre estas dos impresiciones hay una relación de incerteza.' Afirma que la incerteza en la posición de la partícula (Δx) multiplicada por la incerteza en su momento [Δ(mv)] es mayor o igual a la constante de Planck h dividida por 4π
\[ \left ( \Delta x \right )\left ( \Delta \left [ mv \right ] \right )\ge \dfrac{h}{4\pi } \label{6.4.7} \]
Porque la constante de Planck es un número muy pequeño, el principio de Incerteza de Heisenberg es relevante solo para partículas tales como los electrones, que tienen masas muy pequeñas. Estas son las mismas partículas que la ecuación propuesta por de Broglie predice con longitudes de onda medibles.
Si la posición exacta \(x\) de una partícula es conocida de manera absoluta (Δx = 0), entonces la incerteza en el momento es infinita
\[ \left ( \Delta \left [ mv \right ] \right )= \dfrac{h}{4\pi \left ( \Delta x \right ) }=\dfrac{h}{4\pi \left ( 0 \right ) }=\infty \label{6.4.8} \]
Porque la masa del electrón en reposo (\(m\)) es a la vez constante y conocida con precisión, la incerteza en \(Δ(mv)\) se asigna al término \(Δv\), que debería ser infinitamente grande para que Δ(mv) sea infinito. Es decir, de acuerdo a la ecuación \(\ref{6.4.8}\), mientras más preciso es nuestro conocimiento de la posición exacta del electrón (cuando \(Δx → 0\)), menos preciso es el conocimiento de la velocidad y la energía cinética del electrón (1/2 mv2)) porque \(Δ(mv) → ∞\. Inversamente, mientras mayor es la precisión en el momento (y en la energía) del electrón [as \(Δ(mv) → 0\)], entonces \(Δx → ∞\) y no tendremos idea dónde se encuentra.
El modelo de Bohr para el átomo de hidrógeno viola el principio de incerteza de Heisenberg porque especificaba simultáneamente la posición (una órbita con un radio particular) y la energía correspondiente (una cantidad relacionada al momento) del electrón. Además, dada su masa y naturaleza ondulatoria, el electrón en el átomo de hidrógeno no podría moverse en una órbita circular tal como predecía Bohr. Verás, sin embargo, que el radio más probable del electrón en el átomo de hidrógeno es exactamente aquel que predice el modelo de Bohr.
Ejemplo \(\PageIndex{1}\): Naturaleza cuántica de las bolas de béisbol
Calcular la minima incerteza en la posición de la bola de béisbol del ejemplo \(\ref{6.4.1}\) que posee una masa de 149 g y rapidez100 ± 1 mi/h.
Datos: masa y rapidez del objeto
Se pide: incerteza mínima en su posición
Estrategia
- Reordenar la desigualdad que describe el principio de incerteza de Heiseenberg (ecuación \(\ref{6.4.7}\)) para encontrar la incerteza mínima en la posición del objeto (Δx).
- Encuentra Δv tras convertir la rapidez de la bola de béisbol a las unidades apropiadas en el SI: metros por segundo.
- Sustituye los valores apropiados en la expresión para la desigualdad y obtiene Δx.
Solucióm:
A El principio de incerteza de Heisenberg (ecuación \ref{6.4.7}) nos dice que \[(Δx)(Δ(mv)) = h/4π\]. Reordenando la desigualdad
\( \Delta x \ge \left( {\dfrac{h}{4\pi }} \right)\left( {\dfrac{1}{\Delta (mv)}} \right)\)
B Sabemos que h = 6.626 × 10−34 J•s y m = 0.149 kg. Como no hay incerteza en la masa del objeto, Δ(mv) = mΔv and Δv = ±1 mi/h. Tenemos
\[ \Delta \nu =\left ( \dfrac{1\; \cancel{mi}}{\cancel{h}} \right )\left ( \dfrac{1\; \cancel{h}}{60\; \cancel{min}} \right )\left ( \dfrac{1\; \cancel{min}}{60\; s} \right )\left ( \dfrac{1.609\; \cancel{km}}{\cancel{mi}} \right )\left ( \dfrac{1000\; m}{\cancel{km}} \right )=0.4469\; m/s \]
C Por lo tanto,
\[ \Delta x \ge \left ( \dfrac{6.626\times 10^{-34}\; J\cdot s}{4\left ( 3.1416 \right )} \right ) \left ( \dfrac{1}{\left ( 0.149\; kg \right )\left ( 0.4469\; m\cdot s^{-1} \right )} \right ) \]
Utilizando la definición del Joule (1 J = 1 kg•m2/s2) da
\[ \Delta x \ge \left ( \dfrac{6.626\times 10^{-34}\; \cancel{kg} \cdot m^{\cancel{2}} \cdot s}{4\left ( 3.1416 \right )\left ( \cancel{s^{2}} \right )} \right ) \left ( \dfrac{1\; \cancel{s}}{\left ( 0.149\; \cancel{kg} \right )\left ( 0.4469\; \cancel{m} \right )} \right ) \]
\[ \Delta x \ge 7.92 \pm \times 10^{-34}\; m \]
Que es igual a \(3.12 \times 10^{−32}\) pulgadas. Podemos decir que si un bateador pifia la velocidad de una bola rápida en 1 mi/h (about 1%), no podrá echarle la culpa al principio de incerteza de Heisenberg.
Ejercicio \(\PageIndex{2}\)
Calcular la minima incerteza en la posición de un electrón que viaja a un tercio de la velocidad de la luz, si la incerteza en su velocidad es ±0.1%. Asumir que la masa es igual a la masa en reposo.
Respuesta
6 × 10−10 m, or 0.6 nm (aproximadamente el diámetro de la molécula de benceno)
Resumen
Un electrón posee tanto propiedades de partícula como de onda. Así lo supone el modelo actual del átomo, bajo el conocido título de dualidad onda partícula del electrón. Louis de Broglie mostró que la longitud de onda de una partócula es igual a la constante de Plank dividida por su masa multiplicada por la velocidad de la partócula:
\[\lambda =\dfrac{h}{mv} \nonumber \]
El electrón en el modelo de Bohr órbita circularmente y puede describirse como una onda estacionaria (i.e que no se mueve a traves del espacio). Las ondas estacionarias son conocidas en la música: la onda estacionaria de menor energía da la frecuencia de vibración fundamental, vibraciones de mayor energía son sobretonos y tienen sucesivamente mas nodos, o puntos donde la amplitud de la onda es siempre cero. El principio de incerteza Werner Heisenberg establece que es imposible conocer a la vez la posición y la velocidad de partículas que poseen comportamiento dual onda-partícula.
\[ \left ( \Delta x \right )\left ( \Delta \left [ mv \right ] \right )\geqslant \dfrac{h}{4\pi } \nonumber\]
Colaboradores
Modified by Joshua Halpern (Howard University)
Traducción de Santiago Miranda (Universidad Nacional de La Plata)

