2.1: Las ideas tempranas en la teoría átómica
- Page ID
- 1802
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Habilidades Para Desarrollar
Al final de esta sección, podrás:
- Enunciar los postulados de la teoría atómica de Dalton.
- Usar los postulados de la teoría atómica de Dalton para explicar las leyes de proporciones definidas y múltiples.
El lenguaje usado en la química se ve y se escucha en muchas disciplinas, desde la medicina hasta la ingeniería, la medicina forense y el arte. El lenguaje de la química incluye su propio vocabulario, así como su propia forma de taquigrafía. Los símbolos químicos se usan para representar átomos y elementos. Las fórmulas químicas representan moléculas, así como la composición de los compuestos. Las ecuaciones químicas dan información sobre la calidad y la cantidad de los cambios asociados con las reacciones químicas.
Este capítulo será la base de nuestro estudio del lenguaje de la química. Los conceptos de este capítulo incluyen la teoría atómica, la composición y la masa de un átomo, la variabilidad de la composición de los isótopos, la formación de iones, los enlaces químicos en compuestos ionicos y covalentes, los tipos de reacciones químicas y la denominación de los compuestos. También presentaremos una de las herramientas más poderosas para organizar el conocimiento químico: la tabla periódica.
La teoría atómica hasta el siglo diecinueve
La primera discusión registrada sobre la estructura básica de la materia viene de los filósofos griegos antiguos, los científicos de esa época. En el siglo quinto antes de Cristo, Leucipo y Demócrito discutieron que toda la materia estaba compuesta de pequeñas partículas finitas que se llamaban átomos, un término derivado de la palabra griega que significa "indivisible". Pensaban que los átomos eran partículas en movimiento que estaban diferente en forma y tamaño, y que se podrían unir. Después, Aristóteles y otros llegaron a la conclusión de que la materia consistía en varias combinaciones de los cuatro "elementos" (fuego, tierra, aire y agua) y que se podía dividir infinitamente. Curiosamente, estos filósofos pensaron en los átomos y los "elementos" como conceptos filosóficos, pero aparentemente nunca consideraron hacer experimentos para comprobar sus ideas.
La visión Aristotélica de la composición de la materia se mantuvo durante más de dos mil años, hasta que el maestro de escuela inglés John Dalton ayudó a revolucionar la química con su hipótesis de que el comportamiento de la materia se podía explicar usando una teoría atómica. Publicada por primera vez en 1807, muchas de las hipótesis de Dalton sobre las características microscópicas de la materia siguen siendo válidas en la teoría atómica moderna. Aquí están los postulados de la teoría atómica de Dalton.
- La materia está compuesta de partículas muy pequeñas llamadas átomos. Un átomo es la unidad más pequeña de un elemento que puede participar en un cambio químico.
- Un elemento consiste de solo un tipo de átomo, que tiene una masa que es característica del elemento y es la misma para todos los átomos de ese elemento (Figura \(\PageIndex{1}\)). Una muestra macroscópica de un elemento contiene una cantidad increíblemente grande de átomos, todos los cuales tienen propiedades químicas idénticas.

- Los átomos de un elemento difieren en propiedades de los átomos de todos los demás elementos.
- Un compuesto consiste en átomos de dos o más elementos combinados en una pequeña proporción de números enteros. En un compuesto dado, los números de átomos de cada uno de sus elementos están siempre presentes en la misma proporción (Figura \(\PageIndex{2}\)).

- Los átomos no se crean ni se destruyen durante un cambio químico, sino que se reorganizan para producir sustancias que son diferentes de las que estaban presentes antes del cambio (Figura \(\PageIndex{3}\)).
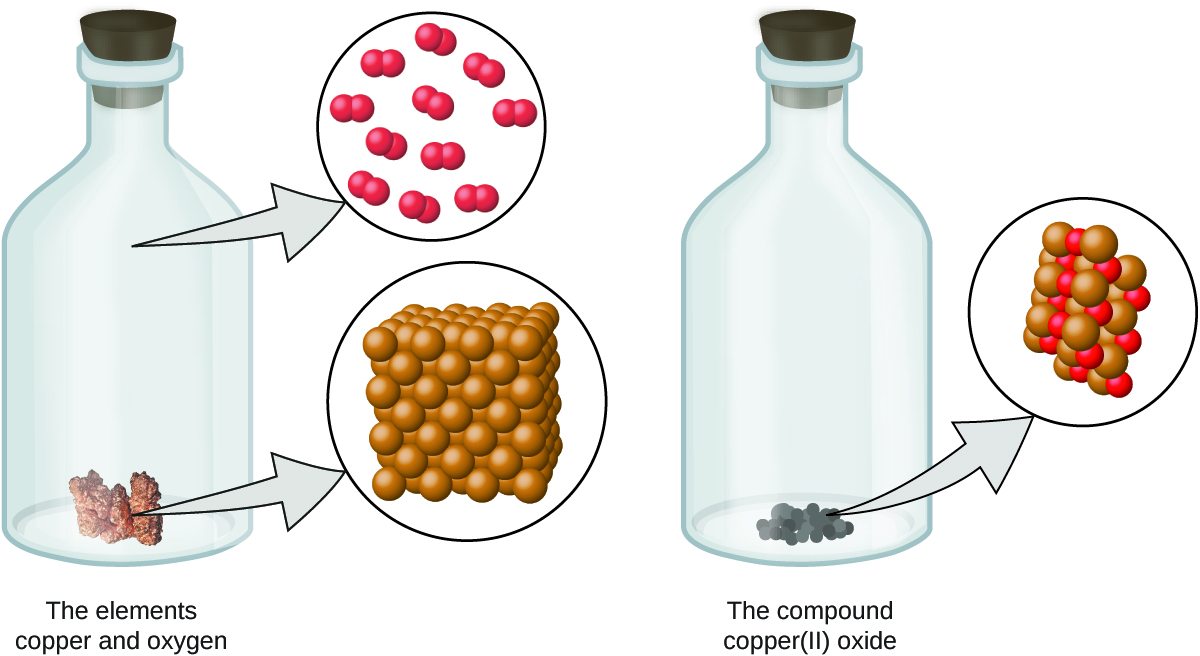
La teoría atómica de Dalton da una explicación microscópica de las muchas propiedades macroscópicas de la materia de la cual ha aprendido sobre. Por ejemplo, si un elemento como el cobre consiste en solo un tipo de átomo, entonces no se puede descomponer en sustancias más simples, es decir, en sustancias compuestas de menos tipos de átomos, y si los átomos no se crean ni se destruyen durante un cambio químico, la masa total de la materia presente cuando la materia cambia de un tipo a otro permanecerá constante (la ley de conservación de la materia).
Ejemplo \(\PageIndex{1}\): Probando la Teoría Atómica de Dalton
En el siguiente dibujo, las esferas verdes representan átomos de un cierto elemento. Las esferas azules representan átomos de otro elemento. Si las esferas tocan, son parte de una sola unidad de un compuesto. ¿El siguiente cambio químico representado por estos símbolos viola alguna de las ideas de la teoría atómica de Dalton? ¿Si es así, Cuál?
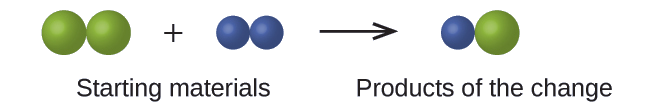
Solución
Los materiales del empiezo consisten en dos esferas verdes y dos esferas azules. Los productos consisten en una sola esfera verde y una esfera azul. Esto viola el postulado de Dalton de que los átomos no se crean ni se destruyen durante un cambio químico, sino que simplemente se redistribuyen. (En este caso, los átomos parecen haber sido destruidos.)
Ejercicio \(\PageIndex{1}\)
En el siguiente dibujo, las esferas verdes representan átomos de un cierto elemento. Las esferas moradas representan átomos de otro elemento. Si las esferas se tocan, son parte de una sola unidad de un compuesto. ¿El siguiente cambio químico representado por estos símbolos viola alguna de las ideas de la teoría atómica de Dalton? ¿Si es así, Cuál?

- Respuesta
-
Los materiales de empiezo consisten en cuatro esferas verdes y dos esferas moradas. Los productos consisten en cuatro esferas verdes y dos esferas moradas. Esto no viola ninguno de los postulados de Dalton: los átomos no se crean ni se destruyen, sino que se redistribuyen en proporciones de números enteros pequeños.
Dalton sabía de los experimentos del químico francés Joseph Proust, quien demostró que todas las muestras de un compuesto puro contienen los mismos elementos en masa en la misma proporción. Esta declaración se conoce como la ley de proporciones definidas o la ley de composición constante. La sugerencia de que los números de átomos de los elementos en un compuesto siempre existen en la misma proporción es consistente con estas observaciones. Por ejemplo, cuando se analizan diferentes muestras de isooctano (un componente de la gasolina y uno de los estándares usado en el sistema de clasificación de octano), se encuentra que tienen una relación de masa de carbono a hidrógeno de 5.33: 1, como se muestra en Tabla \(\PageIndex{1}\).
| Muestra | Carbono | Hidrógeno | Relación de Masa |
|---|---|---|---|
| A | 14,82 g | 2,78 g | \(\mathrm{\dfrac{14.82\: g\: carbon}{2.78\: g\: hydrogen}=\dfrac{5.33\: g\: carbon}{1.00\: g\: hydrogen}}\) |
| B | 22,33 g | 4,19 g | \(\mathrm{\dfrac{22.33\: g\: carbon}{4.19\: g\: hydrogen}=\dfrac{5.33\: g\: carbon}{1.00\: g\: hydrogen}}\) |
| C | 19,40 g | 3,64 g | \(\mathrm{\dfrac{19.40\: g\: carbon}{3.63\: g\: hydrogen}=\dfrac{5.33\: g\: carbon}{1.00\: g\: hydrogen}}\) |
Vale la pena observando que aunque en general todas las muestras de un compuesto particular tienen la misma proporción de masa, lo contrario no es cierto. Es decir, las muestras que tienen la misma relación de masa no son necesariamente la misma sustancia. Por ejemplo, hay muchos otros compuestos además del isooctano que también tienen una relación de masa de carbono a hidrógeno de 5.33: 1.00.
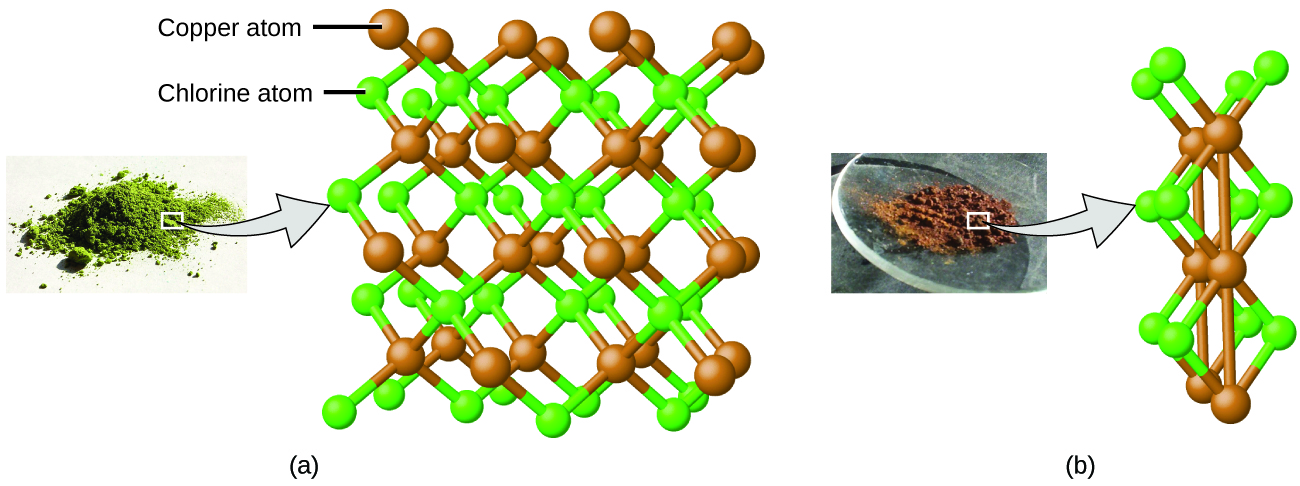
Dalton usó los datos de Proust, también uso los resultados de sus propios experimentos, para formular otra ley interesante. La ley de proporciones múltiples dice que cuando dos elementos reaccionan para formar más de un compuesto, una masa fija de un elemento reaccionará con la masa del otro elemento en una proporción de números enteros pequeños. Por ejemplo, el cobre y el cloro pueden formar un sólido verde cristalino con una relación de masa de 0,558 g de cloro por 1 g de cobre, también como un sólido marrón cristalino con una relación de masa de 1,116 g de cloro por 1 g de cobre. Estas relaciones pueden parecer que no son particularmente interesantes o informativas; pero, sin embargo, si tomamos una proporción de estas relaciones, obtenemos un resultado útil y posiblemente sorprendente: una proporción pequeña de números enteros.
\[\mathrm{\dfrac{\dfrac{1.116\: g\: Cl}{1\: g\: Cu}}{\dfrac{0.558\: g\: Cl}{1\: g\: Cu}}=\dfrac{2}{1}}\]
Esta relación de 2 a 1 significa que el compuesto de color marrón tiene dos veces más de cloro por cantidad de cobre que el compuesto verde.
Esto se puede explicar por la teoría atómica, si la relación de cobre a cloro en el compuesto marrón es de 1 átomo de cobre a 2 átomos de cloro, y la relación en el compuesto verde es de 1 átomo de cobre a 1 átomo de cloro. La proporción de átomos de cloro (y, por tanto, la proporción de sus masas) es de 2 a 1. (Figura \(\PageIndex{4}\)).
Ejemplo \(\PageIndex{2}\): LEYES DE PROPORCIONES DEFINITIVAS Y MULTIPLES
Se analiza una muestra del compuesto A (un gas transparente y sin color) que contiene 4,27 g de carbono y 5,69 g de oxígeno. Se analiza una muestra de compuesto B (también un gas transparente y sin color) que contiene 5,19 g de carbono y 13,84 g de oxígeno. ¿Estos datos son un ejemplo de la ley de proporciones definidas, la ley de proporciones múltiples, o ninguna? ¿Qué le dicen estos datos sobre las sustancias A y B?
Solución
En compuesto A, la relación de masa de carbono a oxígeno es:
\[\mathrm{\dfrac{1.33\: g\: O}{1\: g\: C}} \nonumber\]
En compuesto B, la relación de masa de carbono a oxígeno es:
\[\mathrm{\dfrac{2.67\: g\: O}{1\: g\: C}} \nonumber\]
La relación de estas proporciones es:
\[\mathrm{\dfrac{\dfrac{1.33\: g\: O}{1\: g\: C}}{\dfrac{2.67\: g\: O}{1\: g\: C}}=\dfrac{1}{2}} \nonumber\]
Esto apoya la ley de proporciones múltiples. Esto significa que A y B son compuestos diferentes, A tiene la mitad de carbono por cantidad de oxígeno (o el doble de oxígeno por cantidad de carbono) que B. Un posible par de compuestos que podrían ser esta relación serían A = CO2 y B = CO.
Ejercicio \(\PageIndex{1}\)
Se analiza una muestra de compuesto X (un líquido transparente, sin color, combustible con un olor notable) y se encuentra que contiene 14,13 g de carbono y 2,96 g de hidrógeno. Se analiza una muestra del compuesto Y (un líquido transparente, sin color, combustible con un olor notable que es un poco diferente del olor de X) y se encuentra que contiene 19,91 g de carbono y 3,34 g de hidrógeno. ¿Estos datos son un ejemplo de la ley de proporciones definidas, la ley de proporciones múltiples, o ninguna? ¿Qué le dicen estos datos sobre las sustancias X e Y?
- Respuesta
-
En el compuesto X, la relación de masa de carbono a hidrógeno es \(\mathrm{\dfrac{14.13\: g\: C}{2.96\: g\: H}}\).
En el compuesto Y, la relación de masa de carbono a oxígeno es \(\mathrm{\dfrac{19.91\: g\: C}{3.34\: g\: H}}\).
La relación de estas relaciones es:
\[\mathrm{\dfrac{\dfrac{14.13\: g\: C}{2.96\: g\: H}}{\dfrac{19.91\: g\: C}{3.34\: g\: H}}=\dfrac{4.77\: g\: C/g\: H}{5.96\: g\: C/g\: H}=0.800=\dfrac{4}{5}}. \nonumber\]
Esta pequeña proporción de números enteros apoya la ley de proporciones múltiples. Esto significa que X e Y son compuestos diferentes.
Resumen
Los griegos antiguos propusieron que la materia consistía en partículas muy pequeñas llamadas átomos. Dalton postuló que cada elemento tenía un tipo de átomo característico que tenía propiedades diferentes que de los átomos de todos los demás elementos, y que los átomos de diferentes elementos se podían combinar en relaciones de números enteros, pequeños, y fijos para formar compuestos. Las muestras de un compuesto particular tienen todas las mismas proporciones elementales en masa. Además, Cuando dos elementos forman compuestos diferentes, una masa dada de un elemento se combinará con la masa del otro elemento en una pequeña proporción de números enteros. Durante cualquier cambio químico, los átomos no sea crean ni destruyen.
Glosario
- La Teoría Atómica de Dalton
- Conjunto de postulados que establecieron las propiedades fundamentales de los átomos.
- ley de composición constante
- (también, ley de proporciones definidas) Todas las muestras de un compuesto puro contienen los mismos elementos en las mismas proporciones en masa.
- ley de múltiples proporciones
- Cuando dos elementos reaccionan para formar más de un compuesto, una masa fija de un elemento reaccionará con masas del otro elemento en una proporción de números enteros pequeños.
- ley de proporciones definidas
- (también, ley de composición constante) Todas las muestras de un compuesto puro contienen los mismos elementos en las mismas proporciones en masa.
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


