20.2: Los hidrocarburos
- Page ID
- 1972
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Habilidades para desarrollar
- Explicar la importancia de los hidrocarburos y la razón por su diversidad
- Nombrar los hidrocarburos saturados e insaturados y moléculas derivadas de ellos
- Describir las reacciones características de los hidrocarburos saturados e insaturados
- Identificar los isómeros estructurales y geométricos de los hidrocarburos
La mayor base de datos1 de compuestos orgánicos lista alrededor de 10 millones de sustancias, que incluyen los compuestos que se originan en los organismos vivos y los sintetizados por químicos. El número de compuestos orgánicos potenciales se ha estimado2 en 1060, un número astronómicamente alto. La existencia de tantas moléculas orgánicas es una consecuencia de la capacidad de los átomos de carbono para formar hasta cuatro enlaces fuertes con otros átomos de carbono, lo que resulta en cadenas y anillos de diferentes tamaños, formas y complejidades.
Los compuestos orgánicos más simples contienen solo los elementos carbono e hidrógeno, y se llaman hidrocarburos. Aunque están hechos de solo dos tipos de átomos, existe una extensa variedad de hidrocarburos porque pueden consistir en cadenas de diferentes longitudes y anillos de átomos de carbono, o combinaciones de estas estructuras. Además, los hidrocarburos pueden diferir en los tipos de enlaces carbono-carbono presentes en sus moléculas. Muchos hidrocarburos se encuentran en plantas, animales y sus fósiles; otros hidrocarburos se han preparado en el laboratorio. Usamos hidrocarburos todos los días, principalmente como combustibles, como gas natural, acetileno, propano, butano y los principales componentes de la gasolina, el diesel y el aceite de calefacción. Los plásticos familiares como el polietileno, polipropileno y poliestireno también son hidrocarburos. Podemos distinguir varios tipos de hidrocarburos por las diferencias en los enlaces entre los átomos de carbono. Esto causa diferencias en las geometrías y en la hibridación de los orbitales de carbono.
Los alcanos
Los alcanos, o hidrocarburos saturados, contienen solo enlaces covalentes simples entre átomos de carbono. Cada uno de los átomos de carbono de un alcano tiene orbitales híbridos sp3 y está unido a otros cuatro átomos, cada uno de los cuales es carbono o hidrógeno. Las estructuras de Lewis y los modelos de metano, etano y pentano se ilustran en la Figura \(\PageIndex{1}\). Las cadenas de carbono generalmente se dibujan como líneas rectas en las estructuras de Lewis, pero hay que recordar que las estructuras de Lewis no se usan para indicar la geometría de las moléculas. Observe que los átomos de carbono en los modelos estructurales (los modelos de bola y palo y de relleno de espacio) de la molécula de pentano no se encuentran en línea recta. Debido a la hibridación sp3, los ángulos de enlace en las cadenas de carbono están cerca de 109.5 °, lo que produce estas cadenas en un alcano una forma de zigzag.
Las estructuras de los alcanos y otras moléculas orgánicas también se pueden representar de una manera menos detallada usando las fórmulas estructurales condensadas (o simplemente fórmulas condensadas). En lugar del formato normal de las fórmulas químicas en las que cada símbolo de elemento aparece una sola vez, se escribe una fórmula condensada para indicar el enlace en la molécula. Estas fórmulas tienen la apariencia de una estructura de Lewis de la que se han eliminado la mayoría o todos los símbolos de enlace. Las fórmulas estructurales condensadas para el etano y pentano se muestran en la parte inferior de la Figura \(\PageIndex{1}\), y se dan varios ejemplos adicionales en los ejercicios al final de este capítulo.
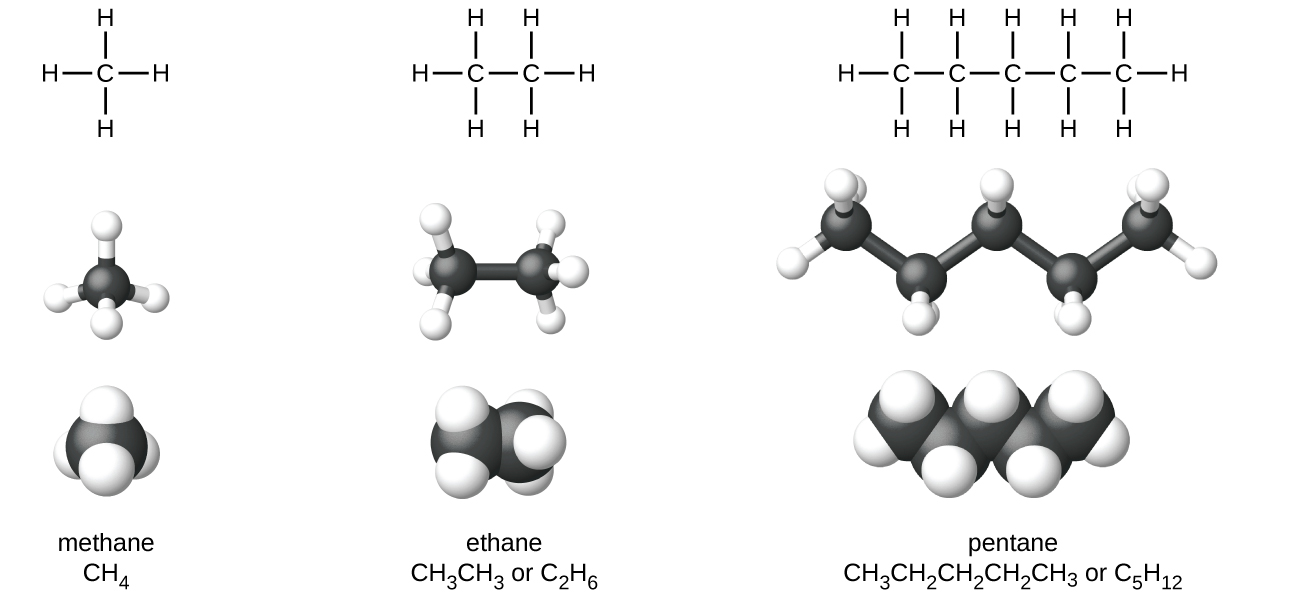
Figura \(\PageIndex{1}\): En la imagen se muestran las estructuras de Lewis, los modelos de bolas y palos y los modelos de llenado de espacio para las moléculas de metano, etano y pentano.
Un método común usado por los químicos orgánicos para simplificar los dibujos de moléculas más grandes es usar una estructura esquelética (también llamada una estructura de líneas y ángulos). En este tipo de estructura, los átomos de carbono no están simbolizados con una C, sino que están representados por cada extremo de una línea o curva en una línea. Los átomos de hidrógeno no se dibujan si están unidos a un carbono. Otros átomos además del carbono y el hidrógeno están representados por sus símbolos elementales. La figura \(\PageIndex{2}\) muestra tres formas diferentes de dibujar la misma estructura.
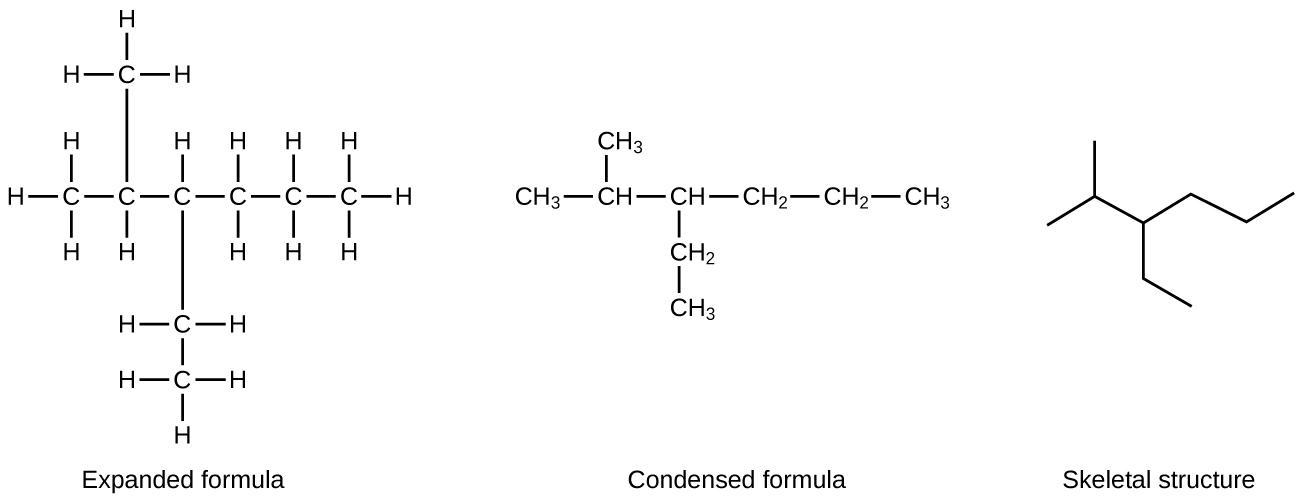
Figura \(\PageIndex{2}\): La misma estructura se puede representar de tres formas diferentes: una fórmula expandida, una fórmula condensada y una estructura esquelética.
Ejemplo \(\PageIndex{1}\)
Dibujando estructuras esqueléticas:
Dibuje las estructuras esqueléticas para estas dos moléculas:
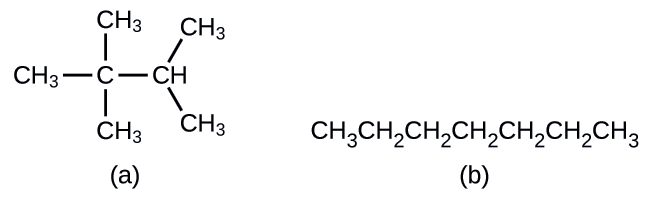
Solución
Cada átomo de carbono se convierte en el final de una línea o en el lugar donde las líneas se cruzan. Todos los átomos de hidrógeno unidos a los átomos de carbono quedan fuera de la estructura (aunque todavía debemos reconocer que están allí):
Ejercicio \(\PageIndex{1}\)
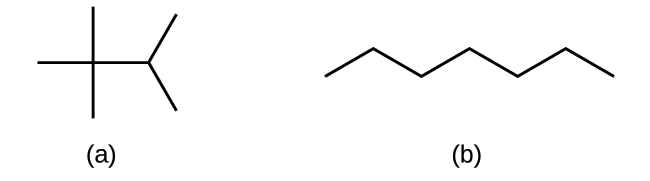
Dibuja las estructuras esqueléticas de estas dos moléculas:

- Respuesta
-

Ejemplo \(\PageIndex{2}\)
La interpretación de estructuras esqueléticas:
Identifique la fórmula química de la molécula representada aquí:
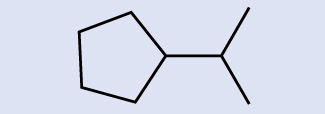
Solución
Hay ocho lugares donde las líneas se cruzan o terminan, lo que significa que hay ocho átomos de carbono en la molécula. Ya que sabemos que los átomos de carbono tienden a formar cuatro enlaces, cada átomo de carbono tendrá la cantidad de átomos de hidrógeno necesarios para cuatro enlaces. Este compuesto contiene 16 átomos de hidrógeno para una fórmula molecular de C8H16.
La ubicación de los átomos de hidrógeno:
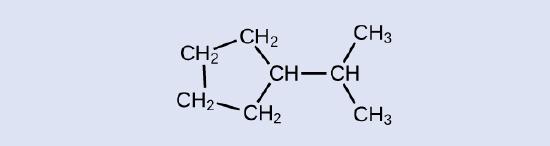
Ejercicio \(\PageIndex{2}\)
Identifique la fórmula química de la molécula representada aquí:
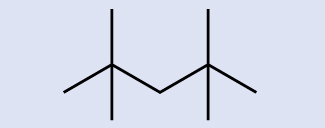
- Respuesta
-
C9H20
Todos los alcanos están hechos de átomos de carbono e hidrógeno y tienen enlaces, estructuras y fórmulas similares; todos los alcanos no cíclicos tienen una fórmula de CnH2n+2. No hay un límite en el número de átomos de carbono presentes en un alcano. Un mayor número de átomos en las moléculas causará atracciones intermoleculares más fuertes (fuerzas de dispersión) y, en consecuencia, diferentes propiedades físicas de las moléculas. Propiedades como el punto de fusión y el punto de ebullición (Tabla \(\PageIndex{1}\)) generalmente cambian de manera uniforme y predecible a medida que cambia el número de átomos de carbono e hidrógeno en las moléculas.
| Alcano | Fórmula molecular | Punto de fusión (°C) | Punto de ebullición (°C) | Fases a STP4 | Número de isómeros estructurales |
|---|---|---|---|---|---|
| metano | CH4 | –182.5 | –161.5 | gas | 1 |
| etano | C2H6 | –183.3 | –88.6 | gas | 1 |
| propano | C3H8 | –187.7 | –42.1 | gas | 1 |
| butano | C4H10 | –138.3 | –0.5 | gas | 2 |
| pentano | C5H12 | –129.7 | 36.1 | liquido | 3 |
| hexano | C6H14 | –95.3 | 68.7 | liquido | 5 |
| heptano | C7H16 | –90.6 | 98.4 | liquido | 9 |
| octano | C8H18 | –56.8 | 125.7 | liquido | 18 |
| nonano | C9H20 | –53.6 | 150.8 | liquido | 35 |
| decano | C10H22 | –29.7 | 174.0 | liquido | 75 |
| tetradecano | C14H30 | 5.9 | 253.5 | solido | 1858 |
| octadecano | C18H38 | 28.2 | 316.1 | solido | 60,523 |
Los hidrocarburos con la misma fórmula, incluidos los alcanos, pueden tener diferentes estructuras. Por ejemplo, dos alcanos que tienen la fórmula C4H10: se llaman n-butano y 2-metilpropano (o isobutano), y tienen las siguientes estructuras de Lewis:
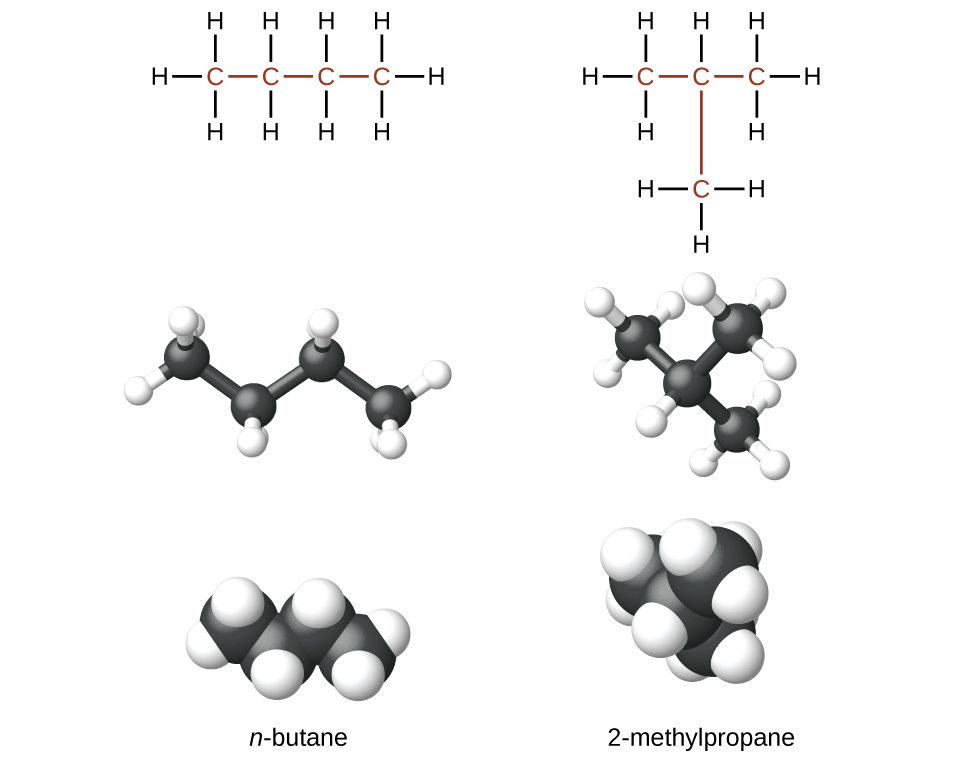
Los compuestos n-butano y 2-metilpropano son isómeros estructurales (a veces también se usa el término isómeros constitucionales). Los isómeros constitucionales tienen la misma fórmula molecular pero diferentes disposiciones espaciales de los átomos en sus moléculas. La molécula de n-butano contiene una cadena no ramificada, esto significa que ningún átomo de carbono está unido a más de otros dos átomos de carbono. Usamos el término normal, o el prefijo n, para referirnos a una cadena de átomos de carbono sin ramificación. El compuesto 2-metilpropano tiene una cadena ramificada (el átomo de carbono en el centro de la estructura de Lewis está unido a otros tres átomos de carbono).
Identificando los isómeros a partir de sus estructuras de Lewis no es tan fácil como parece. Las estructuras de Lewis que se ven diferentes pueden representar en realidad los mismos isómeros. Por ejemplo, las tres estructuras en la Figura \(\PageIndex{3}\) todas representan la misma molécula, n-butano, y por lo tanto no son isómeros diferentes. Son idénticos porque cada uno contiene una cadena no ramificada de cuatro átomos de carbono.
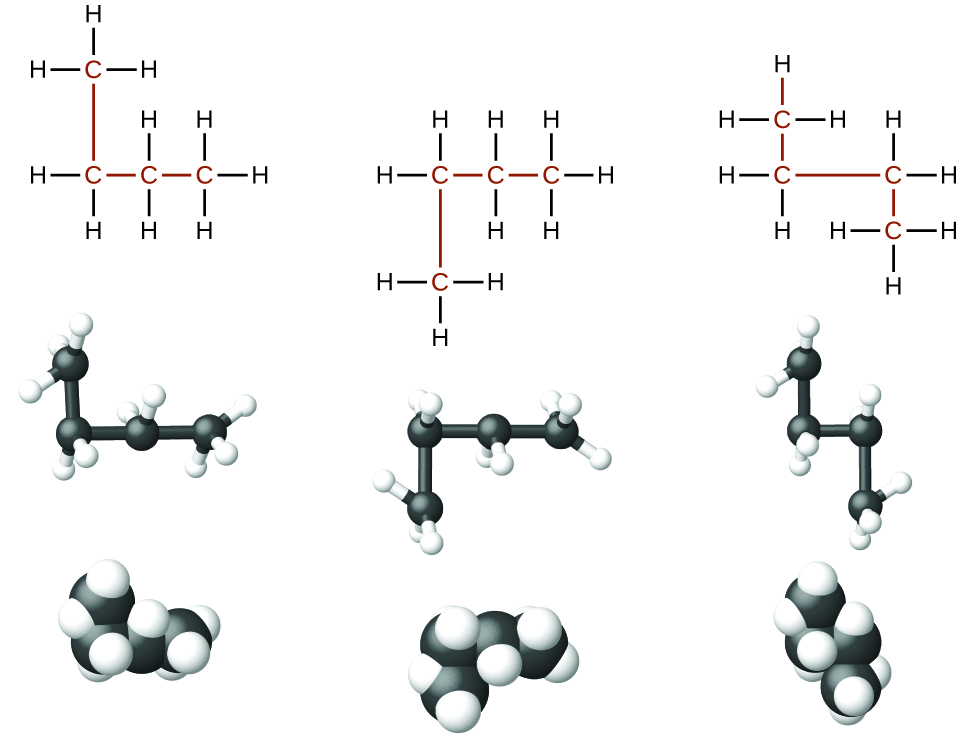
Figura \(\PageIndex{3}\): Estas tres representaciones de la estructura del n-butano no son isómeros porque todas contienen la misma disposición de átomos y enlaces.
Los fundamentos de la nomenclatura orgánica: nombrando los alcanos
La Unión Internacional de Química Pura y Aplicada (IUPAC) ha hecho un sistema de nomenclatura que comienza con los nombres de los alcanos y se puede ajustar a partir de ahí para dar cuenta de estructuras más complicadas. La nomenclatura de los alcanos se basa en dos reglas:
- Para nombrar un alcano, primero identifique la cadena más larga de átomos de carbono en su estructura. Una cadena de dos carbonos se llama etano; una cadena de tres carbonos, propano; y una cadena de cuatro carbonos, butano. Las cadenas más largas se llaman de la siguiente manera: pentano (cadena de cinco carbonos), hexano (6), heptano (7), octano (8), nonano (9) y decano (10). Estos prefijos se pueden ver en los nombres de los alcanos descritos en la Tabla \(\PageIndex{1}\).
- Agregue prefijos al nombre de la cadena más larga para indicar las posiciones y los nombres de los sustituyentes. Los sustituyentes son ramas o grupos funcionales que reemplazan los átomos de hidrógeno en una cadena. La posición de un sustituyente o rama se identifica por el número del átomo de carbono al que está unido en la cadena. Numeramos los átomos de carbono de la cadena contando desde el extremo de la cadena más cercano a los sustituyentes. Los sustituyentes múltiples se nombran individualmente y se colocan en orden alfabético al principio del nombre.
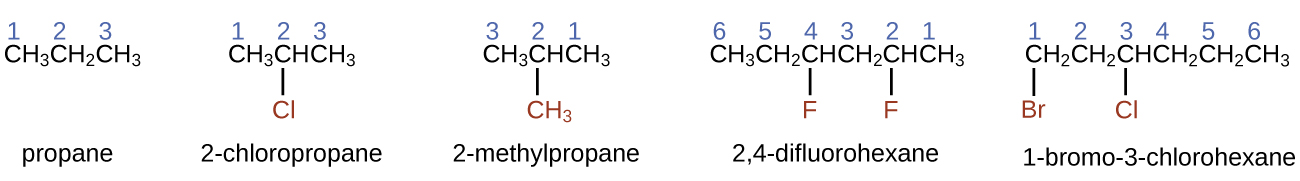
Cuando está presente más de un sustituyente, ya sea en el mismo átomo de carbono o en diferentes átomos de carbono, los sustituyentes se listan alfabéticamente. Debido a que la numeración de los átomos de carbono comienza en el extremo más cercano a un sustituyente, la cadena más larga de átomos de carbono se numera de tal manera que se produzca el número más bajo de sustituyentes. La terminación -o reemplaza -uro al final del nombre de un sustituyente electronegativo (en compuestos iónicos, el ión cargado negativamente termina con -uro como cloruro; en compuestos orgánicos, dichos átomos se tratan como sustituyentes y se usa la terminación -o). El número de sustituyentes del mismo tipo se indica mediante los prefijos di- (dos), tri- (tres), tetra- (cuatro), etc. (por ejemplo, difluoro- indica dos sustituyentes de fluoruro).
Ejemplo \(\PageIndex{3}\): Nombrando sustituidos con halógenos
Nombre la molécula cuya estructura se muestra aquí:
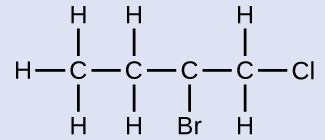
Solución
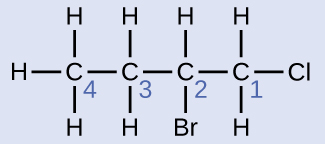
La cadena de cuatro carbonos está numerada desde el final con el átomo de cloro. Esto coloca a los sustituyentes en las posiciones 1 y 2 (la numeración desde el otro extremo colocaría los sustituyentes en las posiciones 3 y 4). Cuatro átomos de carbono significan que el nombre base de este compuesto será butano. El bromo en la posición 2 se describe agregando 2-bromo-; esto viene al comienzo del nombre, ya que el bromo- viene antes de cloro- alfabéticamente. El cloro en la posición 1 se describe agregando 1-cloro-, dando como resultado que el nombre de la molécula sea 2-bromo-1-clorobutano.
Ejercicio \(\PageIndex{3}\)
Nombre la siguiente molécula:
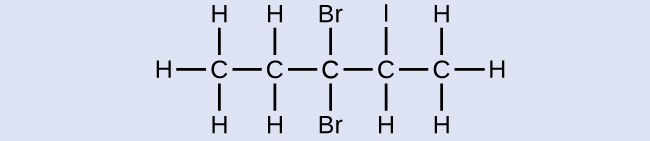
- Respuesta
-
3,3-dibromo-2-yodopentano
Llamamos a un sustituyente que contiene un hidrógeno menos que el alcano correspondiente un alquilo. El nombre de un grupo alquilo se obtiene eliminando el sufijo -ano del nombre del alcano y agregando -lo:
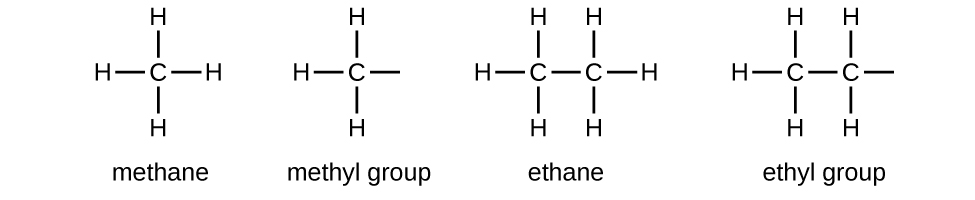
Los enlaces abiertos en los grupos metilo y etilo indican que estos grupos alquilo están unidos a otro átomo.
Ejemplo \(\PageIndex{4}\) Nombrando los alcanos sustituidos
Nombre la molécula cuya estructura se muestra aquí:
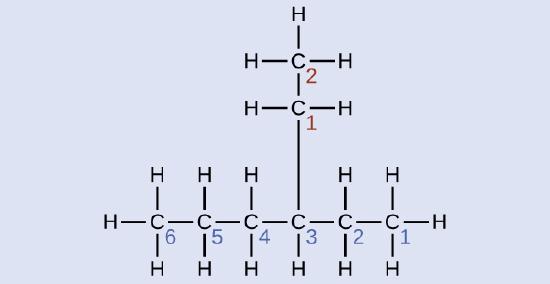
Solución
La cadena de carbono más larga pasa horizontalmente a lo largo de la página y contiene seis átomos de carbono (esto hace que la base del nombre sea hexano, pero también necesitaremos incorporar el nombre de la rama). En este caso, queremos numerar desde la derecha hacia la izquierda (como lo muestran los números azules) para que la rama esté conectada al carbono 3 (imagine los números de izquierda a derecha; esto pondría la rama en el carbono 4, violando nuestras reglas). La rama adjunta a la posición 3 de nuestra cadena contiene dos átomos de carbono (numerados en rojo), por eso tomamos nuestro nombre para dos carbonos eti y adjuntamos -ano al final para significar que estamos describiendo una rama. Juntando todas las piezas, esta molécula es 3-etilhexano.
Ejercicio \(\PageIndex{4}\)
Nombre la siguiente molécula:
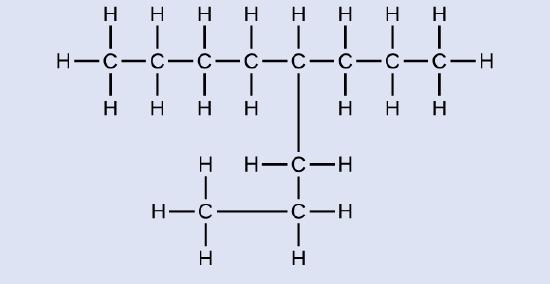
- Respuesta
-
4-propiloctano
Algunos hidrocarburos pueden formar más de un tipo de grupo alquilo cuando los átomos de hidrógeno que se eliminarían tienen diferentes "ambientes" en la molécula. Esta diversidad de posibles grupos alquilo se puede identificar de la siguiente manera: Los cuatro átomos de hidrógeno en una molécula de metano son equivalentes; todos tienen el mismo ambiente. Son equivalentes porque cada uno está unido a un átomo de carbono (el mismo átomo de carbono) que está unido a tres átomos de hidrógeno. (Puede ser más fácil ver la equivalencia en los modelos de bola y palo en la Figura \(\PageIndex{3}\). La eliminación de cualquiera de los cuatro átomos de hidrógeno del metano forma un grupo metilo. Del mismo modo, los seis átomos de hidrógeno en el etano son equivalentes y la eliminación de cualquiera de estos átomos de hidrógeno produce un grupo etilo. Cada uno de los seis átomos de hidrógeno está unido a un átomo de carbono que está unido a otros dos átomos de hidrógeno y un átomo de carbono. Sin embargo, tanto en el propano como en el 2-metilpropano , hay átomos de hidrógeno en dos ambientes diferentes, que se distinguen por los átomos o grupos de átomos adyacentes:
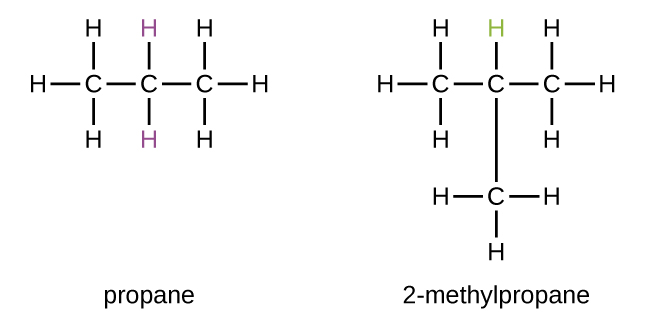
Cada uno de los seis átomos de hidrógeno equivalentes del primer tipo en el propano y cada uno de los nueve átomos de hidrógeno equivalentes de ese tipo en el 2-metilpropano (todos mostrados en negro) están unidos a un átomo de carbono que está unido solo a otro átomo de carbono. Los dos átomos de hidrógeno de color púrpura en el propano son de un segundo tipo. Se diferencian de los seis átomos de hidrógeno del primer tipo en que están unidos a un átomo de carbono unido a otros dos átomos de carbono. El átomo de hidrógeno verde en el 2-metilpropano difiere de los otros nueve átomos de hidrógeno en esa molécula y de los átomos de hidrógeno púrpura en el propano. El átomo de hidrógeno verde en el 2-metilpropano está unido a un átomo de carbono unido a otros tres átomos de carbono. Se pueden formar dos grupos alquilo diferentes a partir de cada una de estas moléculas, dependiendo de qué átomo de hidrógeno se elimine. Los nombres y estructuras de estos y varios otros grupos alquilo se enumeran en la Figura \(\PageIndex{4}\).
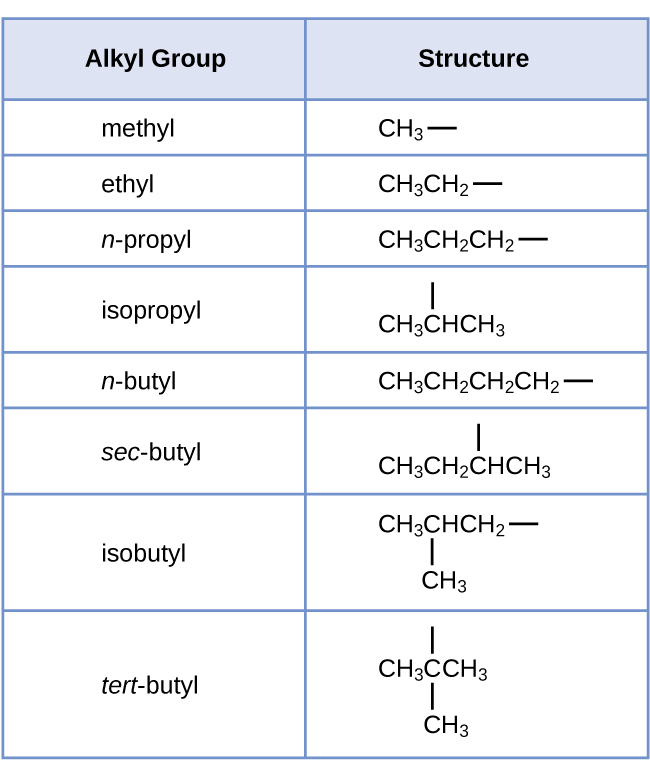
Figura \(\PageIndex{4}\): Esta lista da los nombres y fórmulas de varios grupos alquilo formados por la eliminación de átomos de hidrógeno de diferentes ubicaciones.
Tenga en cuenta que los grupos alquilo no existen como entidades independientes estables. Siempre son parte de alguna molécula más grande. La ubicación de un grupo alquilo en una cadena de hidrocarburo se indica de la misma manera que cualquier otro sustituyente:
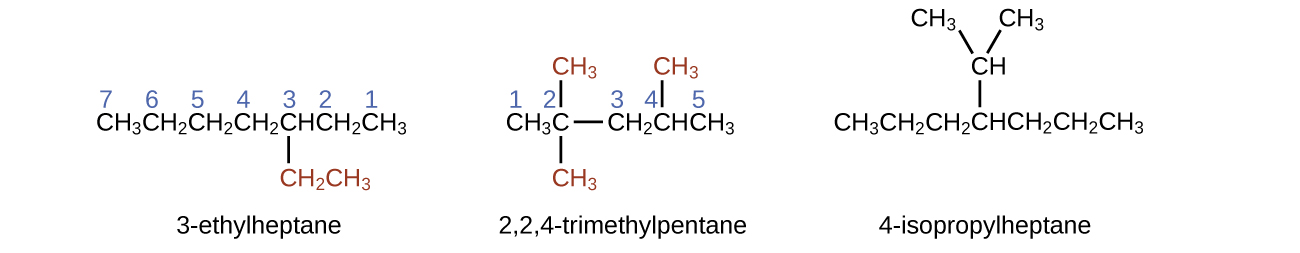
Los alcanos son moléculas relativamente estables, pero el calor o la luz activarán reacciones que involucran la ruptura de los enlaces simples C – H o C – C. La combustión es una de estas reacciones:
\[\ce{CH4}(g)+\ce{2O2}(g)⟶\ce{CO2}(g)+\ce{2H2O}(g)\]
Los alcanos se queman en la presencia del oxígeno, una reacción de oxidación-reducción muy exotérmica que produce el dióxido de carbono y el agua. Como consecuencia, los alcanos son excelentes combustibles. Por ejemplo, el metano, CH4, es el componente principal del gas natural. El butano, C4H10, usado en las estufas y los encendedores de camping es un alcano. La gasolina es una mezcla líquida de alcanos de cadena continua y ramificada, cada uno de los cuales contiene de cinco a nueve átomos de carbono, además de varios aditivos para mejorar su desempeño como combustible. El queroseno, el aceite diesel y el aceite combustible son principalmente mezclas de alcanos con masas moleculares más altas. La fuente principal de estos combustibles de alcanos líquidos es el petróleo crudo, una mezcla compleja que se separa usando la destilación fraccionada. La destilación fraccionada aprovecha las diferencias en los puntos de ebullición de los componentes de la mezcla (Figura \(\PageIndex{5}\)). Tal vez recuerde que el punto de ebullición es una función de las interacciones intermoleculares, que se discutió en el capítulo sobre las soluciones y los coloides.
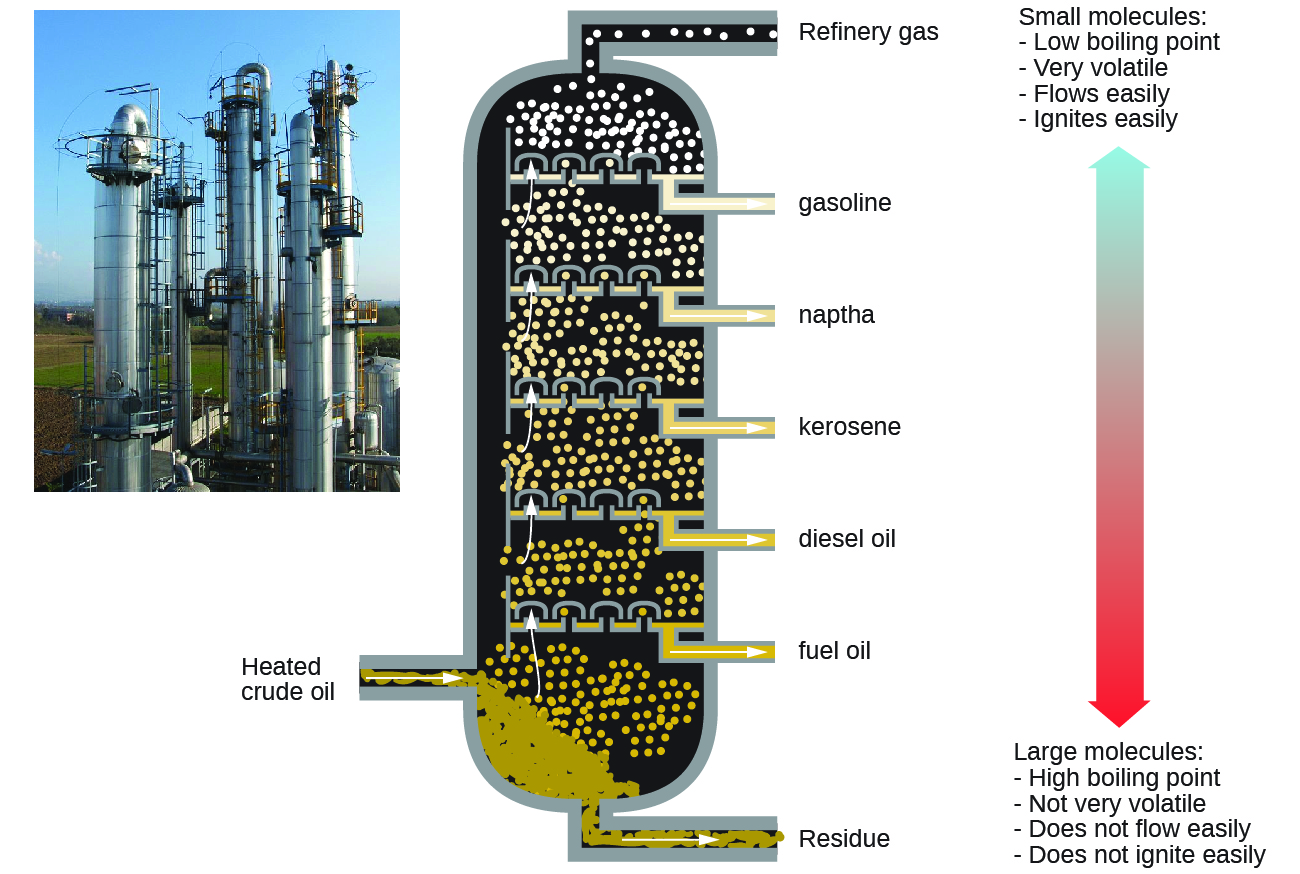
Figura \(\PageIndex{5}\):En una columna para la destilación fraccionada de petróleo crudo, el petróleo calentado a aproximadamente 425 °C en el horno se vaporiza cuando ingresa a la base de la torre. Los vapores se elevan a través de tapas de burbujas en una serie de bandejas de tapa de burbuja en la torre. A medida que los vapores se enfrían gradualmente, las fracciones de puntos de ebullición superiores y luego inferiores se condensan en líquidos y se eliminan. (crédito a la izquierda: modificación del trabajo de Luigi Chiesa)
En una reacción de sustitución, otra reacción típica de los alcanos, uno o más de los átomos de hidrógeno del alcano se reemplazan con un átomo o grupo de átomos diferente. No se rompen los enlaces carbono-carbono en estas reacciones y la hibridación de los átomos de carbono no cambia. Por ejemplo, la reacción entre el etano y el cloro molecular que se muestra aquí es una reacción de sustitución:
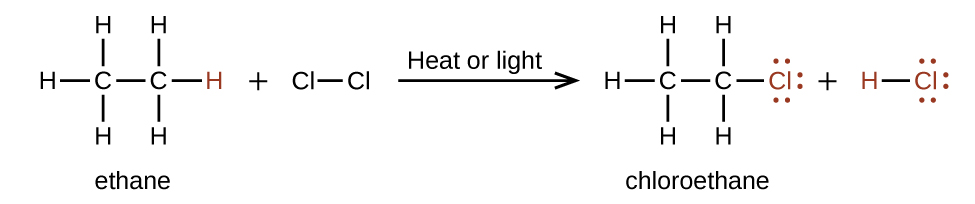
La porción C-Cl de la molécula de cloroetano es un ejemplo de un grupo funcional, la parte de una molécula que imparte una reactividad química específica. Los tipos de grupos funcionales presentes en una molécula orgánica son determinantes importantes de sus propiedades químicas y se usan como un medio para clasificar los compuestos orgánicos, como se detalla en las secciones restantes de este capítulo.
Los alquenos
Los compuestos orgánicos que contienen uno o más enlaces dobles o triples entre los átomos de carbono se describen como insaturados. Probablemente has oído hablar de las grasas insaturadas. Tiene que ver con las moléculas orgánicas complejas con largas cadenas de átomos de carbono, que contienen al menos un doble enlace entre los átomos de carbono. Las moléculas de hidrocarburos insaturados que contienen uno o más dobles enlaces se llaman los alquenos. Los átomos de carbono unidos por un doble enlace están unidos por dos enlaces, un enlace σ y un enlace π. Los enlaces dobles y triples producen una geometría diferente alrededor del átomo de carbono que participa en ellos, lo que genera importantes diferencias en la forma y propiedades moleculares. Las diferentes geometrías son responsables de las diferentes propiedades de las grasas insaturadas versus las saturadas.
El etileno, C2H4, es el alqueno más simple. Cada átomo de carbono en el eteno, comúnmente llamado el etileno, tiene una estructura plana trigonal. El segundo miembro de la serie es el propeno (propileno) (Figura \(\PageIndex{6}\)); los isómeros de buteno siguen en la serie. Cuatro átomos de carbono en la cadena del buteno permiten la formación de los isómeros según la posición del doble enlace, así como una nueva forma de isomería.
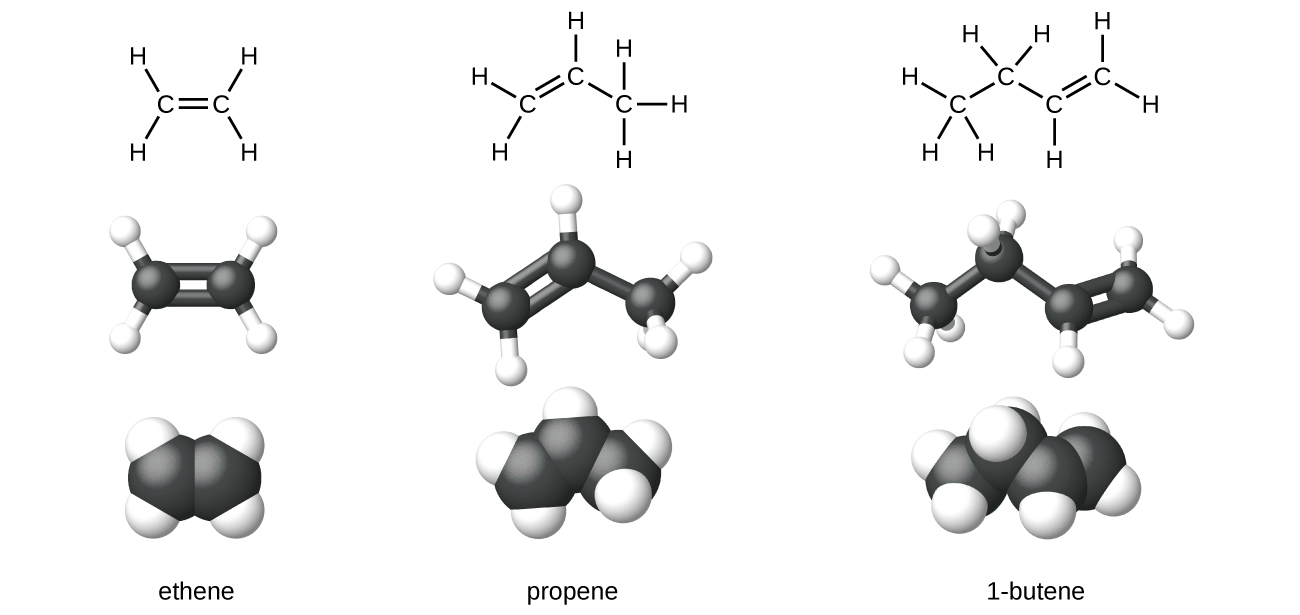
Figura \(\PageIndex{6}\): Se muestran las estructuras expandidas, las estructuras de bolas y palos y los modelos de relleno de espacio para los alquenos eteno, propeno y 1-buteno.
El etileno (el nombre industrial común del eteno) es una materia prima básica en la producción del polietileno y otros compuestos importantes. En 2010 se produjeron más de 135 millones de toneladas de etileno en todo el mundo para su uso en las industrias de polímeros, petroquímica y plásticos. El etileno se produce industrialmente usando un proceso llamado el craqueo, en el que las largas cadenas de hidrocarburos en una mezcla de petróleo se rompen para formar moléculas más pequeñas.
Reciclaje de plástico
Los polímeros (de las palabras griegas poli que significa "muchos" y mer que significa "partes") son moléculas grandes formadas por unidades repetidas, llamadas monómeros. Los polímeros pueden ser naturales (el almidón es un polímero de residuos de azúcar y las proteínas son polímeros de aminoácidos) o sintéticos [como el polietileno, cloruro de polivinilo (PVC) y poliestireno]. La variedad de estructuras de los polímeros causa varias propiedades y usos que los convierten en una parte integral de nuestra vida cotidiana. Agregar grupos funcionales a la estructura de un polímero puede resultar en propiedades significativamente diferentes (vea la discusión sobre Kevlar más adelante en este capítulo).
En la Figura \(\PageIndex{7}\) se muestra un ejemplo de una reacción de polimerización. El monómero etileno (C2H4) es un gas a temperatura ambiente, pero cuando se polimeriza, usando un catalizador de metal de transición, se transforma en un material sólido formado por largas cadenas de unidades –CH2– llamado polietileno. El polietileno es un plástico comercial que se usa principalmente para envases (bolsas y películas).
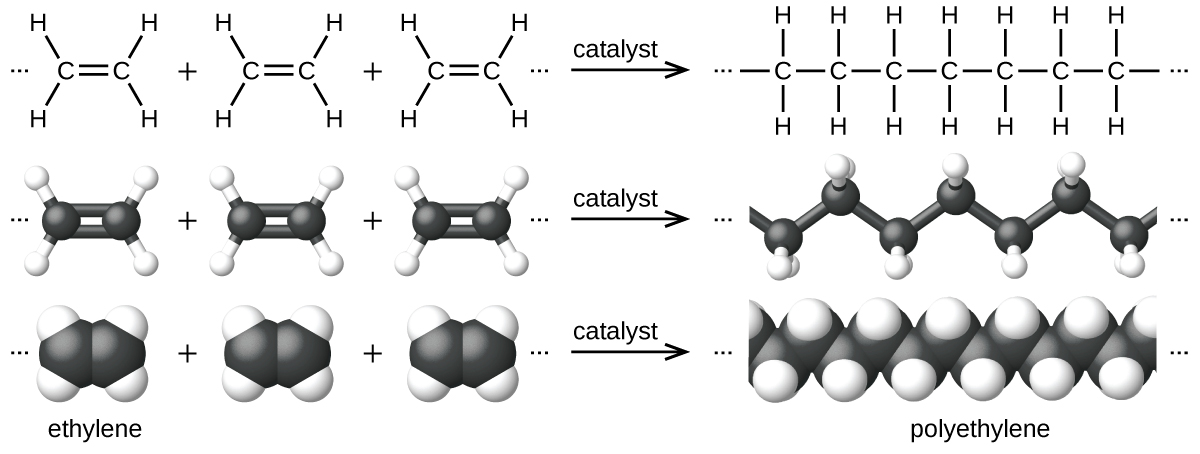
Figura \(\PageIndex{7}\): Se muestra la reacción para la polimerización del etileno a polietileno.
El polietileno es parte de un subconjunto de polímeros sintéticos clasificados como plásticos. Los plásticos son sólidos orgánicos sintéticos que se pueden moldear; normalmente son polímeros orgánicos con masas moleculares grandes. La mayoría de los monómeros que se encuentran en los plásticos comunes (etileno, propileno, cloruro de vinilo, estireno y tereftalato de etileno) se derivan de los productos petroquímicos y no son muy biodegradables, haciéndolos materiales candidatos para el reciclaje. El reciclaje de plásticos ayuda a minimizar la necesidad de usar más suministros petroquímicos y también minimiza el daño ambiental causado por el desecho de estos materiales no biodegradables.
El reciclaje de plástico es el proceso de recuperar basura, desechos o plásticos usados y reprocesar el material en productos útiles. Por ejemplo, el tereftalato de polietileno (botellas de refrescos) se puede fundir y usar para muebles hechos de plástico, alfombras o para otras aplicaciones. Otros plásticos, como el polietileno (bolsas) y el polipropileno (vasos, recipientes de plástico para alimentos), pueden reciclarse o reprocesarse para usarse otra vez. Muchas áreas del país tienen programas de reciclaje que se enfocan en uno o más de los plásticos básicos a los que se les ha asignado un código de reciclaje (Figura \(\PageIndex{8}\)). Estas operaciones han existido desde la década de 1970 y han convertido la producción de algunos plásticos entre las operaciones industriales más eficientes hoy en día.
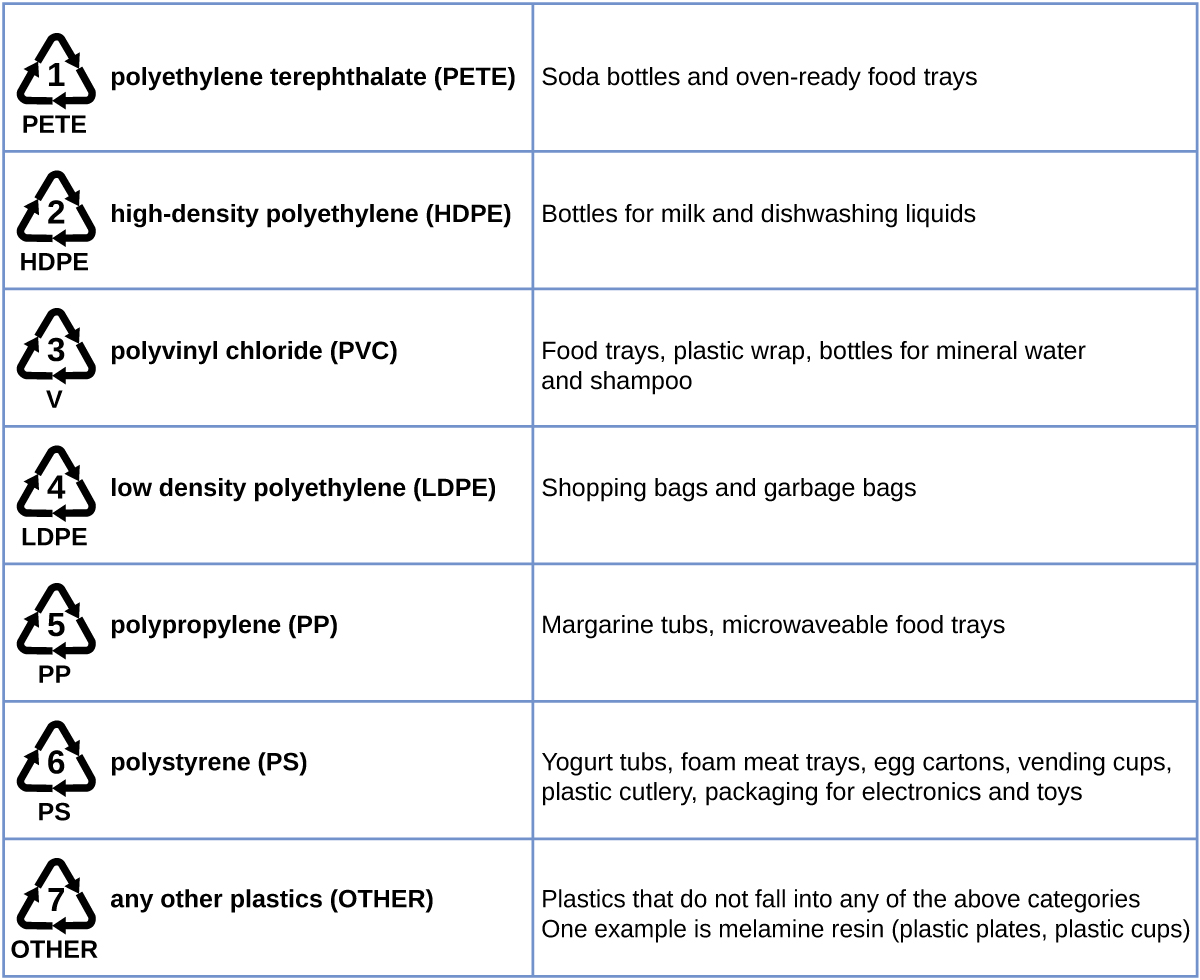
Figura \(\PageIndex{8}\): Cada tipo de plástico reciclable se imprime con un código para facilitar su identificación.
El nombre de un alqueno se deriva del nombre del alcano con el mismo número de átomos de carbono. La presencia del doble enlace se indica reemplazando el sufijo -ano por el sufijo -eno. La ubicación del doble enlace se identifica nombrando el menor de los números de átomos de carbono que participan en el doble enlace:
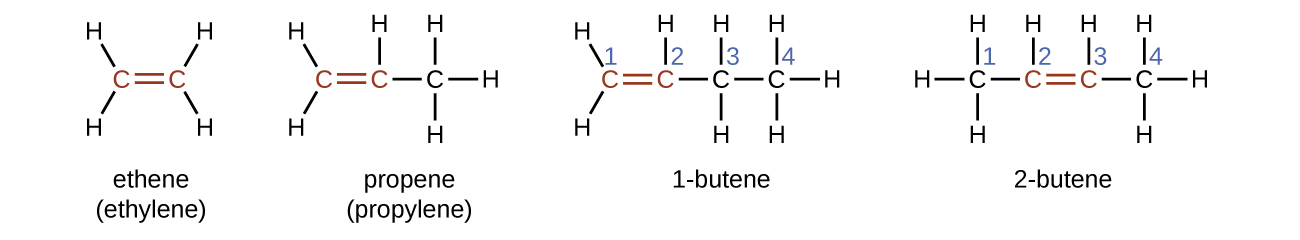
Los isómeros do los alquenos
Las moléculas de 1-buteno y 2-buteno son isómeros estructurales; la disposición de los átomos en estas dos moléculas es diferente. Como un ejemplo en las diferencias de la disposición, el primer átomo de carbono en 1-buteno está unido a dos átomos de hidrógeno; el primer átomo de carbono del 2-buteno está unido a tres átomos de hidrógeno.
El compuesto 2-buteno y algunos otros alquenos también forman un segundo tipo de isómero llamado un isómero geométrico. En un conjunto de isómeros geométricos, los mismos tipos de átomos están unidos entre sí en el mismo orden, pero las geometrías de las dos moléculas son diferentes. Los isómeros geométricos de los alquenos difieren en la orientación de los grupos a cada lado de un enlace \(\mathrm{C=C}\).
Los átomos de carbono pueden rotar libremente alrededor de un enlace sencillo, pero no alrededor de un enlace doble; un doble enlace es rígido. Esto hace posible que haiga dos isómeros de 2-buteno, uno con ambos grupos metilo en el mismo lado del doble enlace y otro con los grupos metilo en lados opuestos. Cuando se dibujan estructuras de buteno con ángulos de enlace de 120° alrededor de los átomos de carbono con hibridación sp2 que participan en el doble enlace, los isómeros son evidentes. El isómero 2-buteno en el que los dos grupos metilo están en el mismo lado se llama isómero cis; aquel en el que los dos grupos metilo están en lados opuestos se llama isómero trans (Figura \(\PageIndex{9}\)). Las diferentes geometrías producen diferentes propiedades físicas, como el punto de ebullición, que pueden hacer posible la separación de los isómeros:
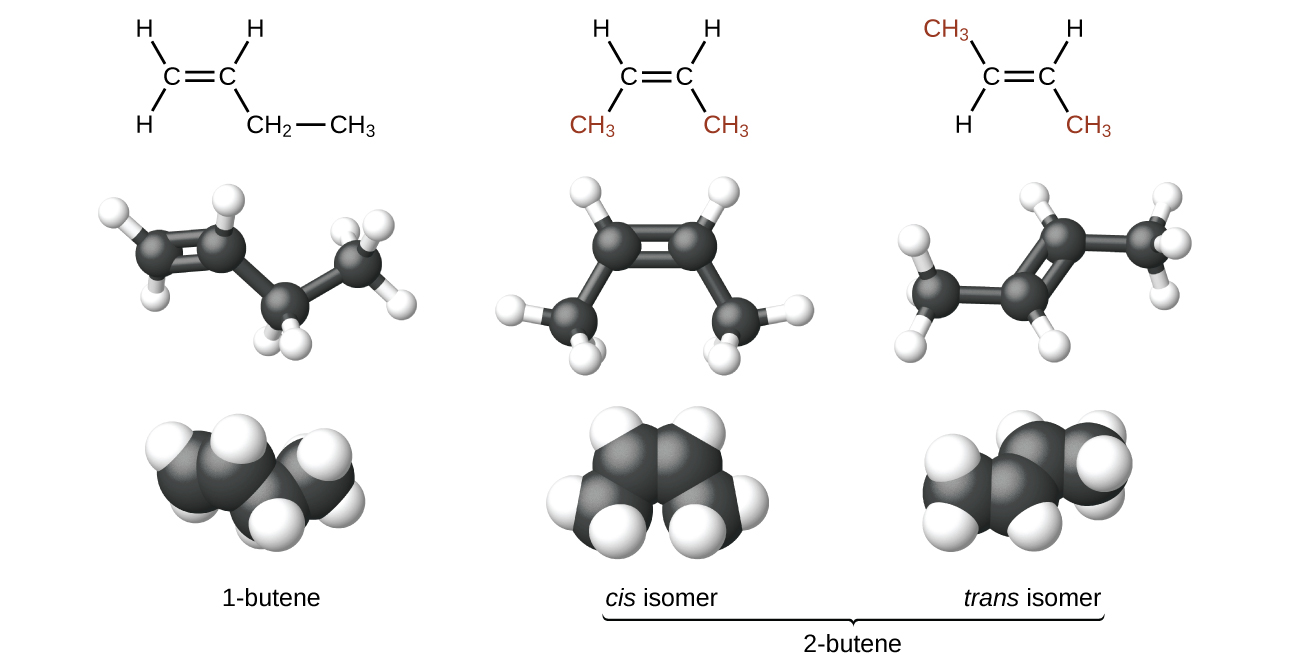
Figura \(\PageIndex{9}\): Estos modelos moleculares muestran los isómeros estructurales y geométricos del buteno.
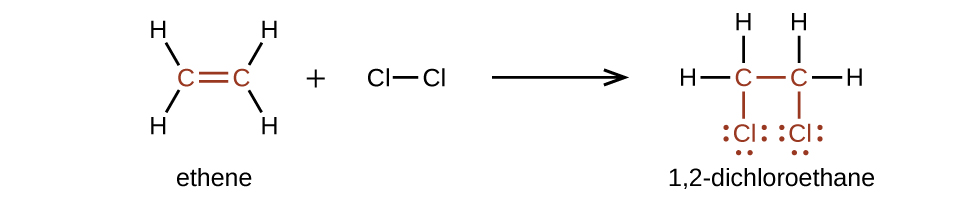
Los alquenos son mucho más reactivos que los alcanos porque \(\mathrm{C=C}\) es un grupo funcional reactivo. Un enlace π, que es un enlace más débil, se rompe mucho más fácilmente que un enlace σ. Por tanto, los alquenos experimentan una reacción característica en la que el enlace π se rompe y se reemplaza por dos enlaces σ. Esta reacción se llama una reacción de adición. La hibridación de los átomos de carbono en el doble enlace de un alqueno cambia de sp2 a sp3 durante una reacción de adición. Por ejemplo, los halógenos se agregan al doble enlace en un alqueno en lugar de reemplazar al hidrógeno, como ocurre en un alcano:
Ejemplo \(\PageIndex{5}\): La reactividad y denominación de los alquenos
Proporcione los nombres IUPAC para el reactivo y el producto de la reacción de halogenación que se muestra aquí:
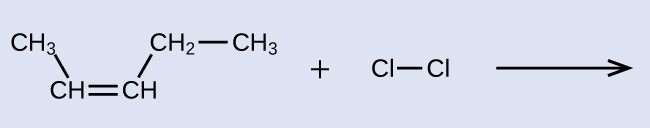
Solución
El reactivo es una cadena de cinco carbonos que contiene un doble enlace carbono-carbono, por eso el nombre base es penteno. Comenzamos a contar al final de la cadena más cercana al doble enlace, en este caso desde la izquierda, el doble enlace extiende desde los carbonos 2 y 3, por eso el nombre se convierte en 2-penteno. Dado que hay dos grupos que contienen carbono unidos a los dos átomos de carbono en el doble enlace, y están en el mismo lado del doble enlace, esta molécula es el isómero cis, lo que hace que el nombre del alqueno inicial sea cis-2- penteno. El producto de la reacción de halogenación tendrá dos átomos de cloro unidos a los átomos de carbono que formaban parte del doble enlace carbono-carbono:
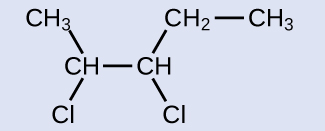
Ahora, esta molécula es un alcano sustituido y se denominará como tal. La base del nombre será pentano. Contaremos desde el final que numera los átomos de carbono donde están unidos los átomos de cloro como 2 y 3, formando el nombre del producto 2,3-dicloropentano.
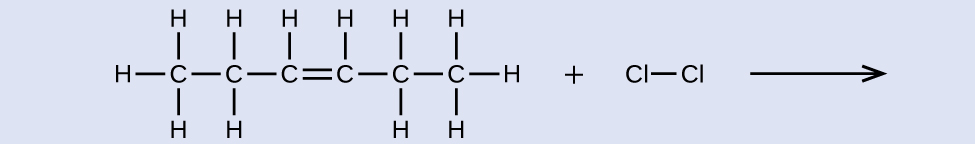
Ejercicio \(\PageIndex{5}\)
Nombre el reactivo y el producto de la reacción que se muestra aquí:
- Respuesta
-
reactivo: cis-3-hexeno, producto: 3,4-diclorohexano
Los alquinos
Las moléculas de hidrocarburos con uno o más triples enlaces se llaman alquinos; forman otra serie de hidrocarburos insaturados. Dos átomos de carbono unidos por un triple enlace están unidos por un enlace σ y dos enlaces π. Los carbonos con hibridación sp involucrados en el triple enlace tienen ángulos de enlace de 180°, esto le da a estos enlaces una forma lineal similar a una varilla.
El miembro más simple de la serie de los alquinos es el etino, C2H2, comúnmente llamado el acetileno. La estructura de Lewis para el etino que es una molécula lineal, es:
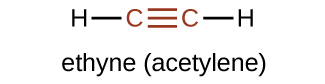
La nomenclatura de la IUPAC para los alquinos es similar a la de los alquenos, excepto que se usa el sufijo -ino para indicar un triple enlace en la cadena. Por ejemplo, \(\mathrm{CH_3CH_2C≡CH}\) se llama 1-butino.
Ejemplo \(\PageIndex{6}\): La estructura de los alquinos
Describe la geometría y la hibridación de los átomos de carbono en la siguiente molécula:
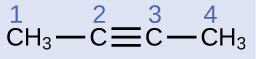
Solución
Los átomos de carbono 1 y 4 tienen cuatro enlaces sencillos y por eso son tetraédricos con hibridación sp3. Los átomos de carbono 2 y 3 están involucrados en el triple enlace y por eso tienen geometrías lineales y se clasificarían como híbridos sp.
Ejercicio \(\PageIndex{6}\)
Identifique la hibridación y los ángulos de enlace en los átomos de carbono en la molécula que se muestra:
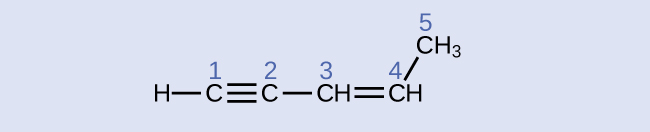
- Respuesta
-
carbono 1: sp, 180°; carbono 2: sp, 180°; carbono 3: sp2, 120°; carbono 4: sp2, 120°; carbono 5: sp3, 109.5°
Químicamente, los alquinos son similares a los alquenos. Ya que el grupo funcional \(\mathrm{C≡C}\) tiene dos enlaces π, los alquinos típicamente reaccionan aún más fácilmente y reaccionan con el doble de reactivo en reacciones de adición. La reacción del acetileno con el bromo es un ejemplo típico:
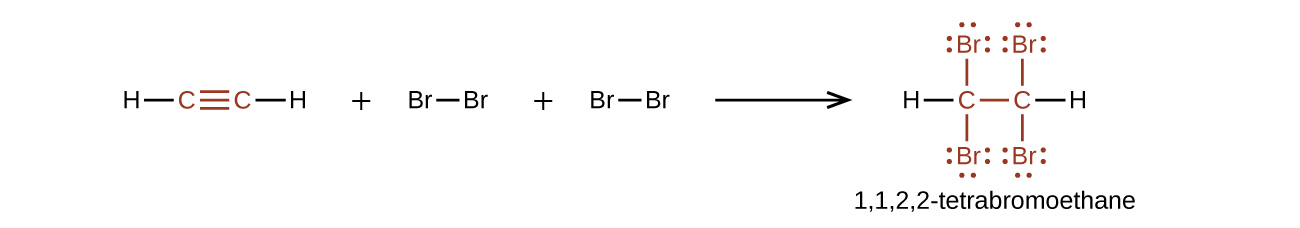
El acetileno y los otros alquinos también se queman fácilmente. Una antorcha de acetileno aprovecha el alto calor de combustión del acetileno.
Los hidrocarburos aromáticos
El benceno, C6H6, es el miembro más simple de una gran familia de hidrocarburos, llamados hidrocarburos aromáticos. Estos compuestos contienen estructuras de anillo y exhiben enlaces que se deben describir usando el concepto híbrido de resonancia de la teoría del enlace de valencia o el concepto de deslocalización de la teoría de los orbitales moleculares. (Para revisar estos conceptos, consulte los capítulos anteriores sobre los enlaces químicos). Las estructuras de resonancia para el benceno, C6H6, son:
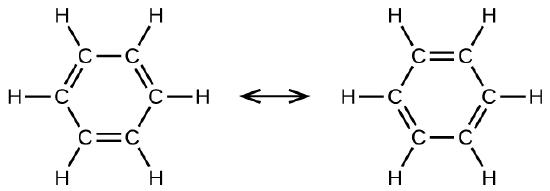
La teoría del enlace de valencia describe la molécula de benceno y otras moléculas de hidrocarburo aromático planas como los anillos hexagonales de los átomos de carbono con hibridación sp2 con el orbital p no hibridado de cada átomo de carbono perpendicular al plano del anillo. Tres electrones de valencia en los orbitales híbridos sp2 de cada átomo de carbono y el electrón de valencia de cada átomo de hidrógeno forman la estructura de los enlaces σ en la molécula de benceno. El cuarto electrón de valencia de cada átomo de carbono se comparte con un átomo de carbono adyacente en sus orbitales p sin hibridar para producir los enlaces π. Sin embargo, el benceno no tiene las características típicas de un alqueno. Cada uno de los seis enlaces entre sus átomos de carbono es equivalente y exhibe propiedades intermedias entre las de un enlace simple C – C y un enlace doble \(\mathrm{C=C}\). Para representar este enlace único, las fórmulas estructurales del benceno y sus derivados se dibujan típicamente con enlaces simples entre los átomos de carbono y un círculo dentro del anillo como se muestra en la Figura \(\PageIndex{10}\).
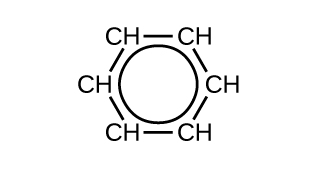
Figura \(\PageIndex{10}\): Esta fórmula condensada muestra la estructura de unión única del benceno.
Hay muchos derivados del benceno. Los átomos de hidrógeno se pueden reemplazar por muchos sustituyentes diferentes. Los compuestos aromáticos pasan por reacciones de sustitución más fácilmente que las reacciones de adición; la sustitución de uno de los átomos de hidrógeno por otro sustituyente dejará intactos los dobles enlaces deslocalizados. Los siguientes son ejemplos típicos de los derivados de benceno sustituidos:
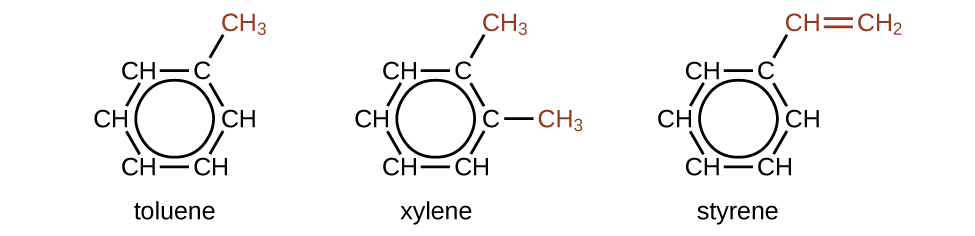
El tolueno y el xileno son importantes disolventes y materias primas en la industria química. El estireno se usa para producir el poliestireno polimérico.
Ejemplo \(\PageIndex{7}\): La estructura de los hidrocarburos aromáticos
Aquí se muestra un posible isómero formado por una reacción de sustitución que reemplaza un átomo de hidrógeno unido al anillo aromático del tolueno con un átomo de cloro. Dibuje otros dos posibles isómeros en los que el átomo de cloro reemplaza a un átomo de hidrógeno diferente unido al anillo aromático:
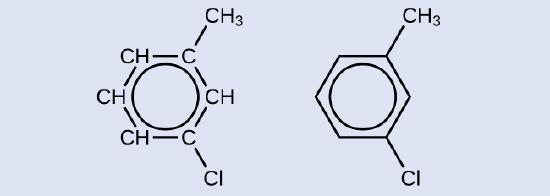
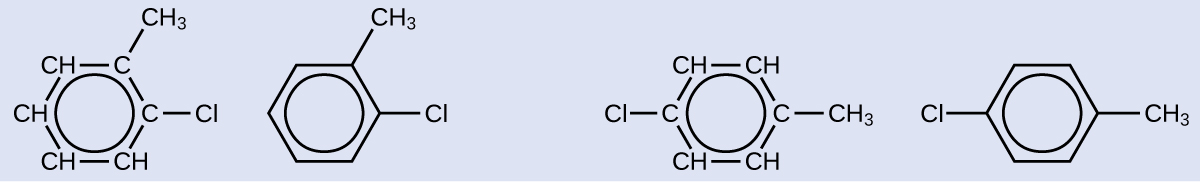
Solución
Ya que el anillo de seis carbonos con dobles enlaces alternos se necesita para que la molécula se clasifique como aromática, los isómeros apropiados se pueden producir solo por cambiando las posiciones del sustituyente cloro con respecto al sustituyente metilo:
Ejercicio \(\PageIndex{7}\)
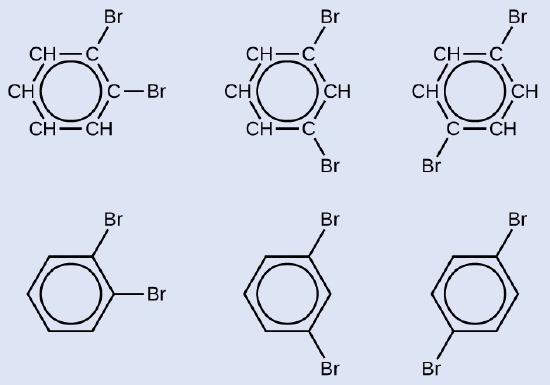
Dibuje tres isómeros de un compuesto de anillo aromático de seis miembros sustituido con dos bromos.
- Respuesta
-
Resumen
Los enlaces fuertes y estables entre los átomos de carbono producen moléculas complejas que contienen cadenas, ramas y anillos. La química de estos compuestos se llama la química orgánica. Los hidrocarburos son compuestos orgánicos hechos únicamente por carbono e hidrógeno. Los alcanos son hidrocarburos saturados, es decir, los hidrocarburos que contienen solo enlaces simples. Los alquenos contienen uno o más dobles enlaces carbono-carbono. Los alquinos contienen uno o más triples enlaces carbono-carbono. Los hidrocarburos aromáticos contienen estructuras de anillo con sistemas de electrones π deslocalizados.
Notas al pie de la página
- Esta es la base de datos de Beilstein, ahora disponible usando el sitio de Reaxys (www.elsevier.com/online-tools/reaxys).
- Peplow, Mark. "Síntesis orgánica: el robot químico", Nature 512 (2014): 20-2.
- Las propiedades físicas del C4H10 y las moléculas más pesadas son las del isómero normal, n-butano, n-pentano, etc.
- STP indica una temperatura de 0 °C y una presión de 1 atm.
Glosario
- reacción de adición
- reacción en la que un doble enlace carbono-carbono forma un enlace sencillo carbono-carbono mediante la adición de un reactivo. Es la reacción típica de los alquenos.
- alcano
- molécula que consiste solo de átomos de carbono e hidrógeno conectados por enlaces simples (σ)
- alqueno
- molécula formada por carbono e hidrógeno que contiene al menos un doble enlace carbono-carbono.
- grupo alquilo
- sustituyente, que consiste en un alcano al que le falta un átomo de hidrógeno, unido a una estructura más grande
- alquino
- molécula formada por carbono e hidrógeno que contiene al menos un triple enlace carbono-carbono.
- hidrocarburo aromático
- molécula cíclica que consiste en carbono e hidrógeno con enlaces simples y dobles alternados carbono-carbono deslocalizados, lo que resulta en una estabilidad mejor
- grupo funcional
- parte de una molécula orgánica que imparte una reactividad química específica a la molécula
- compuesto orgánico
- compuesto natural o sintético que contiene carbono
- hidrocarburo saturado
- molécula que contiene carbono e hidrógeno que solo tiene enlaces simples entre los átomos de carbono
- estructura esquelética
- método abreviado para dibujar las moléculas orgánicas en el que los átomos de carbono están representados por los extremos de las líneas y las curvas entre las líneas, y los átomos de hidrógeno unidos a los átomos de carbono no se muestran (pero se entiende que están presentes por el contexto de la estructura)
- sustituyente
- rama o grupo funcional que reemplaza los átomos de hidrógeno en una cadena de hidrocarburo más grande
- reacción de sustitución
- reacción en la que un átomo reemplaza a otro en una molécula
Contribuyentes y atribuciones
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


