4.3: Cloruro de sodio y enlaces iónicos
- Page ID
- 69928
Muchos átomos y grupos de átomos en los compuestos químicos son iones que tienen una carga eléctrica debido a su desigual número de protones y electrones. Los cationes son iones cargados positivamente y los aniones son iones cargados negativamente. Los compuestos que consisten en iones son compuestos iónicos y los enlaces que los mantienen juntos son enlaces iónicos. Los enlaces iónicos dependen de la atracción mutua entre los cationes positivos y los aniones negativos para su fuerza de unión (los cuerpos con carga inversa se atraen entre sí, mientras que los cuerpos cargados negativamente se repelen entre sí).
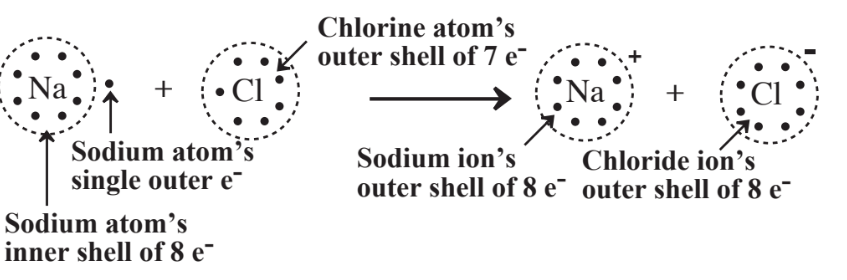
La formación de iones basada en la regla del octeto se ve fácilmente para el conocido compuesto iónico, cloruro de sodio, NaCl, como se ilustra en la Figura 4.3. Al perder un electrón para convertirse en el catión Na +, la capa subyacente del sodio de 8 electrones se convierte en la capa externa del ion con un octeto estable. El cloro alcanza un octeto estable de 8 electrones de capa externa al ganar 1 electrón por átomo para producir iones Cl -.
El cloruro de sodio es un compuesto muy estable debido a la atracción mutua de iones cargados opuestamente. Pero los iones tienen que estar dispuestos de manera óptima para que esta atracción sea efectiva. Dado que los iones cargados opuestamente se atraen entre sí, pero los iones con la misma carga son mutuamente repulsivos, los iones en un compuesto iónico como el cloruro de sodio tienen que ser empaquetados para maximizar la atracción y minimizar la repulsión. La disposición que hace esto para NaCl se muestra mediante un modelo de bola y palo en la Figura 4.4.
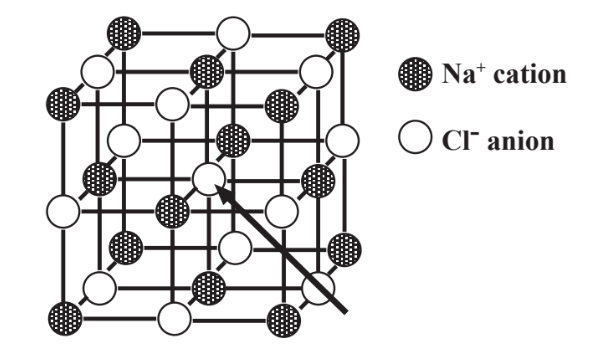
Aunque puede ser un poco difícil de imaginar para un modelo representado en papel, los seis vecinos más cercanos de cada anión Cl - cargado negativamente son cationes Na +. Y los seis vecinos más cercanos de cada catión Na + cargado positivamente son aniones Cl - cargados negativamente
En realidad, los iones se representan con mayor precisión en una estructura iónica como esferas que tocan. El catión Na + es significativamente menor que el anión Cl -, por lo que una representación más precisa de NaCl que la mostrada en la Figura 4.4 mostraría esferas Cl- bastante grandes entre las cuales se encuentran enclavadas esferas de Na+ apenas visibles. Pero el modelo imperfecto de bola y varilla mostrado en la Figura 4.4 muestra varios puntos importantes con respecto al NaCl iónico. Ilustra las posiciones relativas de los iones. Estas posiciones, combinadas con carga iónica y tamaño, determinan la estructura cristalina del cristal sólido del que está compuesto el compuesto iónico. Además, el examen de la figura muestra que ningún anión Cl - solo pertenece a un catión Na + específico, y ningún catión Na + pertenece a un anión Cl - específico. Entonces, aunque la fórmula química NaCl representa con precisión los números relativos de átomos de Na y Cl en el cloruro de sodio, no implica que existan moléculas discretas que consisten en 1 Na y 1 Cl. Por esta razón no es correcto referirse a una molécula de cloruro de sodio debido a que no existen moléculas distintas de compuestos iónicos como tales. En cambio, se hace referencia a unidades de fórmula de compuestos iónicos, donde una unidad de fórmula de NaCl consiste en 1 ion Na + y 1 Cl - ion, la cantidad más pequeña de una sustancia que puede existir y aún ser cloruro de sodio.
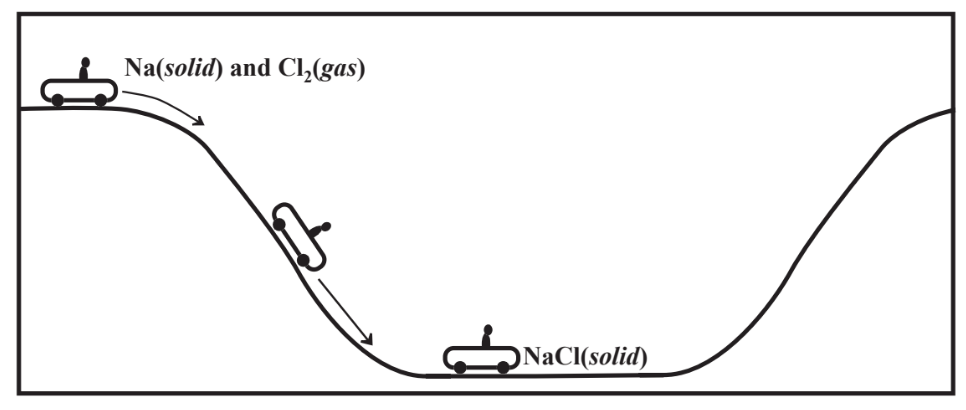
Las estabilidades de los compuestos químicos tienen que ver con la energía. En general, cuanta más energía se libera cuando se forma un compuesto, más estable es el compuesto. El cloruro de sodio podría formarse haciendo reaccionar sodio sólido elemental con gas Cl 2 elemental,
\[\ce{2Na(solid) + Cl2(gas) \rightarrow 2NaCl (solid)}\]
para producir cloruro de sodio sólido. Esta reacción libera una gran cantidad de energía y el sodio elemental se quema explosivamente en el gas cloro. La reacción se puede ver en términos de los siguientes pasos.
- Los átomos en el Na sólido se descomponen, lo que requiere energía.
- Cada molécula de Cl 2 se desarma, lo que requiere energía.
- Se toma un electrón de cada átomo de Na para producir iones Na +, que requiere energía.
- Se agrega un electrón a cada átomo de Cl para producir un ion Cl, que libera energía.
- Todos los cationes Na + y 1 Cl - anión se ensamblan en una proporción 1/1 en una red cristalina para producir NaCl, que libera una cantidad muy grande de energía.
La gran cantidad de energía involucrada en el Paso 5 se llama energía reticular y es la principal responsable de la alta estabilidad de los compuestos iónicos. En la Figura 4.5 se muestra una imagen general de la energía involucrada.
Las diferencias en el tamaño iónico señaladas anteriormente se representan en la Figura 4.6 para varios iones monoatómicos (1 átomo) de elementos cercanos entre sí en la tabla periódica. La figura muestra que los iones monatómicos negativos son generalmente más grandes que los iones monoatómicos positivos formados a partir de elementos que están cerca en la tabla periódica. Así, el ion F negativo es mayor que el ion Na+ positivo, aunque ambos iones tienen el mismo número de electrones (10) y el número atómico de Na es mayor que el de F.
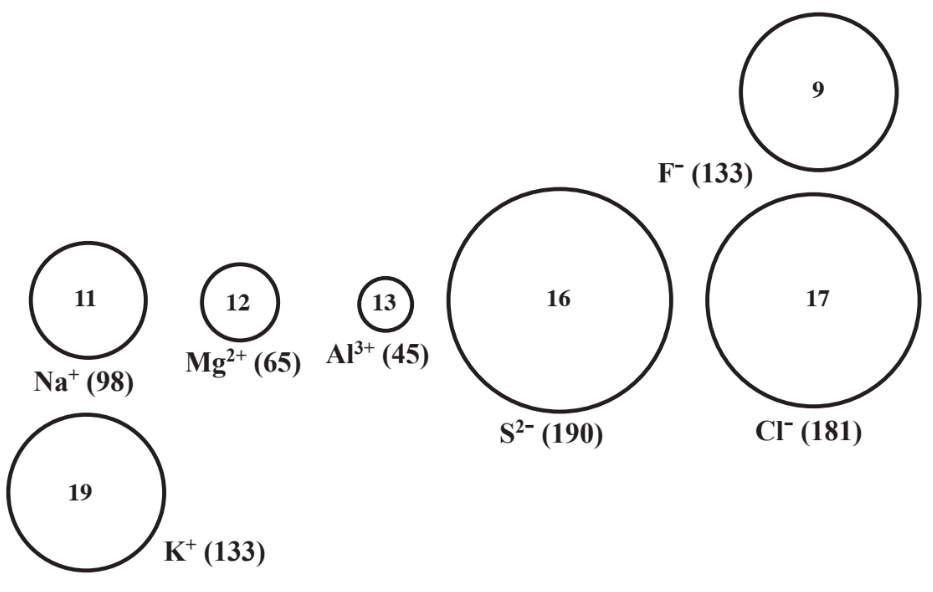
visto que para los iones del mismo grupo de elementos que tienen la misma carga, el ion del elemento con mayor número atómico es mayor. La Figura 4.6 muestra el ion Cl - mayor que el ion F - y el ion K + es mayor que el ion Na +. A medida que los electrones se eliminan de los elementos en el mismo periodo de la tabla periódica para producir progresivamente cationes con mayor carga, el tamaño de los iones se contrae notablemente como lo muestra el orden de tamaños de iones Na + > Mg 2 + > Al 3 +, cada uno de los cuales tiene 10 e-. Esto ocurre porque a medida que la carga del núcleo se hace más grande en relación con la carga de la nube de electrones negativos a su alrededor, la nube se acerca más al núcleo, encogiendo el tamaño del ion. A medida que los electrones se agregan a los átomos para producir aniones más altamente cargados, el tamaño del anión aumenta porque más electrones ocupan más espacio. Entonces S 2- ion es más grande que Cl - ion.
Para comprender mejor la formación de iones, se pueden considerar varios ejemplos más. El calcio y el cloro reaccionan,
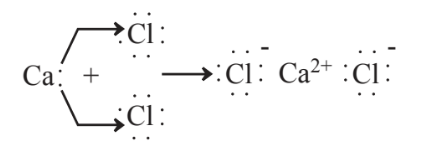
para formar cloruro de calcio, CaCl 2. Este compuesto es un subproducto de algunos procesos industriales, de los cuales su eliminación puede ser un problema. Se usa comúnmente como sal vial para derretir hielo y nieve en calles y carreteras. Si bien el cloruro de calcio es efectivo en este sentido, es corrosivo para los automóviles y el cloruro de calcio es una sal contaminante que puede contribuir al exceso de niveles de sal en cuerpos de agua. Un sustituto “más verde”, aunque más costoso es el acetato de calcio, Ca (C 2 H 3 O 2) 2. Este compuesto está compuesto por iones Ca 2 + y aniones acetato (C 2 H 3 O 2 2-). Su ventaja es que las bacterias en el suelo y en el agua causan fácilmente la biodegradación del anión acetato como lo demuestra la reacción,
\[\ce{Ca(C2H3O2)2 + 4O2} \: \: \: \underrightarrow{Bacteria} \: \: \: \ce{CaCO3 + 3CO2 + 3H2O}\]
de donde el calcio termina como carbonato de calcio, un componente común de la roca y el suelo.
Otro ejemplo de la formación de un compuesto iónico es la siguiente reacción de aluminio metálico con oxígeno elemental,
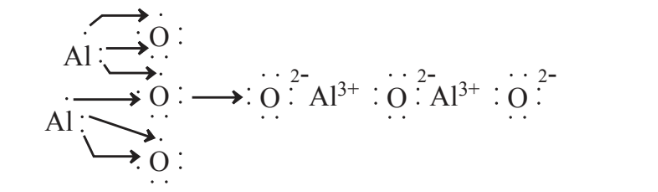
Esta reacción produce óxido de aluminio para el cual la fórmula química es Al 2 O 3. Este compuesto es la fuente de aluminio en la bauxita, el mineral del que se produce el aluminio y es un importante químico industrial. Llamado alúmina, el óxido de aluminio en sí tiene muchas aplicaciones incluyendo su uso para abrasivos y papel de lija, como materia prima para la cerámica, y como ingrediente de antiácidos y antitranspirantes.
Ejercicio: Mostrar los productos iónicos de la reacción del metal y del no metal indicados

Respuestas: (a) Na +, (b) Cl -, (c) NaCl, (d) K +, (e) O 2-, (f) K 2 O, (g) Ca 2 +, (h) Cl -, (i) CaCl 2
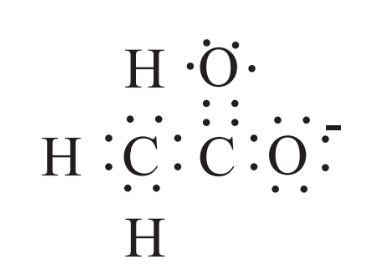
Además de los iones formados a partir de átomos individuales que pierden o ganan electrones, muchos iones consisten en grupos de átomos unidos covalentemente entre sí, pero que tienen una carga eléctrica neta debido a un exceso una deficiencia de electrones. Un ejemplo de tal ion es el ion acetato mostrado anteriormente en la fórmula del acetato de calcio, Ca (C 2 H 3 O 2) 2. La fórmula estructural del anión acetato, C 2 H 3 O 2 -, se muestra a continuación en la que los dos átomos de carbono se unen con un solo enlace covalente que consiste en dos electrones compartidos, cada uno de los tres átomos de H están unidos a uno de los átomos de carbono por un solo covalente y el otro átomo de carbono está unido a un oxígeno con un solo enlace covalente y al otro por un doble enlace covalente que consiste en 4 electrones compartidos. La carga neta sobre el ion es -1.
Líquidos iónicos y química verde
Los compuestos iónicos más comunes como el cloruro de sodio son sólidos duros porque los iones de los que están compuestos son relativamente pequeños y se empaquetan estrechamente en la red cristalina. Estos compuestos iónicos deben calentarse a temperaturas muy altas antes de que se fundan, 801° C para NaCl, por ejemplo. En los últimos años se han desarrollado compuestos iónicos que son líquidos en condiciones ordinarias. Los iones en estos líquidos iónicos están compuestos por grandes moléculas orgánicas compuestas por esqueletos de numerosos átomos de carbono unidos a otros átomos y que tienen una carga neta. Las cargas sobre los iones en tales compuestos están mucho menos concentradas que en compuestos inorgánicos simples como NaCl, los iones grandes se mueven fácilmente entre sí en el cristal iónico, y el compuesto es líquido a bajas temperaturas. Un ejemplo común de un compuesto líquido iónico es el hexafluorofosfato de decilmetilimidazolio, que es un líquido a temperaturas superiores a 40° C, la temperatura de un día de verano muy caluroso.
Ha habido mucho interés en la aplicación de líquidos iónicos a la química verde. Esto se debe a que muchas reacciones químicas incluyendo las de preparación de polímeros utilizados en tejidos sintéticos o compuestos farmacéuticos se llevan a cabo en disolventes líquidos, que tienden a evaporarse y contaminar el aire y a plantear problemas de eliminación. Además, aunque las propiedades de los disolventes en la síntesis química a menudo juegan un papel importante en la determinación del curso de la síntesis, el número de disolventes disponibles es muy limitado. En el caso de los líquidos iónicos, sin embargo, existe una gran variedad de cationes y líquidos que, combinados entre sí, podrían dar hasta un billón (!) diferentes líquidos iónicos. Esta versatilidad permite ajustar las propiedades de los líquidos iónicos para usos especializados en síntesis y otras aplicaciones. Los líquidos iónicos son bastante fáciles de reciclar, añadiendo a su carácter verde. Además de sus aplicaciones como solventes para medios de síntesis química, los líquidos iónicos pueden ser útiles para aislar contaminantes. Por ejemplo, un líquido iónico apropiado puede agitarse con agua contaminada con metales pesados tóxicos, como plomo o cadmio, que se unen con el líquido iónico. Dado que dicho líquido normalmente no es soluble en agua, puede separarse físicamente del agua, llevando consigo los metales pesados y dejando agua purificada.


