5.9: Energía en reacciones químicas
- Page ID
- 69858
Además de los cambios en la distribución de la masa entre diversas especies químicas que ocurren con las reacciones químicas, otro participante importante en las reacciones químicas es la energía. El capítulo 15 define y discute la energía con más detalle. Aquí la energía se considera en forma de calor manifestado por el movimiento de átomos y moléculas y como energía química, que es energía almacenada en enlaces químicos en la materia. La unidad estándar de energía es el joule, abreviado J. Un total de 4.184 J de energía térmica elevará la temperatura de 1 g de agua líquida en 1° C.
Como ejemplo de energía involucrada con las reacciones químicas, Considera lo que sucede en un quemador en una estufa de cocina alimentada por gas natural. La llama obviamente está caliente; algo está pasando que está liberando energía térmica. La llama también está emitiendo energía luminosa, probablemente como un resplandor azul claro. Se está produciendo una reacción química ya que el metano en el gas natural se combina con el oxígeno en el aire,
\[\ce{CH4 + 2O2 \rightarrow CO2 + 2H2O}\]
para producir dióxido de carbono y agua. La mayor parte de la energía liberada durante esta reacción química se libera como calor, y un poco como luz. Es razonable suponer que el metano y el oxígeno contienen energía almacenada como energía potencial química y que se libera en la producción de dióxido de carbono y agua. El sentido común nos dice que sería difícil obtener energía térmica de cualquiera de los productos. ¡Desde luego no se quemarán! El agua se usa para apagar incendios, y el dióxido de carbono se usa incluso en los extintores.
La energía potencial contenida en las especies químicas está contenida en los enlaces químicos de las moléculas que están involucradas en la reacción química. La Figura 5.2 muestra los tipos de enlaces involucrados en metano, oxígeno elemental, dióxido de carbono y agua y la energía contenida en cada uno. Las energías de enlace están en unidades del número de kilojulios (miles de julios, kJ) requeridos para romper un mol (6.02×1023, ver Sección 4.8) de los enlaces (kJ/mol). La misma cantidad de energía se libera cuando se forma un mol de un enlace. Por convención, la energía puesta en un sistema recibe un signo positivo y la energía liberada se denota con un signo negativo.
Para calcular el cambio de energía cuando un mol de metano reacciona con oxígeno como se muestra en la Reacción 5.9.1, se toma la diferencia entre la suma de las energías de los enlaces en los productos y la suma de las energías de los enlaces en los reactivos. El examen de la Reacción 5.9.1 y la Figura 5.2 muestra las siguientes energías de enlace totales en los productos:
\(\textrm{1 mol CO}_{2} \times \frac{\textrm{2 mol C=O}}{\textrm{mol CO}_{2}} \times \frac{\textrm{799 kJ}}{\textrm{mol C=O}} = \textrm{1598 kJ}\)
\(\textrm{2 mol H}_{2}\textrm{O} \times \frac{\textrm{2 mol O-H}}{\textrm{mol H}_{2}\textrm{O}} \times \frac{\textrm{459 kJ}}{\textrm{mol O-H}} = \textrm{1836 kJ}\)
Un cálculo similar da las energías de enlace totales en los reactivos
\(\textrm{1 mol CH}_{4} \times \frac{\textrm{4 mol C-H}}{\textrm{1 mol CH}_{4}} \times \frac{\textrm{411 kJ}}{\textrm{mol C-H}} = \textrm{1644 kJ}\)
\(\textrm{2 mol O}_{2} \times \frac{\textrm{1 mol O=O}}{\textrm{mol O}_{2}} \times \frac{\textrm{494 kJ}}{\textrm{mol O=O}} = \textrm{988 kJ}\)
Energía total de enlace en reactivos = 1644 kJ + 988 kJ = 2632 kJ
La diferencia en las energías de enlace entre productos y reactivos es de 3434 kJ - 2632 kJ = 802 kJ
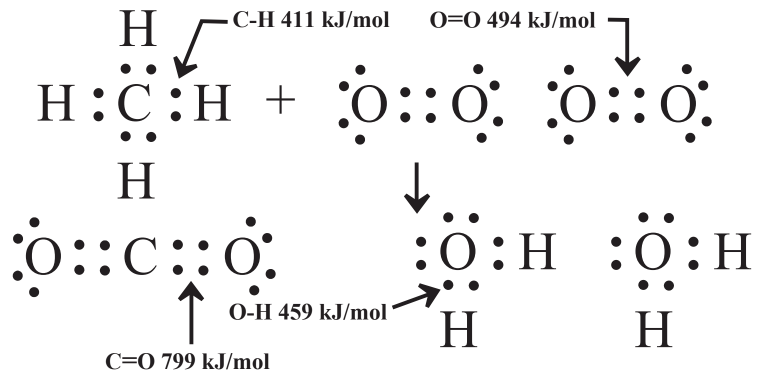
Este cálculo establece que, con base en consideraciones de energía de enlace, sola, la energía liberada cuando 1 mol de CH 4 reacciona con 2 moles de O 2 para producir 1 mol de CO 2 y 2 moles de H 2 O, es 802 kJ. Se trata de una reacción exotérmica en la que se libera energía térmica, por lo que se denota como 802 kJ. Este valor es cercano al valor que se obtendría midiendo experimentalmente la energía térmica liberada por la reacción, asumiendo que todos los reactivos y productos estaban en fase gaseosa. (Se libera una cantidad significativa de energía térmica cuando el agua en fase vapor se condensa en líquido. Los hornos de gas de condensación altamente eficientes capturan este calor en un intercambiador de calor donde el vapor de agua en el escape del horno se condensa a la fase líquida). En su mayor parte, por lo tanto, la cantidad de energía térmica liberada en una reacción química, y la cantidad de energía química potencial contenida en los reactivos es igual a la diferencia entre las energías de enlace totales de los productos y las de los reactivos.


