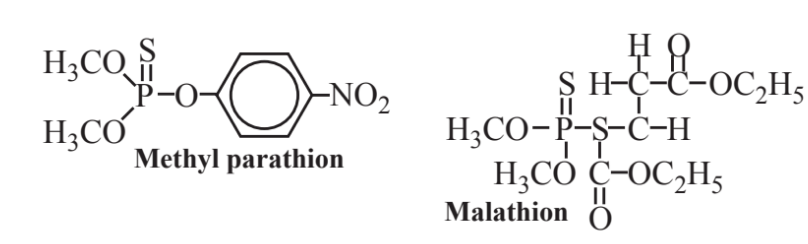6.4: Grupos funcionales
- Page ID
- 70072
Numerosos elementos además del carbono y el hidrógeno se encuentran en los compuestos orgánicos. Estos están contenidos en grupos funcionales, los cuales definen diversas clases de compuestos orgánicos. El grupo -NH 2 en anilina y los grupos -OH en fenol mencionados anteriormente son ejemplos de grupos funcionales. El mismo compuesto orgánico puede contener dos o más grupos funcionales. Entre los elementos comunes en los grupos funcionales se encuentran O, N, Cl, S y P. No hay espacio aquí para discutir todos los grupos funcionales posibles y las clases de compuestos orgánicos que definen. Se dan algunos ejemplos importantes para dar una idea de la variedad de compuestos orgánicos con diversos grupos funcionales. Otros ejemplos se encuentran más adelante en el texto
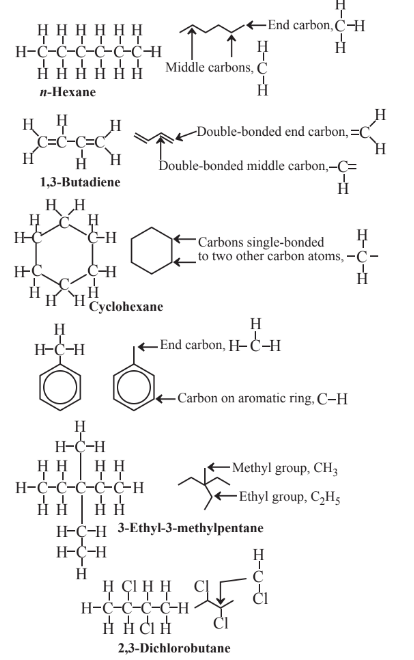
Al usar líneas para representar fórmulas estructurales orgánicas, las esquinas donde se cruzan las líneas y los extremos de las líneas representan átomos de C, y cada línea representa un enlace covalente (2 electrones compartidos). Se entiende que cada átomo de C al final de una sola línea tiene 3 átomos de H unidos, cada átomo de C a la intersección de 2 líneas tiene 2 átomos de C unidos, cada C en la intersección de 3 líneas tiene 1 H unido, y la intersección de 4 líneas denota un átomo de C sin átomos de H unidos. Múltiples líneas
Compuestos organooxigenados
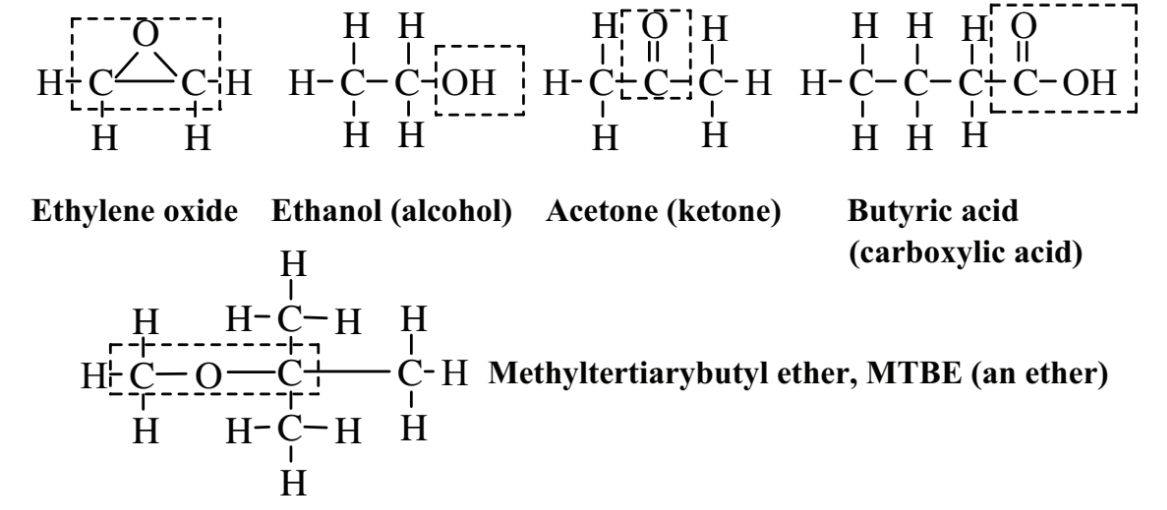
La Figura 6.4 muestra varias clases importantes de compuestos orgánicos que contienen oxígeno. El óxido de etileno es un gas explosivo, incoloro, inflamable y de olor dulce. Es un epóxido caracterizado por un átomo de oxígeno que une dos átomos de carbono que también están unidos entre sí. El óxido de etileno es tóxico y se utiliza como un esterilante y fumigante así como un intermedio químico. Debido a la toxicidad e inflamabilidad de este compuesto, la práctica de la química verde intenta evitar su generación y uso. El etanol, que se presenta en las bebidas alcohólicas, es un alcohol, una clase de compuesto en el que el grupo -OH está unido a un alcano o alqueno (la unión del grupo -OH a una molécula de hidrocarburo aromático da un compuesto fenólico). La acetona es una cetona, una clase de compuestos que tiene el grupo funcional C=O en medio de una cadena hidrocarbonada. La acetona es un excelente solvente orgánico y relativamente segura. El ácido butírico, que se encuentra en la mantequilla, es un ácido carboxílico orgánico, todos los cuales contienen el grupo funcional,
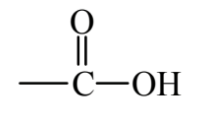
que puede liberar la característica de iones H+ de los ácidos. El éter metilterciario butílico, MTBE, es un ejemplo de un éter en el que un átomo de O conecta 2 átomos de C. Cuando el tetraetilplomo altamente tóxico se eliminó gradualmente de la gasolina como refuerzo de octano, se eligió MTBE como sustituto. Posteriormente se encontró que era un contaminante del agua particularmente nocivo, y su uso ha sido ampliamente prohibido
El grupo C=O en el medio de una molécula orgánica es característico de las cetonas. Cuando este grupo se localiza en el extremo de una molécula y el carbono también está unido a H, el compuesto es un aldehído. Los dos aldehídos más bajos son formaldehído y acetaldehído,

de los cuales el formaldehído es el más ampliamente producido. A pesar de sus múltiples usos, el formaldehído carece de características de los químicos verdes porque es una sustancia volátil, tóxica y nociva. El formaldehído tiende a inducir hipersensibilidad (alergias) en personas que inhalan el vapor o cuya piel está expuesta a él.
La reacción de un alcohol y un ácido orgánico,
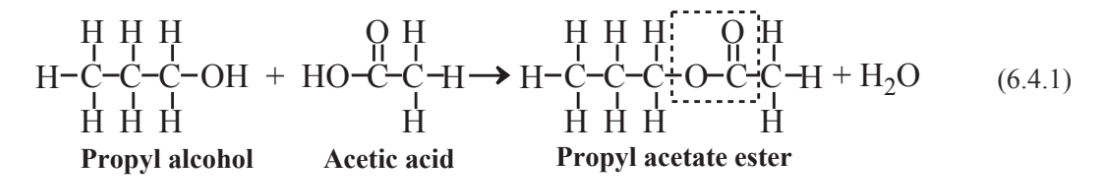
produce un importante tipo de compuesto orgánico llamado ésteres. La característica de enlace de los ésteres se describe por la caja discontinua en la estructura del acetato de propilo anterior. Un gran número de los ésteres naturales elaborados por las plantas se destacan por sus agradables olores. El acetato de propilo, por ejemplo, le da a las peras su agradable olor. Otros olores de frutas debido a los ésteres incluyen butirato de metilo, manzana; butirato de etilo, piña; y benzoato de metilo, kiwi maduro.
Compuestos de Organonitrogen
Metilamina,
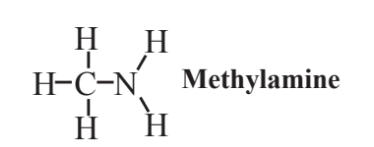
es la más simple de las aminas, compuestos en los que un átomo de N está unido a un grupo hidrocarbonado. En una amina, el átomo de N puede estar unido a 2 átomos de H, o uno o ambos de estos átomos de H también pueden estar sustituidos por grupos hidrocarbonados. Aunque es ampliamente utilizado en síntesis química porque no hay sustitutos adecuados disponibles, la metilamina definitivamente no es compatible con la práctica de la química verde. Eso es porque es altamente inflamable y tóxico. Es un irritante severo para la piel, los ojos y las membranas mucosas de las vías respiratorias. Tiene un olor nocivo y es un contribuyente significativo al olor de los peces podridos. De acuerdo con la reputación de las aminas como compuestos generalmente desagradables, otra amina, la putrescina, le da a la carne en descomposición su olor característico.
Muchos compuestos de organonitrógeno también contienen oxígeno. Uno de esos compuestos es el nitrometano

utilizado en síntesis química y como combustible en algunos autos de carreras. Como se ve en la fórmula estructural anterior, el grupo nitro, -NO 2, es el grupo funcional en este compuesto y los compuestos nitro relacionados. Otra clase de compuestos de organonitrógeno que también contienen oxígeno consiste en las nitrosaminas, o compuestos N-nitroso, que han figurado de manera prominente en la historia de la química verde antes de que se definiera como tal. Se trata de compuestos que tienen el grupo funcional N-N=O, los cuales son motivo de preocupación debido a que se conocen varios carcinógenos (agentes cancerígenos). El más conocido de estos es la dimetilnitrosamina que se muestra a continuación:
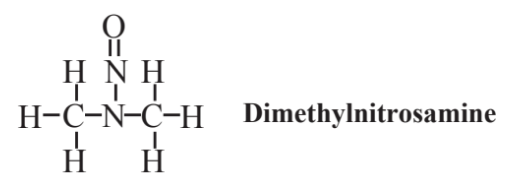
Este compuesto solía emplearse como disolvente industrial y se utilizó en aceites de corte. Sin embargo, los trabajadores expuestos a ella sufrieron daño hepático y desarrollaron ictericia, y se encontró que el compuesto, así como otras nitrosaminas, eran cancerígenos. Posteriormente se encontraron otras nitrosaminas en materiales industriales y como subproductos del procesamiento y conservación de alimentos. Debido a su potencial como carcinógenos, las nitrosaminas se evitan en la práctica de la química verde.
Compuestos de organohalogenuros
Los organohaluros ejemplificados por los mostrados en la Figura 6.5 son compuestos orgánicos que contienen halógenos —F, Cl, Br o I— pero generalmente cloro, sobre alcano, alqueno o moléculas aromáticas. Los organohaluros se han producido y distribuido ampliamente para una variedad de aplicaciones, incluyendo solventes industriales, intermedios químicos, fluidos refrigerantes, pesticidas y otras aplicaciones. Son en su mayor parte ambientalmente persistentes y, debido a su tendencia a acumularse en el tejido adiposo (graso), tienden a sufrir bioacumulación y biomagnificación en organismos
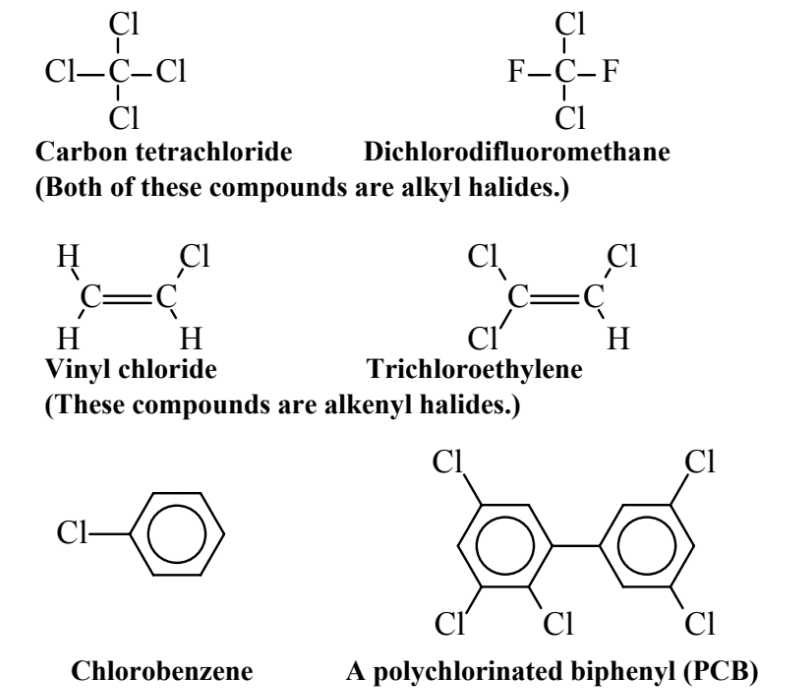
El tetracloruro de carbono se produce cuando los cuatro átomos de H en el metano, CH 4, están sustituidos por Cl. Este compuesto alguna vez fue ampliamente utilizado e incluso se vendió al público como solvente para eliminar manchas y en extintores, donde el pesado vapor CCl 4 sofoca incendios. Posteriormente se encontró que era muy tóxico, causando daño hepático severo, y sus usos están severamente restringidos. El diclorodifluorometano es un miembro destacado de la clase de compuestos clorofluorocarbonados, conocidos popularmente como Freones. Desarrollados como fluidos refrigerantes, estos compuestos son notablemente no reactivos y no tóxicos. Sin embargo, como se discute en el Capítulo 10, se encontró que eran indestructibles en la atmósfera baja, persistiendo a altitudes muy altas en la estratosfera donde el cloro partido de ellas por la radiación ultravioleta destruye el ozono estratosférico. Por lo que ahora está prohibida la fabricación de clorofluorocarbonos. El cloruro de vinilo, un compuesto de organohaluro a base de alqueno, es ampliamente utilizado para fabricar polímeros y tuberías de cloruro de polivinilo. Desafortunadamente, es un carcinógeno humano conocido, por lo que la exposición humana a él es severamente limitada. El tricloroetileno es un excelente solvente orgánico que no es inflamable. Se utiliza como disolvente de limpieza en seco y para desengrasar piezas manufacturadas, y anteriormente se usaba para la extracción de alimentos, particularmente para descafeinar café. El clorobenceno es el organocloruro aromático más simple. Además de sus usos en la elaboración de otros productos químicos, sirve como solvente y como fluido para la transferencia de calor. Es extremadamente estable, y su destrucción es una prueba común para la efectividad de los incineradores de desechos peligrosos. El compuesto de bifenilo policlorado (PCB) que se muestra es uno de los 209 compuestos de PCB que se pueden formar sustituyendo de 1 a 10 átomos de Cl en el esqueleto de carbono básico de bifenilo (anillo de dos bencenos). Estos compuestos son notablemente estables y persistentes, lo que lleva a su uso en equipos eléctricos, particularmente como refrigerantes en transformadores y en capacitores industriales, como fluidos hidráulicos y otras aplicaciones. Su extrema persistencia ambiental ha llevado a que se les prohíba. Los sedimentos en el río Hudson de Nueva York están muy contaminados con PCB que fueron (en ese momento, legalmente) vertidos o filtrados al río desde la fabricación de equipos eléctricos desde la década de 1950 hasta la década de 1970.
De la discusión anterior, es obvio que muchos compuestos de organohaluro definitivamente no son verdes debido a su persistencia y efectos biológicos. Gran parte del esfuerzo en el desarrollo de la química verde se ha dedicado a encontrar sustitutos para compuestos organohalogenados. Un tratado de 2001 de las Naciones Unidas formulado por aproximadamente 90 naciones en Estocolmo, Suecia, designó a una “docena sucia” de 12 compuestos organohalogenados de especial preocupación como contaminantes orgánicos persistentes (POP); posteriormente se han agregado otros compuestos a esta lista.
Compuestos de organosulfuros y organofosforados
Se han sintetizado varios compuestos de organosulfuros y organofosforados para diversos fines, incluyendo aplicaciones plaguicidas. Una clase común de compuestos organosulfurados consiste en los tioles, el más simple de los cuales es el metanotiol:
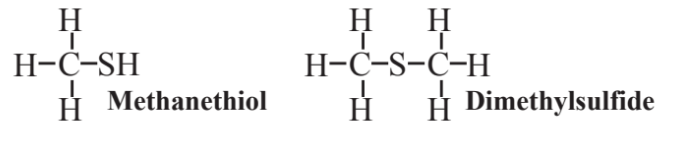
Al igual que con otros tioles, que contienen el grupo -SH, este compuesto se destaca por su mal olor. Los tioles se agregan al gas natural para que su olor pueda advertir de fugas de gas. El sulfuro de dimetilo, también mostrado anteriormente, es un compuesto volátil liberado por microorganismos que habitan en el océano a la atmósfera en cantidades tales que constituye el mayor flujo de vapores que contienen azufre de la Tierra a la atmósfera.
Entre los compuestos organofosforados más destacados se encuentran los organofosfatos como lo muestran el metilparatión y el malatión (abajo). Estos compuestos son a la vez insecticidas y contienen azufre así como fósforo. El paratión se desarrolló durante la década de 1940 y alguna vez fue ampliamente utilizado como insecticida en lugar del DDT porque el paratión es muy biodegradable, mientras que el DDT no lo es y experimenta bioacumulación y biomagnificación en los ecosistemas. Desafortunadamente, el paratión tiene una alta toxicidad para los humanos y otros animales y algunas muertes humanas han resultado de la exposición al mismo. Al igual que otros organofosfatos, inhibe la acetilcolinesterasa, una enzima esencial para la función nerviosa (el mismo modo de acción que sus primos mortales, los venenos militares del “gas nervioso”, como el Sarín). Debido a su toxicidad, el paratión ahora está prohibido de uso general. El malatión se usa en su lugar y solo es alrededor de 1/100 tan tóxico como el paratión para los mamíferos porque ellos —aunque no insectos— tienen sistemas enzimáticos que pueden descomponerlo.