13.13: Reacciones Químicas Energizantes e Intensificación de Procesos
- Page ID
- 70246
Uno de los aspectos más importantes de la química verde es la mejora de la velocidad y el grado de finalización de las reacciones químicas. Una de las formas en que esto se hace es bajando la energía de activación requerida para permitir que una reacción continúe. Eso es lo que hacen los catalizadores como se discutió en el apartado anterior. La otra forma de potenciar una reacción es mediante la adición de energía como se discute en esta sección.
El medio más sencillo para añadir energía a una reacción es calentando la mezcla de reacción. A escala industrial esto se logra comúnmente con serpentines de tubería sumergidos en la mezcla de reacción que se calientan con vapor que pasa a través de los serpentines. El calentamiento al pasar una corriente de electricidad a través de bobinas eléctricamente resistentes también es un medio para agregar energía a un sistema químico. Gran parte del esfuerzo en química verde se ha dedicado a encontrar formas más sofisticadas de energizar los sistemas químicos.
Las microondas se pueden usar para agregar energía a las reacciones para mejorar las velocidades de reacción. Las microondas son radiación electromagnética con longitudes de onda de 1 cm a 1 m (frecuencia 30 GHz a 300 Hz). Para evitar interferencias con las bandas de microondas utilizadas en la comunicación, los generadores de microondas industriales y domésticos suelen operar a 2.45 GHz. Las microondas son absorbidas por moléculas polares, como las del agua, provocando una reorientación rápidamente repetida de las moléculas en un campo de microondas. El resultado es un alto aporte de energía directamente en sustancias sometidas a microondas, agregando energía y acelerando las reacciones. La energía de microondas se puede poner directamente en volúmenes relativamente pequeños de medios de reacción, reduciendo los requisitos de material y minimizando los desechos. Las microondas se pueden usar para mejorar las reacciones en (1) medios acuosos, (2) disolventes orgánicos polares como dimetilformamida y (3) reacciones libres de medios, como reactivos sólidos mixtos.
La sonoquímica agrega energía al someter un medio de reacción a energía de ultrasonido a frecuencias entre 20 y 100 kHz que introduce pulsos de muy alta energía en el medio. Comúnmente, el ultrasonido es producido por el efecto piezoeléctrico a través del cual los cristales de sustancias como el titanato de bario impregnado con cerámica son sometidos a campos eléctricos de rápida inversión convirtiendo la energía eléctrica en energía sonora con una eficiencia que puede alcanzar el 95%. Una ventaja de la sonoquímica es que puede introducir alta energía en regiones microscópicas permitiendo que se produzcan reacciones sin calentar apreciablemente el medio de reacción.
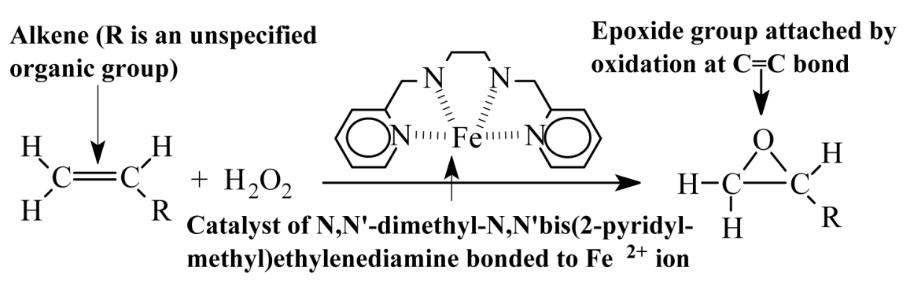
La electroquímica por el paso de una corriente continua de electricidad a través de un medio de reacción puede provocar tanto reducciones como oxidaciones. La reducción, la adición de electrones, e -, ocurre en el cátodo relativamente cargado negativamente, y la oxidación, la pérdida de electrones, en el ánodo relativamente cargado positivamente. La oxidación y reducción electroquímica puede ser controlada por los potenciales eléctricos aplicados, por los medios en los que ocurren y por los electrodos utilizados. Debido a que la adición de electrones al medio de reacción (reducción) y su consiguiente eliminación (oxidación) no agrega materia, las síntesis electrolíticas cumplen con los objetivos de la química verde. La producción electrolítica de oxígeno y de hidrógeno, un combustible no contaminante y valiosa materia prima, se muestra en la Sección 13.15 y Figura 13.10.
Las reacciones fotoquímicas utilizan la energía de los fotones de luz o radiación ultravioleta para provocar que ocurran reacciones. La energía, E, de un fotón de radiación electromagnética de frecuencia, ν, es E = h ν, donde h es la constante de Planck. Dado que un fotón puede ser absorbido directamente por una molécula o un grupo funcional en una molécula, la aplicación de radiación electromagnética de la energía apropiada a un medio de reacción puede introducir una gran cantidad de energía en una especie reaccionante sin calentar significativamente el medio. La energía fotoquímica se puede utilizar para hacer que las reacciones de síntesis ocurran de manera más eficiente y con menos producción de subproductos de desecho que los procesos no fotoquímicos. Un ejemplo es la acilación de benzoquinona con un aldehído para producir una acil-hidroquinona, un intermedio utilizado para elaborar algunos polímeros especiales:
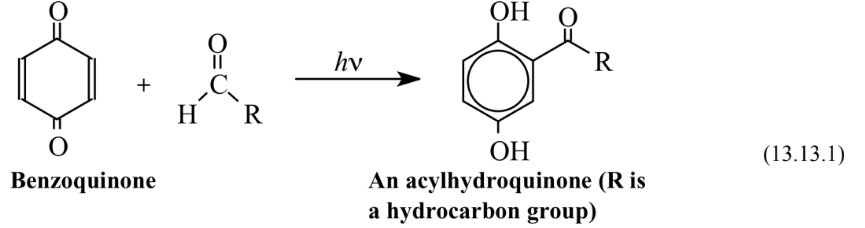
Esta reacción ocurre con 100% de economía atómica. A diferencia del tipo de reacción estándar de Friedel-Crafts, que utiliza el efecto catalítico de haluros ácidos de tipo Lewis, particularmente cloruro de aluminio, AlCl 3, el proceso fotoquímico no requiere sustancias catalíticas que tienden a ser reactivas y sensibles a la humedad y al aire.
Un participante de la reacción no tiene que absorber un fotón directamente para someterse a una reacción inducida fotoquímicamente. En algunos casos se agregan especies fotoquímicamente reactivas a la mezcla de reacción para absorber fotones, luego producir especies reactivas excitadas o radicales libres que llevan a cabo reacciones adicionales. Un ejemplo de esto lo proporciona el peróxido de hidrógeno, que absorbe fotones.
\[\ce{H2O2 + } h \nu \rightarrow \ce{ HO \cdot + HO \cdot}\]
para producir radicales hidroxilo reactivos que reaccionan con otras especies.
Intensificación de procesos y mayor seguridad con tamaños más pequeños
La intensificación del proceso se puede emplear con reactores de flujo continuo (Figura 13.8) utilizados para intensificar los procesos químicos y permitir una mayor producción de producto con una menor huella de aparato. Este es especialmente el caso cuando el flujo continuo se combina con catálisis heterogénea y entrada de energía. Un gran beneficio para tales reactores desde el punto de vista de la química verde es el aumento de la seguridad. Si algo sale mal en un reactor discontinuo grande, en el peor de los casos puede ocurrir un accidente como una explosión o incendio con una gran cantidad de material. Con un reactor de flujo continuo, el problema puede confinarse al pequeño volumen del reactor y el proceso se puede detener inmediatamente deteniendo la entrada de los reactivos.


