1.1: Solubilidad
- Page ID
- 76234
Solución
La solución es una mezcla homogénea de dos o más sustancias.
- Las sustancias miscibles hacen una solución al mezclarse entre sí en cualquier proporción. Por ejemplo, el etanol y el agua son miscibles entre sí.
- Las sustancias inmiscibles no hacen soluciones al mezclarse en ninguna proporción.
- Las sustancias parcialmente miscibles pueden hacer una solución al mezclarse hasta cierto punto pero no en todas las proporciones.
- Un disolvente es una sustancia en mayor cantidad en la solución.
- Un soluto es una sustancia en menor cantidad en la solución.
- Una solución insaturada es una solución en la que el disolvente mantiene el soluto por debajo del límite máximo, es decir, en la que se puede disolver más soluto.
- Una solución saturada es una solución en la que el disolvente está conteniendo la cantidad máxima de soluto que puede disolver.
Agua -un solvente universal
El agua es uno de los solventes más importantes porque está presente a nuestro alrededor -cubre más del 70% de la tierra y es más del 60% de nuestra masa corporal. El agua es una molécula polar que tiene un extremo negativo parcial en el oxígeno y un extremo parcialmente positivo en los átomos de hidrógeno. que puede disolver la mayoría de los compuestos polares e iónicos. En los compuestos iónicos, los cationes son retenidos por aniones a través de la interacción electrostática. Cuando un compuesto iónico se disuelve en agua, se disocia en cationes y aniones, cada uno rodeado por una capa de moléculas de agua mantenidas por interacciones ión-dipolo. Las moléculas de agua alrededor de los iones hacen interacción ión-dipolo orientando su extremo negativo parcial hacia los cationes y su extremo positivo parcial hacia los aniones. La energía necesaria para romper la interacción ión-ion en los compuestos iónicos se compensa parcialmente por la energía liberada mediante el establecimiento de las interacciones ión-dipolo. La energía obtenida debido a las interacciones ión-dipolo y la tendencia de la naturaleza a dispersarse son las fuerzas impulsoras responsables de la disolución de los compuestos iónicos.
La solubilidad es la capacidad de una sustancia para formar una solución con otra sustancia.
La solubilidad de un soluto en un disolvente específico se expresa cuantitativamente como la concentración del soluto en la solución saturada. Por lo general, la solubilidad se tabula en las unidades de gramos de soluto por 100 mL de solvente (g/100 mL). La solubilidad de los compuestos iónicos en el agua varía en un amplio rango. Todos los compuestos iónicos se disuelven hasta cierto punto.
Para fines prácticos, una sustancia se considera insoluble cuando su solubilidad es inferior a 0.1 g por 100 mL de disolvente.
Por ejemplo, el yoduro de plomo (II) (\(\ce{PbI2}\)) y el cloruro de plata (\(\ce{AgCl}\)) son insolubles en agua debido a que la solubilidad de\(\ce{PbI2}\) es 0.0016 mol/L de la solución y la solubilidad de\(\ce{AgCl}\) es de aproximadamente 1.3 x 10-5 mol/L de solución. El yoduro de potasio (\(\ce{KI}\)) y\(\ce{Pb(NO3)2}\) son solubles en agua. Cuando se\(\ce{Pb(NO3)2}\) mezclan soluciones acuosas de\(\ce{KI}\) y, la combinación insoluble de iones, es decir,\(\ce{PbI2}\) en este caso, precipita, como se ilustra en la Figura\(\PageIndex{1}\).

Lineamientos de solubilidad para la disolución de compuestos iónicos en agua
No existen pautas a prueba de fallas para predecir la solubilidad de compuestos iónicos en agua. Sin embargo, la siguiente guía puede predecir la solubilidad de la mayoría de los compuestos iónicos.
- Las sales de metales alcalinos (\(\ce{Li^+}\)\(\ce{Na^+}\),\(\ce{K^+}\),,\(\ce{Rb^+}\),\(\ce{Cs^+}\)) y amoníaco (\(\ce{NH4^+}\)) son solubles. Por ejemplo,\(\ce{NaCl}\) NaCl, y\(\ce{(NH4)3PO3}\) son solubles.
- Las sales de nitrato (\(\ce{NO3^-}\)), acetato (\(\ce{CH3COO^-}\)) y perclorato (\(\ce{ClO4^-}\)) son solubles. Por ejemplo,\(\ce{Pb(NO3)2}\), y\(\ce{Ca(CH3COO)2}\) son solubles.
- Las sales de cloruro (\(\ce{Cl^-}\)), bromuro (\(\ce{Br^-}\)) y yoduro (\(\ce{I^-}\)) son solubles, excepto cuando el catión es Plomo (\(\ce{Pb^{2+}}\)), Mercurio (\(\ce{Hg2^{2+}}\)) o Plata (\(\ce{Ag^{+}}\)). Recuerda el acrónimo “LMS” basado en la primera letra del nombre del elemento, o la frase 'Let Me See” para recordar Plomo, Mercurio y Plata.
- Los sulfatos (\(\ce{SO4^{2-}}\)) son solubles excepto cuando el catión es\(\ce{Pb^{2+}}\),\(\ce{Hg2^{2+}}\), o\(\ce{Ag^{+}}\) (recuerde “Let Me See” para Plomo, Mercurio y Plata) o un ion pesado de metal alcalinotérreo: calcio (\(\ce{Ca^{2+}}\)), bario (\(\ce{Ba^{2+}}\)) o estroncio (\(\ce{Sr^{2+}}\)). (Recuerde el acrónimo “CBS” basado en la primera letra del nombre del elemento, o la frase “Come By Soon” para recordar calcio, bario y estroncio).
- El hidróxido (\(\ce{OH^{-}}\)) y los sulfuros (\(\ce{S^{2-}}\)) son insolubles excepto cuando el catión es un ion pesado de metal alcalinotérreo:\(\ce{Ca^{2+}}\)\(\ce{Ba^{2+}}\),, o\(\ce{Sr^{2+}}\) (recuerde “Come By Soon” para calcio, bario y estroncio), metales alcalinos y amonio. Por ejemplo,\(\ce{Mg(OH)2}\) y las\(\ce{CuS}\) CUs son insolubles.
- Los carbonatos (\(\ce{CO3^{2-}}\)), fosfatos (\(\ce{PO4^{3-}}\)) y óxido (\(\ce{O^{2-}}\)) son insolubles excepto cuando el catión es un ion de metal alcalino o amonio. Por ejemplo,\(\ce{CaCO3}\), y\(\ce{Fe2O3}\) son insolubles.
- Si existe un conflicto entre los dos lineamientos, entonces la pauta listada primero tiene prioridad. Por ejemplo,\(\ce{CaCO3}\) es insoluble (regla #6), pero\(\ce{Na2CO3}\) es soluble (la regla #1 tiene prioridad sobre la regla #6).
Reacciones de precipitación
Las reacciones de precipitación son una clase de reacciones químicas en las que se mezclan dos soluciones y se separa un producto sólido, llamado precipitado. La reacción de precipitación que ocurre al mezclar soluciones de compuestos iónicos en agua se puede predecir como se ilustra en la Figura\(\PageIndex{2}\). El primer paso es enumerar los compuestos iónicos solubles y luego combinar los cationes de uno con el anión del otro para elaborar los productos potenciales. Si alguno de los productos potenciales es un compuesto iónico insoluble, precipitará. Por ejemplo, cuando la\(\ce{NaOH}\) solución se mezcla con la\(\ce{MgCl2}\) solución,\(\ce{Mg(OH)2}\) es una combinación cruzada que forma un compuesto insoluble, precipitará.
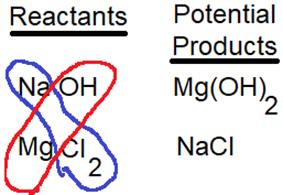
La Figura\(\PageIndex{3}\) muestra precipitados de algunos compuestos iónicos insolubles formados mezclando soluciones acuosas de compuestos iónicos solubles apropiados.






