5.2: Separación y confirmación si precipitan iones individuales del grupo III
- Page ID
- 76213
Separación y confirmación del ion níquel (II)
El tipo ácido\(\ce{HCl}\) disuelve los precipitados de los cationes del grupo III, es decir\(\ce{Cr(OH)3(s, gray-green)}\)\(\ce{Fe2Se3(s, yellow-green)}\),, y\(\ce{FeS(s, black)}\), mediante la siguiente serie de reacciones:
\[\ce{Cr(OH)3(s, gray-green) <=> Cr^{3+}(aq) + 3OH^{-}(aq)}\nonumber\]
\[\ce{FeS(s, black) <=> Fe^{2+}(aq) + 2S^{2-}(aq)}\nonumber\]
\[\ce{Fe2S3(s, yellow-green) <=> 2Fe^{3+}(aq) + 3S^{2-}(aq)}\nonumber\]
\[\ce{2Fe^{3+}(aq) + 2S^{2-}(aq) + 2H3O^{+} <=> 2Fe^{2+}(aq) + H2S(aq) + S(s) + 2H2O(l)}\nonumber\]
\[\ce{3OH^{-}(aq) + 3H3O^{+} <=> + 6H2O(l)}\nonumber\]
\[\ce{3S^{2-}(aq) + 6H3O^{+} <=> 3H2S(aq) + 6H2O(l)}\nonumber\]
\[\text{Overall reaction:}\ce{~Cr(OH)3(s, gray-green) + FeS(s, black) + Fe2S3(s, yellow-green) + 11H3O^{+} <=> Cr^{3+}(aq) + 3Fe^{2+}(aq) + 4H2S(aq) + S(s) + 14H2O(l)}\nonumber\]
La eliminación de\(\ce{S^{2-}}\) los iones básicos\(\ce{OH^{-}}\) y de los productos por neutralización ácido-base impulsa estas reacciones en la dirección hacia adelante. \(\ce{Fe^{3+}}\)se reduce a\(\ce{Fe^{2+}}\) por\(\ce{S^{2-}}\) bajo la condición ácida.
La solubilidad de\(\ce{NiS}\) es muy baja y no se disuelve en ácido no oxidante como\(\ce{HCl}\).
Por lo tanto, el sobrenadante separado en esta etapa contiene\(\ce{Cr^{3+}}\) y\(\ce{Fe^{2+}}\) y precipita, si está presente\(\ce{NiS}\), como se muestra en la Figura\(\PageIndex{1}\).


Aqua regia, es decir, una mezcla de\(\ce{HCl}\) y\(\ce{HNO3}\), puede disolver el\(\ce{NiS}\) precipitado retirando\(\ce{Ni^{2+}}\) como anión de coordinación soluble\(\ce{[NiCl4]^{2-}}\) y, al mismo tiempo,\(\ce{S^{2-}}\) retirándolo oxidándolo, utilizando\(\ce{NO3^{-}}\) como agente oxidante en el medio ácido.
\[\ce{NiS(s, black) <=> Ni^{2+}(aq) + 2S^{2-}(aq)}\nonumber\]
\[\ce{Ni^{2+}(aq) + 4Cl^{-}(aq) <=> [NiCl4]^{2-}(aq)}\nonumber\]
\[\ce{3S^{2-}(aq) + 2NO3^{-}(aq) + 8H3O^{+}(aq) <=> 3S(s)(v) + 2NO(g)(^) + 12H2O(l)}\nonumber\]
El óxido de nitrógeno (\(\ce{NO}\)) se evapora de la mezcla líquida impulsando aún más el equilibrio hacia adelante. La mayor parte del\(\ce{NO}\) in se oxida a dióxido de nitrógeno (\(\ce{NO2}\)) que forma humos de color marrón sobre la mezcla líquida como se muestra en la Figura\(\PageIndex{2}\):
\[\ce{2NO(g) + O2(g) <=> 2NO2(g, red-brown)}\nonumber\]

Los precipitados de S se eliminan por centrifugación y decantación. El anión de\(\ce{[NiCl4]^{2-}}\) coordinación se convierte en catión de coordinación [Ni (NH 3)] 2+ haciendo que la solución sea alcalina por adición de amoníaco:
\[\ce{[NiCl4]^{2-}(aq) + 6NH3(aq) <=> [Ni(NH3)6]^{2+}(aq, blue) + 4Cl^{-}(aq)}\nonumber\]
La dimetil glioxima\(\ce{(CH3)2C2(NOH)2}\) es un ligando que es capaz de formar dos enlaces covalentes coordinados con iones de metales de transición. Los ligandos como\(\ce{Cl^{-}}\),\(\ce{NH3}\)\(\ce{H2O}\), etc. que forman un enlace covalente coordinado con metales de transición se denominan mono-dentados, y los quelatos como dimetilglioxima forman dos enlaces covalentes coordinados se llaman bidentado. Los ligandos que pueden formar dos o más enlaces covalentes coordinados se denominan quelatos o agentes quelantes. Los complejos de coordinación con quelatos suelen ser más estables, es decir, tienen mayores constantes de formación que con ligandos monodentados.
La adición de dimetilglioxima\(\ce{(CH3)2C2(NOH)2}\) a la mezcla líquida que contiene\(\ce{[Ni(NH3)6]^{2+}}\) en un medio alcalino forma un compuesto de coordinación insoluble\(\ce{NiC8H14O4}\) que se separa como un precipitado de color rojo, como se muestra en la Figura\(\PageIndex{3}\):



La estructura del agente quelante de dimetilglioxima y su complejo de coordinación con níquel se ilustra en la Figura\(\PageIndex{4}\) siguiente.
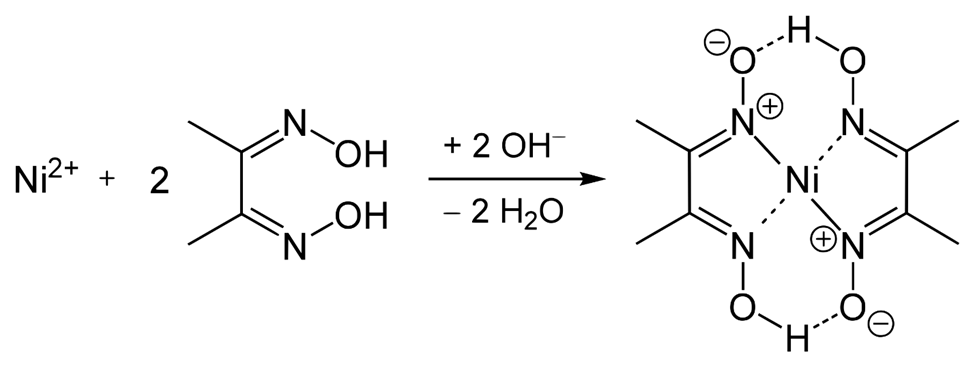
La formación de precipitado de color rojo tras la adición de dimetilglioxima en esta etapa confirma la presencia de ión níquel en la muestra de prueba.
Separación y confirmación de iones de hierro
El sobrenadante que contiene\(\ce{Fe^{2+}}\) e\(\ce{Cr^{3+}}\) iones se separa del\(\ce{NiS}\) precipitado después de la adición de\(\ce{HCl}\) a los precipitados de cationes del grupo III. El sobrenadante se alcaliniza a pH 9 a 10 mediante la adición de solución de amoníaco. Se utiliza un papel de pH para determinar el pH. Se agrega peróxido de hidrógeno (\(\ce{H2O2}\)) como agente oxidante a la solución alcalina. \(\ce{Fe^{2+}}\)se oxida\(\ce{Fe^{3+}}\) y precipita como sólido marrón oxidado\(\ce{Fe(OH)3}\), y\(\ce{Cr^{3+}}\) se oxida a ion cromato soluble (\(\ce{CrO4^{2-}}\)) bajo esta condición:
\[\ce{2Fe^{2+}(aq) + H2O2(aq) <=> 2Fe^{3+}(aq) + 2OH^{-}(aq)}\nonumber\]
\[\ce{Fe^{3+}(aq) + 3OH^{-}(aq) <=> Fe(OH)3(s, rusty-brown)(v)}\nonumber\]
\[\ce{2Cr^{3+}(aq) + 3H2O2(aq) + 10OH^{-}(aq) <=> 2CrO4^{2-}(aq) + 8H2O(l)}\nonumber\]
La mezcla se centrifuga para separar el sobrenadante que contiene\(\ce{CrO4^{2-}}\) iones y el precipitado que contiene precipitado marrón oxidado\(\ce{Fe(OH)3}\), como se muestra en la Figura\(\PageIndex{5}\).



El\(\ce{Fe(OH)3}\) precipitado se disuelve en\(\ce{HCl}\) solución:
\[\ce{Fe(OH)3(s, rusty-brown) <=> Fe^{3+}(aq) + 3OH^{-}(aq)}\nonumber\]
\[\ce{3OH^{-}(aq) + 3H3O^{+}(aq) <=> 6H2O(l)}\nonumber\]
El tiocianato (\(\ce{SCN^{-}}\)) es un ligando que forma un ion complejo de coordinación de color rojo profundo\(\ce{[FeSCN]^{2+}}\) al reaccionar con\(\ce{Fe^{3+}}\), como se muestra en la Figura\(\PageIndex{6}\).
\[\ce{Fe^{3+}(aq) + SCN^{-}(aq) <=> [FeSCN]^{2+}(aq, deep-red)}\nonumber\]
Al cambiar el color del sobrenadante a rojo intenso tras la adición de tiocianato, se confirma que los iones de hierro están presentes en la muestra de prueba.


Confirmación de iones de cromo (III)
El sobrenadante obtenido después de la eliminación del\(\ce{Fe(OH)3}\) precipitado contiene\(\ce{CrO4^{2-}}\) iones en un medio alcalino. La solución se hace ácida por la adición de ácido nítrico donde se\(\ce{CrO4^{2-}}\) convierte en ion dicromato (\(\ce{Cr2O7^{2-}}\)):
\[\ce{2CrO4^{2-}(aq) + 2H3O^{+}(aq) <=> Cr2O7^{2-}(aq) + 3H2O(l)} \nonumber\]
\(\ce{H2O2}\)es un agente reductor en medio ácido. \(\ce{H2O2}\)se añade a la mezcla ácida para reducir\(\ce{Cr2O7^{2-}}\) a\(\ce{Cr^{3+}}\) través de las siguientes reacciones:
\[\ce{2Cr2O7^{2-}(aq) + 8H2O2(aq) + 4H3O^{+}(aq) <=> 4CrO5(aq, dark-blue) + 14H2O(l)} \nonumber\]
\[\ce{4CrO5(aq) + 12H3O^{+}(aq) <=> 4Cr^{3+}(aq, light-blue) + 7O2(g)(^) + 18H2O(l)} \nonumber\]
El oxígeno evoluciona de la mezcla y se puede observar como burbujas de gas en la solución. \(\ce{CrO5}\)intermedio es un color azul oscuro en el que un oxígeno está en estado de oxidación -2 y los otros cuatro oxígeno están en estado de oxidación -1. \(\ce{CrO5}\)es inestable en solución y se descompone a\(\ce{Cr^{3+}}\) lo que es de un color azul claro. \(\ce{H2O2}\)El residuo se destruye calentando la mezcla en un baño de agua hirviendo, lo que se puede observar a través del burbujeo de gas oxígeno. Tenga en cuenta que la destrucción de\(\ce{H2O2}\) es significativamente más lenta en un medio ácido que en un medio alcalino. Puede tardar más tiempo\(\ce{H2O2}\) en destruirse en el medio ácido. Después la solución se cambia de ácida a alcalina añadiendo NaOH 6M a la mezcla. \(\ce{Cr^{3+}}\)precipita como un\(\ce{Cr(OH)3}\) sólido gris-verde:
\[\ce{Cr^{3+}(aq) + 3OH^{-}(aq) <=> Cr(OH)3(s, gray-green)(v)} \nonumber\]
La formación de precipitado gris-verde en esta etapa confirma que\(\ce{Cr^{3+}}\) está presente en la muestra de prueba, como se muestra en la Figura\(\PageIndex{7}\).




