6.4: Espectros de Emisión y Absorbancia
- Page ID
- 78989
En el último apartado se consideró la fuente de emisión y absorción. En esta sección consideramos los tipos de espectros de emisión y absorbancia que formaremos la base para muchos de los capítulos que siguen.
Espectros de Emisión
Cuando un átomo, ion o molécula se mueve de un estado de mayor energía a un estado de menor energía, emite fotones con energías iguales a la diferencia de energía entre los dos estados. El resultado es un espectro de emisión que muestra la intensidad de emisión en función de la longitud de onda. Las formas de estos espectros de emisión se encuentran en dos tipos amplios: espectros de línea y espectros de banda.
Espectros de Línea
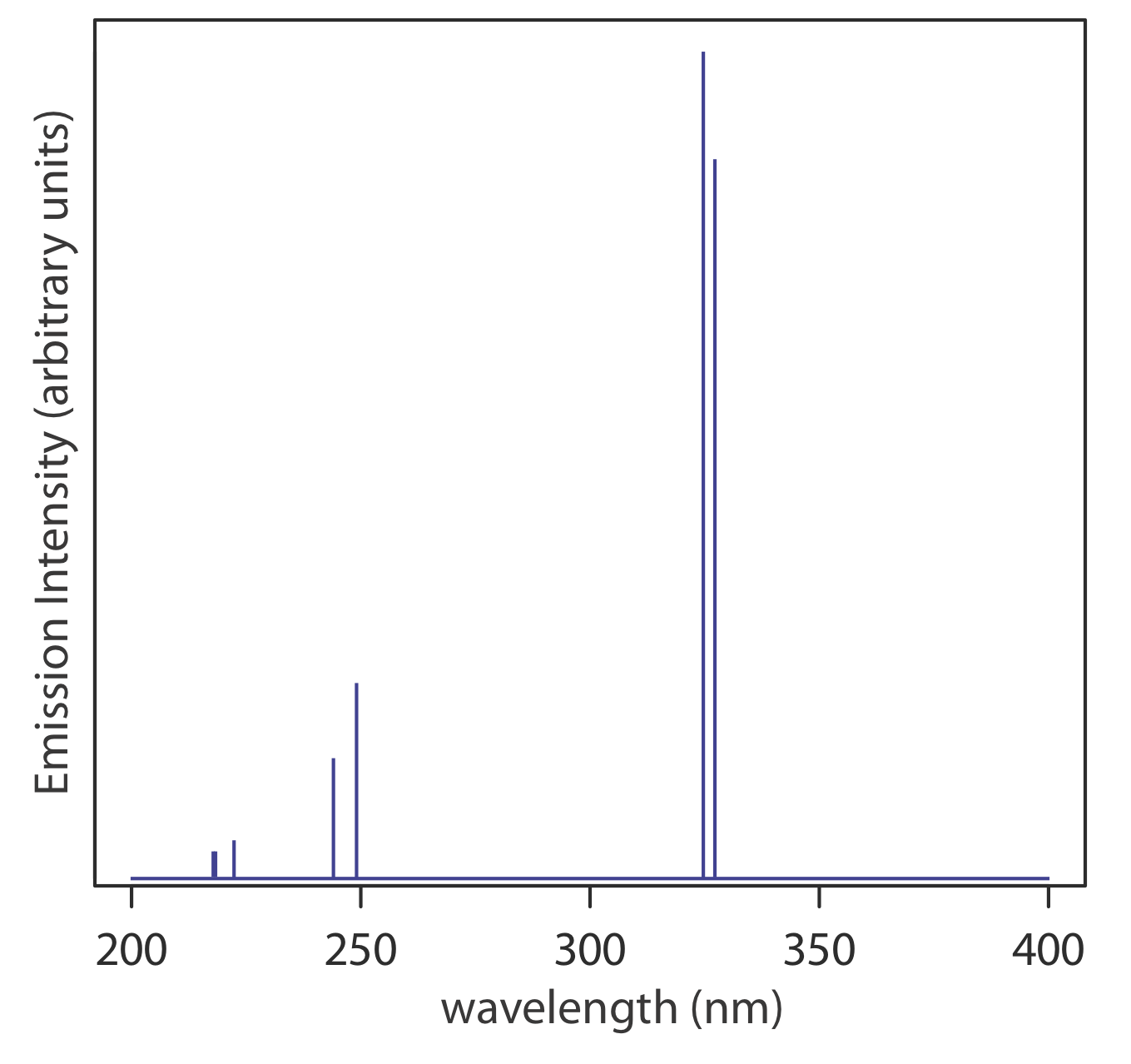
Cuando los estados energéticos están bien separados entre sí, y cuando solo hay un tipo de transición entre los estados energéticos, el resultado es un espectro lineal que consiste en un pequeño número de bandas estrechas. La figura\(\PageIndex{1}\), por ejemplo, muestra el espectro de emisión de átomos de Cu en fase gaseosa, que consta de siete líneas, dos de las cuales están demasiado cerca una de la otra para resolverlas entre sí. Las líneas de emisión individuales son muy estrechas, como podríamos esperar, porque los niveles de energía del átomo tienen valores precisos.
Espectros de Banda
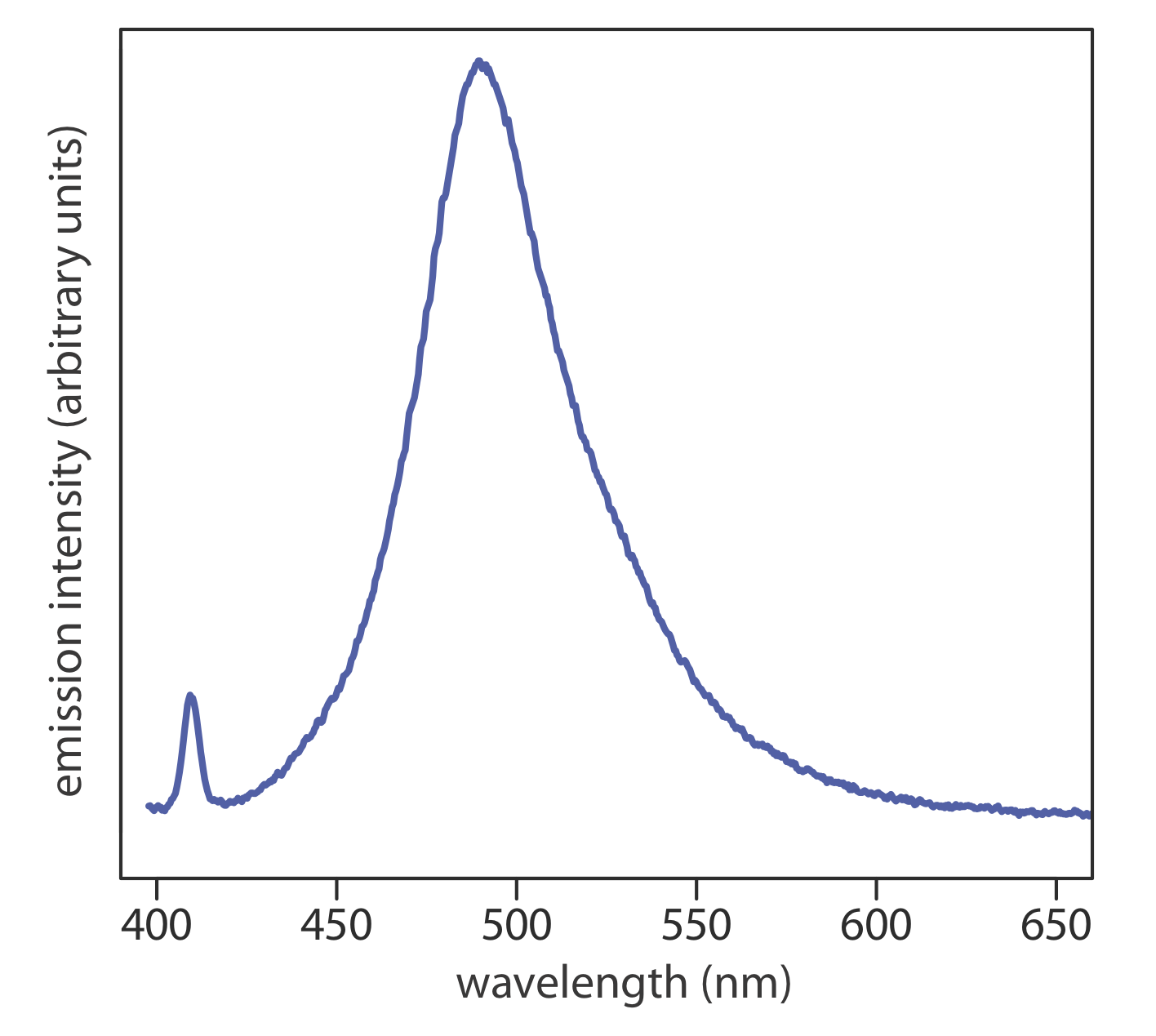
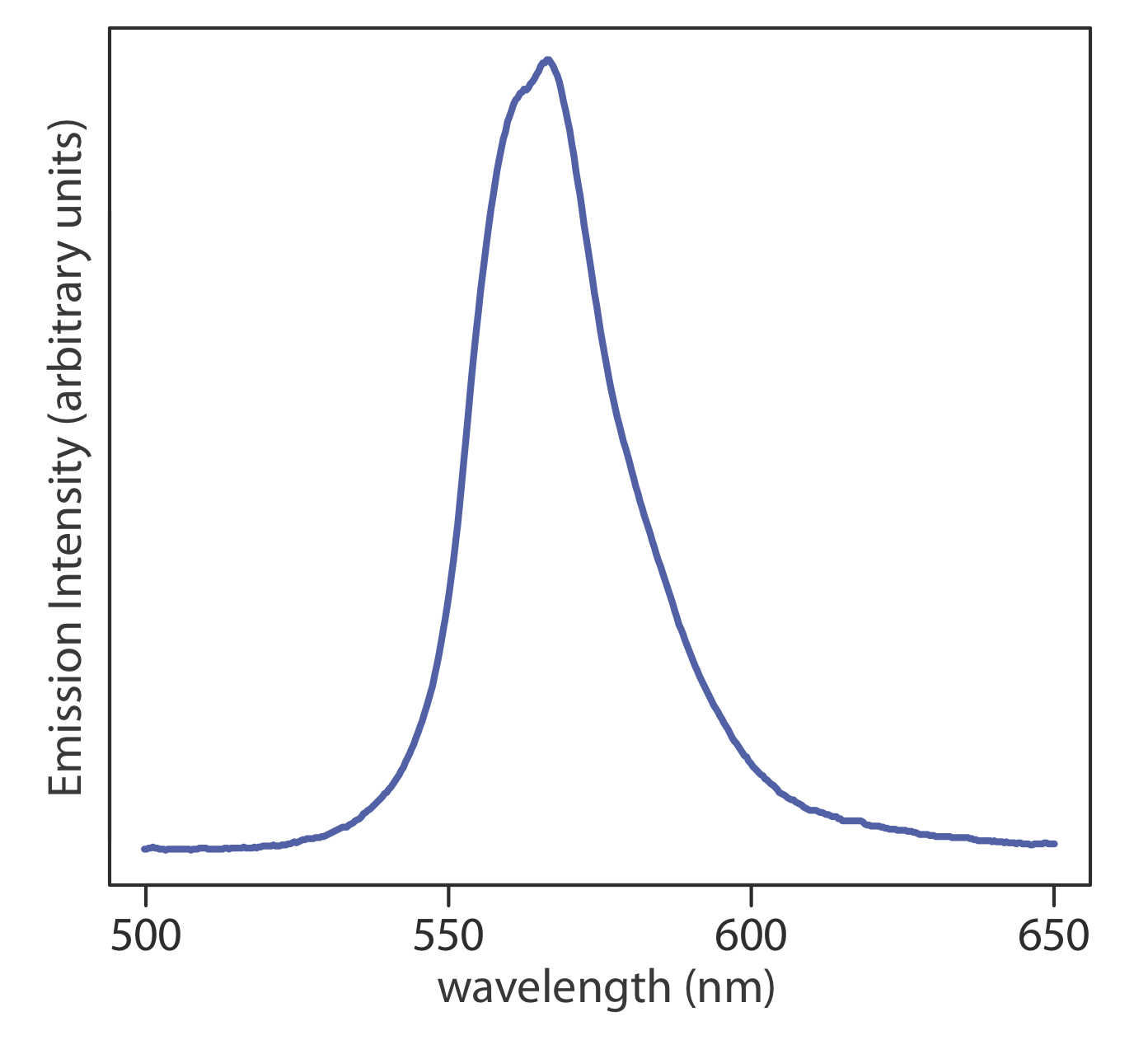
El espectro de emisión para un átomo en fase gaseosa es relativamente simple porque el número de transiciones posibles es pequeño y porque sus energías individuales están bien separadas entre sí. Cuando una molécula en un solvente emite luz, el número de posibles cambios en los niveles de energía puede ser bastante grande si la molécula experimenta transiciones entre niveles de energía electrónica, vibracional y rotacional. El espectro resultante tiene tantas líneas de emisión individuales de emisión que vemos un solo pico ancho, o banda, que llamamos espectro de banda. La figura\(\PageIndex{2}\) muestra el espectro de emisión para el colorante cumarina 343, el cual se incorpora en una micela inversa y se suspende en ciclohexanol.
Al considerar fuentes de radiación electromagnética para instrumentos espectroscópicos, generalmente las describimos como fuentes de línea y fuentes continuas dependiendo de si emiten líneas discretas, como es el caso de la lámpara de cátodo hueco en la Figura\(\PageIndex{1}\), o exhiben emisión en un amplio rango de longitudes de onda sin ningún hueco, como es el caso de un diodo emisor de luz verde (LED), cuyo espectro se muestra en la Figura\(\PageIndex{3}\).
Espectros de absorbancia
Cuando un átomo, ion o molécula se mueve de un estado de menor energía a un estado de mayor energía, absorbe fotones con energías iguales a la diferencia de energía entre los dos estados. El resultado es un espectro de absorbancia que muestra la intensidad de emisión en función de la longitud de onda. Como es el caso de los espectros de emisión, los espectros de absorbancia van desde líneas estrechas hasta bandas anchas. El espectro de absorción atómica para Na se muestra en la Figura\(\PageIndex{4}\), y es típico del que se encuentra para la mayoría de los átomos. La característica más obvia de este espectro es que consiste en un pequeño número de líneas de absorción discretas que corresponden a transiciones entre el estado fundamental (el orbital atómico de 3 s) y los orbitales atómicos de 3 p y 4 p.
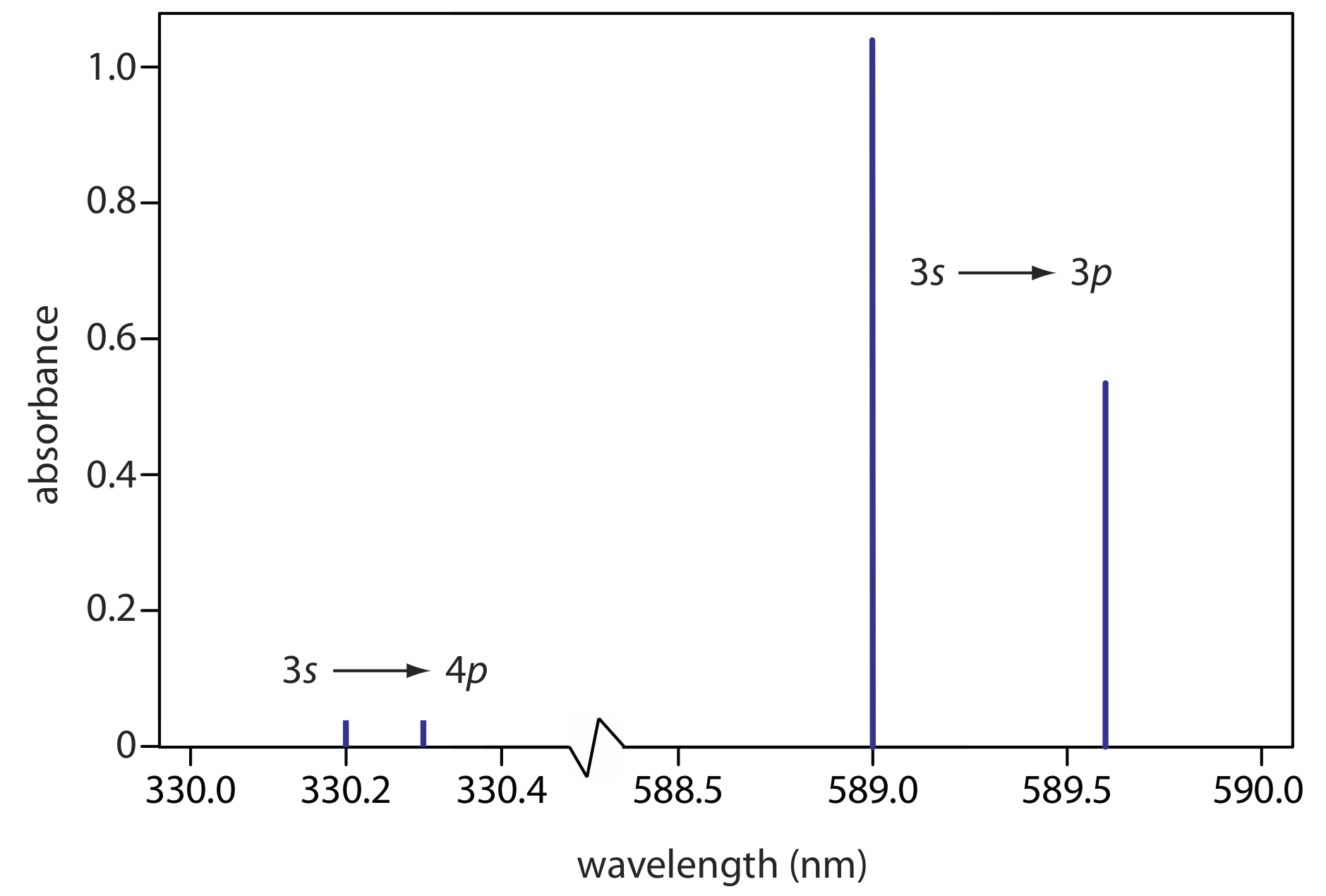
Otra característica del espectro de absorción atómica en la Figura\(\PageIndex{4}\) es el ancho estrecho de las líneas de absorción, lo cual es consecuencia de la diferencia fija de energía entre el estado fundamental y el estado excitado, y la falta de niveles de energía vibratoria y rotacional. Los anchos de línea naturales para la absorción atómica, que se rigen por el principio de incertidumbre, son aproximadamente de 10 —5 nm. Otras contribuciones al ensanchamiento incrementan este ancho de línea a aproximadamente 10 —3 nm.
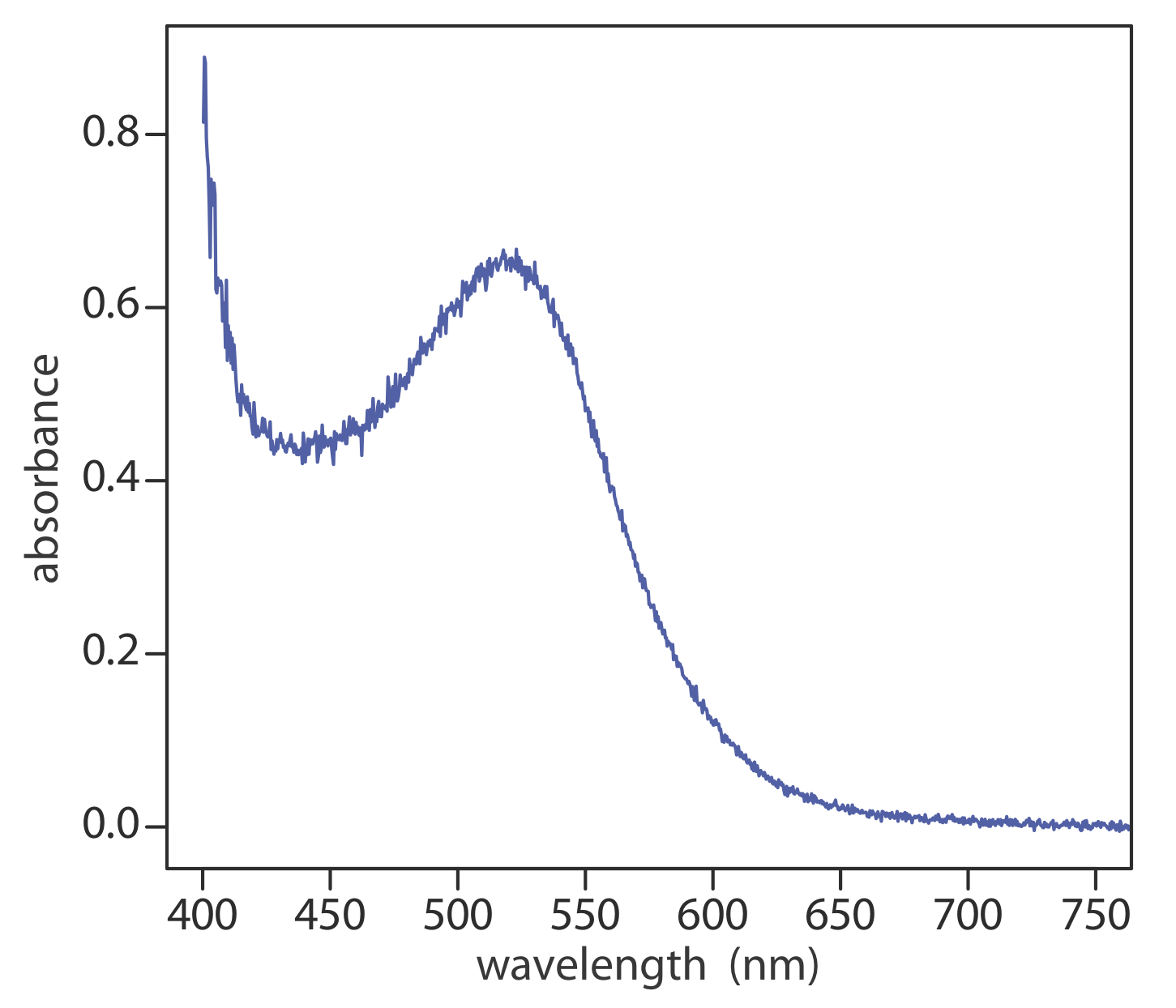
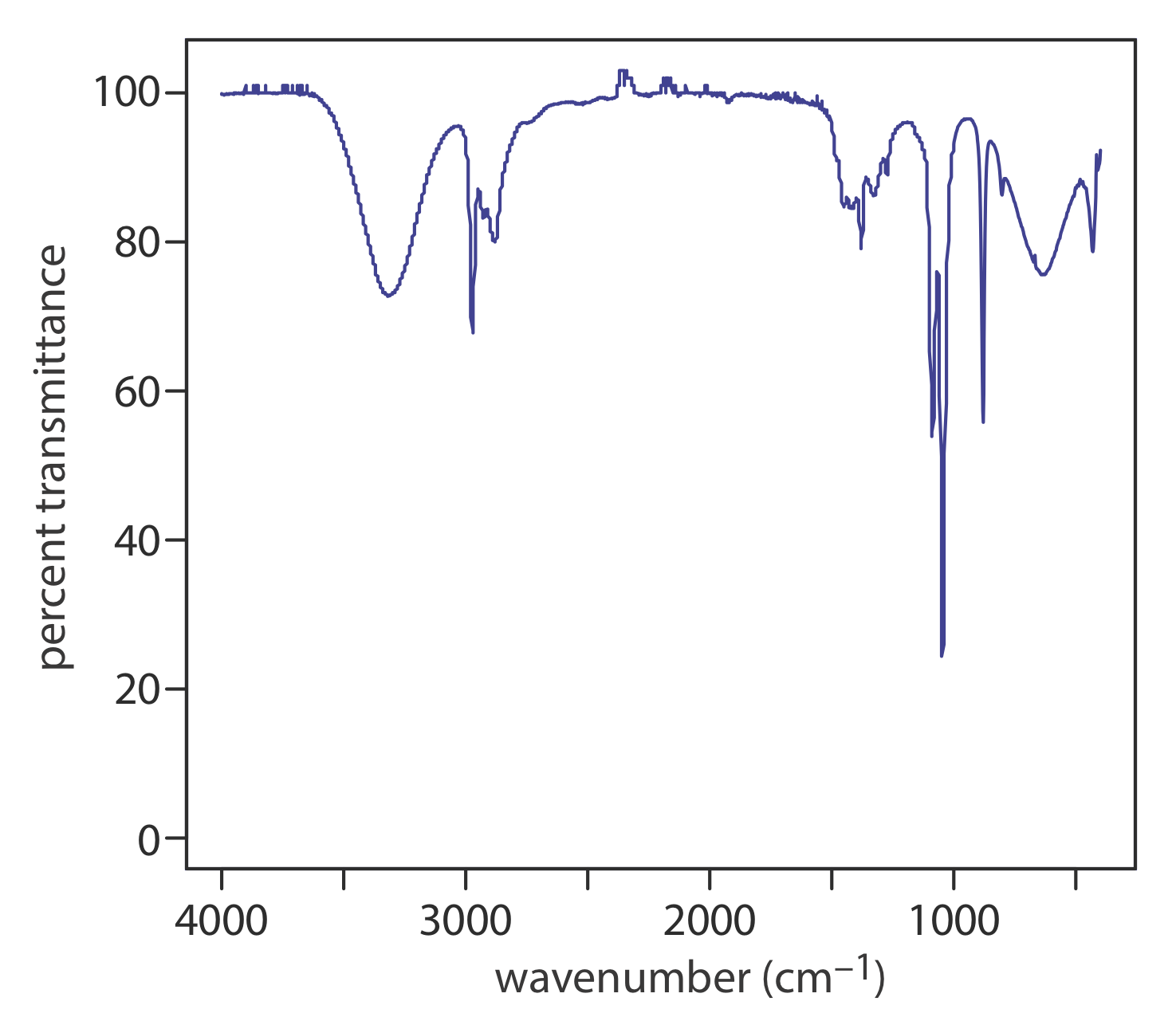
Los espectros de absorbancia para moléculas consisten en bandas anchas por las mismas razones discutidas anteriormente para los espectros de emisión. El espectro UV/Vis para jugo de arándano en la Figura\(\PageIndex{5}\) muestra una sola banda ancha para los tintes de antocianina que son responsables de su color rojo. El espectro IR para etanol en la Figura\(\PageIndex{6}\) muestra múltiples bandas de absorción, algunas más amplias y otras más estrechas. Las bandas estrechas, sin embargo, siguen siendo mucho más amplias que las líneas en el espectro de absorción atómica para Na.