6.3: Propiedades mecánicas cuánticas de la radiación electromagnética
- Page ID
- 78994
En la última sección, se consideraron las propiedades de la radiación electromagnética que son consistentes con identificar la luz como una onda. Otras propiedades de la luz, sin embargo, no pueden explicarse por un modelo que la trate como una onda; en cambio, necesitamos considerar un modelo que trate a la luz como un sistema de partículas discretas, a las que llamamos fotones.
El efecto fotoeléctrico
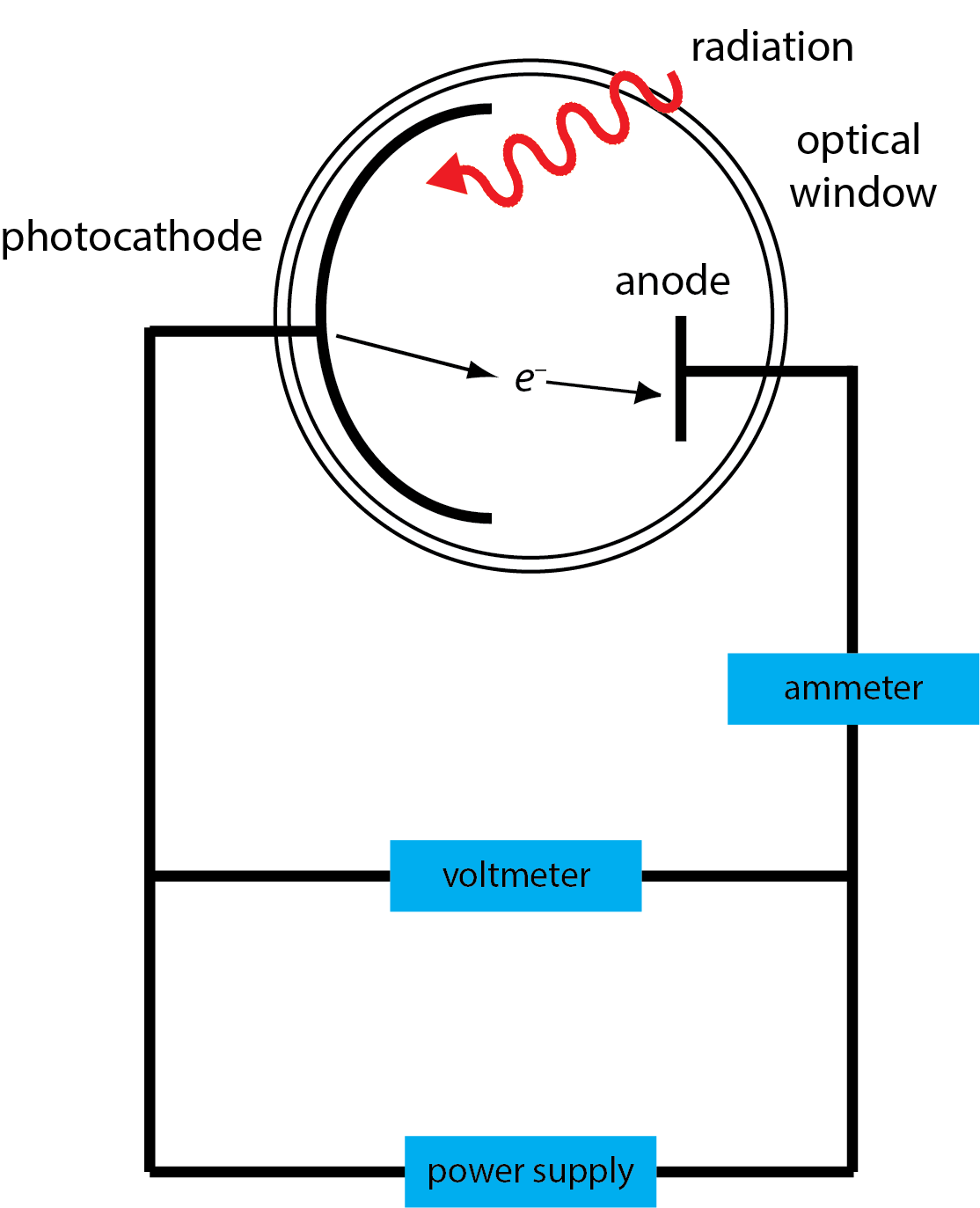
Como se muestra en la Figura\(\PageIndex{1}\), en una celda fotoeléctrica, un metal, como el sodio, se mantiene bajo vacío y se expone a radiación electromagnética, que ingresa a la celda a través de una ventana óptica. Si la frecuencia de la radiación es suficiente, los electrones escapan del metal con una energía cinética que podemos medir; a estos los llamamos fotoelectrones. Si el ánodo de la fotocélula se mantiene a un potencial que es positivo en relación con el potencial aplicado al cátodo, los fotoelectrones se mueven del cátodo al ánodo, generando una corriente que es medida por un amperímetro. Si el voltaje aplicado al ánodo se hace suficientemente negativo, los electrones finalmente fallan en alcanzar el ánodo y la corriente disminuye a cero. El voltaje necesario para detener el flujo de electrones se llama voltaje de detención.
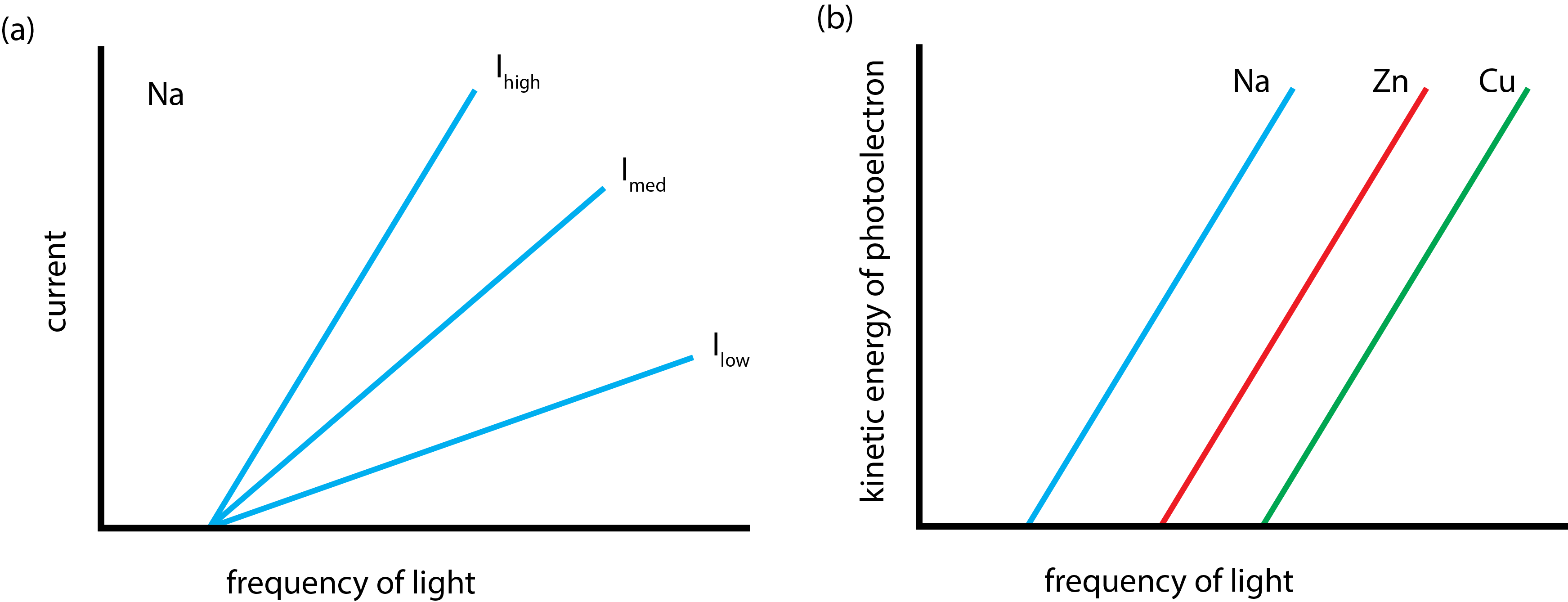
En un espectro fotoelectrónico variamos la frecuencia e intensidad de la radiación electromagnética y observamos su efecto sobre el número de fotoelectrones liberados (medidos como una corriente) o la energía de los fotoelectrones liberados (medida por su energía cinética). Un conjunto típico de experimentos se muestra en la Figura\(\PageIndex{2}a\) usando Na y en la Figura\(\PageIndex{2}b\) usando Na, Zn y Cu. Los datos muestran varias características interesantes. Primero, vemos en la Figura\(\PageIndex{2}a\) que la intensidad de la fuente de luz no tiene efecto sobre la frecuencia mínima de luz necesaria para expulsar un fotoelectrón de Na—a esto lo llamamos la frecuencia umbral— pero que una fuente de radiación electromagnética de alta intensidad da como resultado la liberación de un mayor número de fotoelectrones y, por lo tanto, una corriente mayor que para una fuente de menor intensidad. Segundo, vemos en la Figura\(\PageIndex{2}b\) que diferentes metales tienen diferentes frecuencias umbral, pero que una vez que superamos la frecuencia umbral de cada metal, el cambio en la energía cinética de los fotoelectrones con frecuencia creciente produce líneas de pendientes iguales.
Podemos explicar estas observaciones experimentales si asumimos que la fuente de energía electromagnética tiene una energía,\(E_\text{ER}\), que hace dos cosas: supera la energía que une el fotoelectrón al metal,\(E_\text{BE}\), e imparte la energía restante a la energía cinética del fotoelectrón, \(E_\text{KE}\), donde ER significa radiación electromagnética, BE significa energía de unión y KE significa energía cinética.
\[E_\text{KE} = E_\text{ER} - E_\text{BE} \nonumber \]
Un modelo de onda para la radiación electromagnética es insuficiente para explicar el efecto fotoeléctrico porque cuando golpea el metal la energía de la radiación se distribuiría a través de todos los átomos en la superficie, ninguno de los cuales recibiría entonces una energía que excede la energía de unión del fotoelectrón. En cambio, los resultados en la Figura solo tienen\(\PageIndex{2}\) sentido si asumimos que la luz consiste en partículas discretas con energías que son una función de frecuencia o longitud de onda
\[E_\text{ER} = h \nu = \frac{hc}{\lambda} \label{qm} \]
donde\(h\) está la constante de Plank. Esto nos deja con la siguiente ecuación que relaciona la energía cinética, la energía del fotón y la energía de unión del electrón.
\[E_\text{KE} = h \nu - E_\text{BE} \nonumber \]
Obsérvese que la pendiente de las líneas en la Figura\(\PageIndex{2}b\) es la constante de Plank.
Estados Energéticos
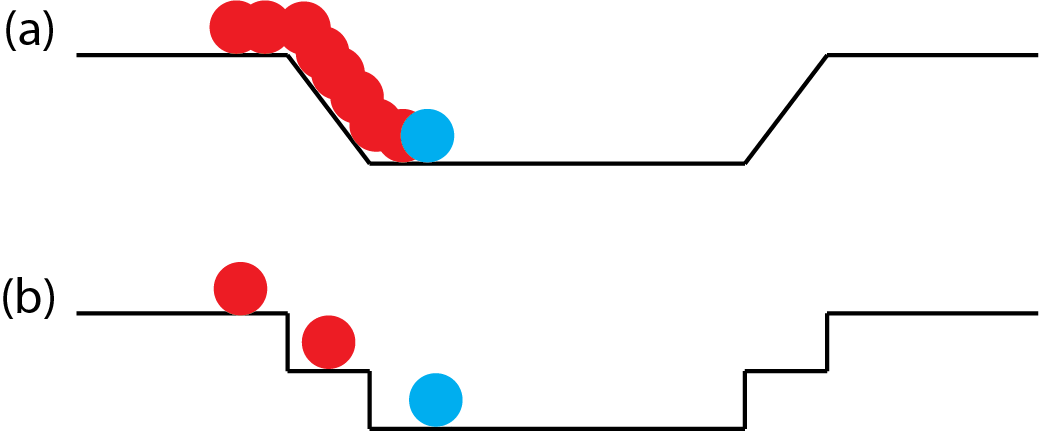
La ecuación\ ref {qm} es central para la partícula, o modelo mecánico cuántico del átomo en el que entendemos que las especies químicas —átomos, iones, moléculas— existen solo en estados discretos, cada uno con una sola energía bien definida. Una ola, por otro lado, puede tomar cualquier energía. Una imagen simple son las posibles energías de una bola a medida que rueda por una rampa (ola) o una escalera (partícula), como en la Figura\(\PageIndex{3}\).
Cuando un átomo, ion o molécula se mueve entre dos de estos estados discretos, la diferencia en energía\(\Delta E\), viene dada por
\[\Delta E = h \nu = \frac{hc}{\lambda} \nonumber \]
En la espectroscopia de absorción, un fotón es absorbido por un átomo, ion o molécula, que experimenta una transición de un estado de menor energía a un estado de mayor energía, o estado excitado (Figura\(\PageIndex{4}a\)). El proceso inverso, en el que un átomo, ion o molécula emite un fotón a medida que se mueve de un estado de mayor energía a un estado de menor energía (\(\PageIndex{4}b\)), se llama emisión.
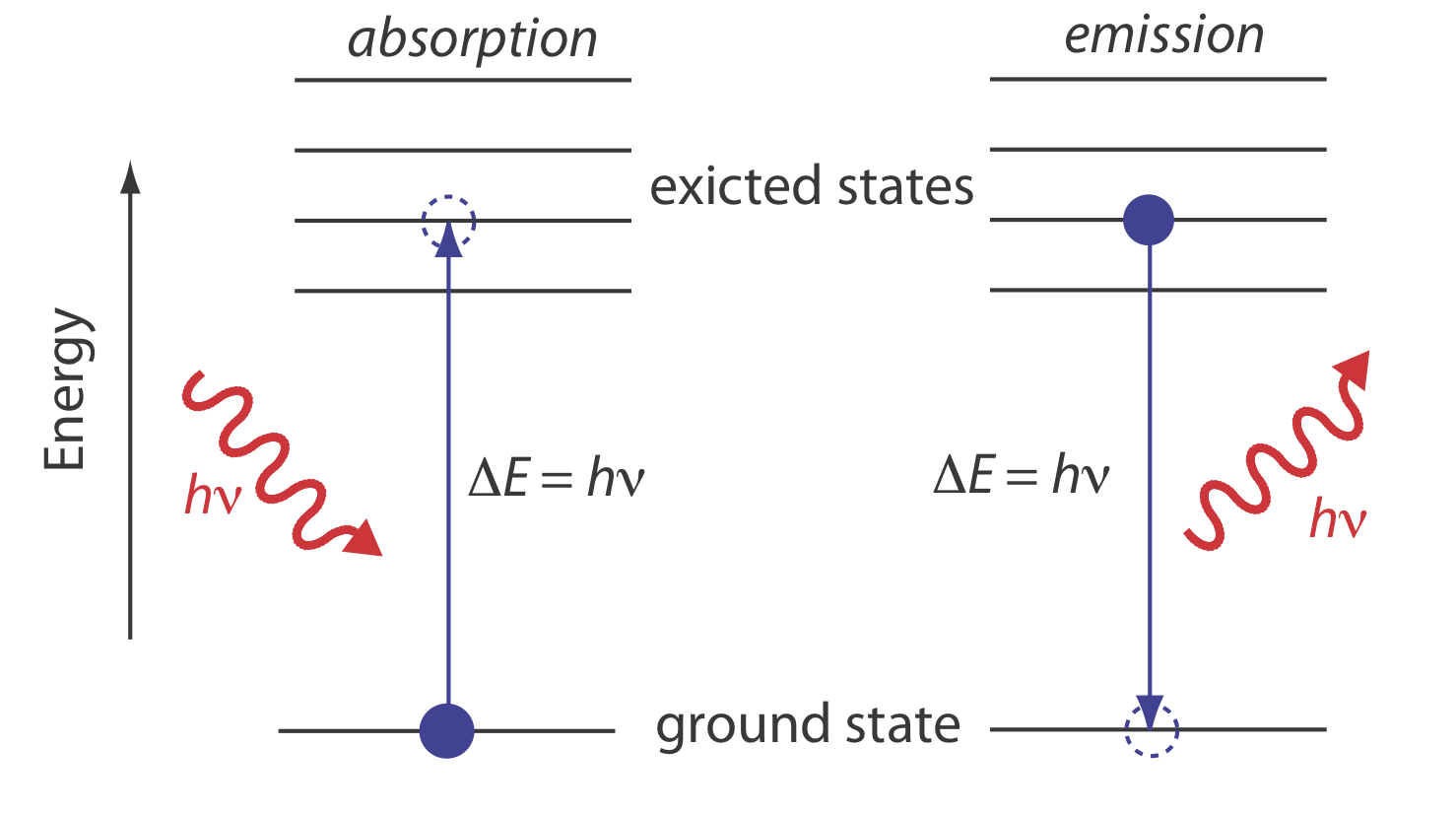
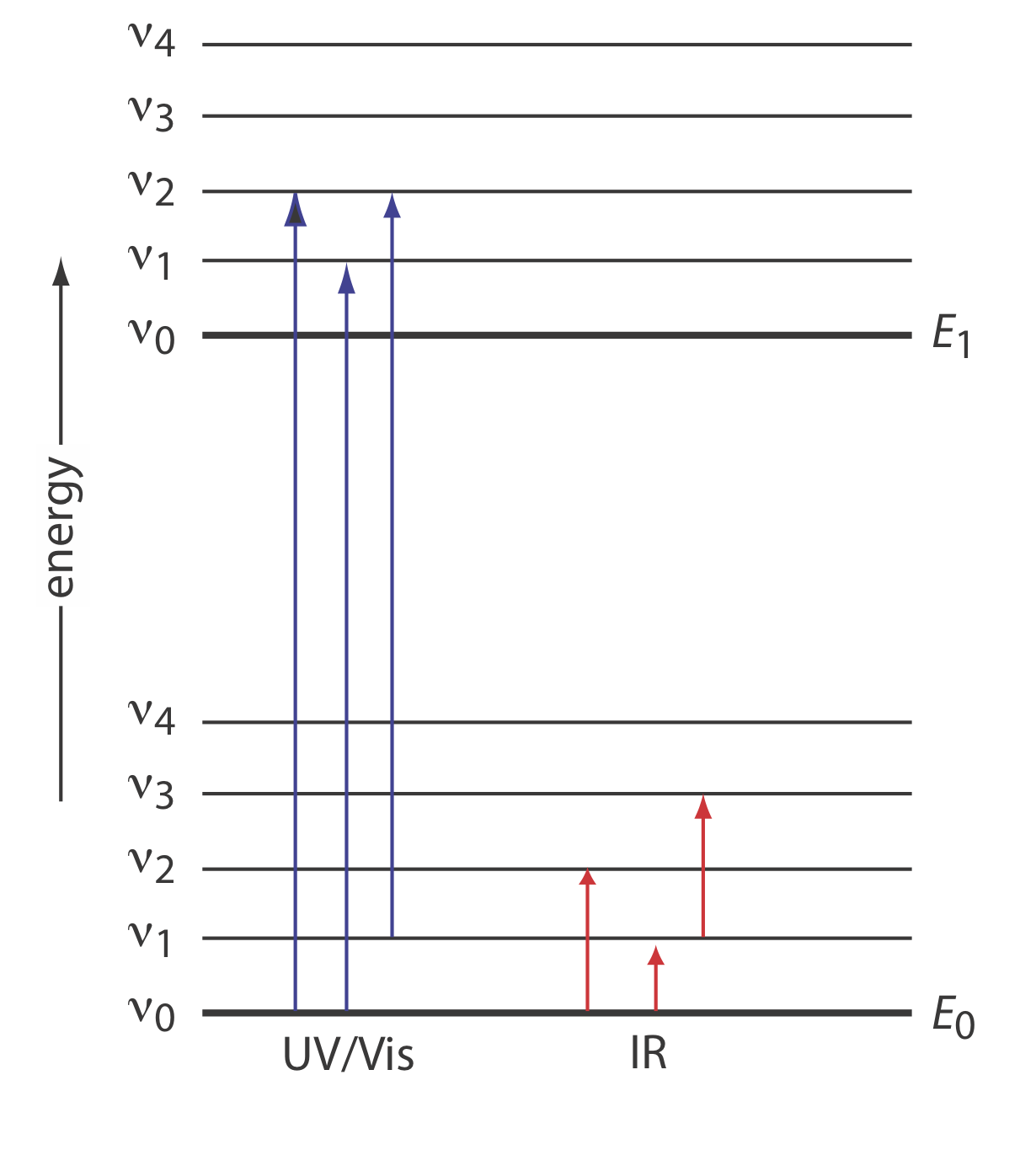
Los tipos de estados energéticos involucrados en la emisión y absorción dependen de la energía de la radiación electromagnética. En general,\(\gamma\) los rayos implican transiciones entre estados nucleares, los rayos X sondean las energías de los electrones a nivel de núcleo, la radiación ultravioleta-visible sondea las energías de los electrones de valencia, la radiación infrarroja proporciona información sobre los estados de energía vibracional, la radiación de microondas sondea la energía rotacional niveles y espines de electrones, y las ondas de radio proporcionan información sobre los espines nucleares. Si bien la espectroscopia infrarroja puede proporcionar información sobre los estados de energía vibratoria de una molécula, las energías disponibles en la espectroscopia ultravioleta-visible proporcionan información tanto sobre los estados electrónicos de la molécula como sobre sus estados vibracionales, como se muestra en la Figura\(\PageIndex{5}\).