12.1: Principios Fundamentales
- Page ID
- 78727
En el Capítulo 6 se introdujo el espectro electromagnético y las propiedades características de los fotones, como las longitudes de onda, las frecuencias y las energías de la luz ultravioleta, visible e infrarroja. El rango de longitud de onda para fotones de radiación de rayos X se extiende de aproximadamente 0.01 nm a 10 nm. Aunque estamos acostumbrados a reportar la longitud de onda de un fotón en nanómetros, por razones históricas la longitud de onda de un fotón de rayos X generalmente se reporta en angstroms (para los cuales el símbolo es Å) donde 1 Å = 0.1 nm; así el rango de longitud de onda de 0.01 nm a 10 nm para radiación de rayos X también se expresa como 0.1 Å a 100 Å. Este rango de longitudes de onda corresponde a un rango de frecuencias de aproximadamente\(3 \times 10^{19} \text{ s}^{-1}\) a\(3 \times 10^{16} \text{ s}^{-1}\), y un rango de energías de\(2 \times 10^{-19} \text{ J}\) a\(2 \times 10^{-17} \text{ J}\).
Fuentes de Rayos X
Hay tres formas rutinarias de generar rayos X, cada una de las cuales está cubierta en esta sección: podemos bombardear un metal adecuado con un haz de electrones de alta energía, podemos usar una radiografía para estimular la emisión de rayos X adicionales a través de la fluorescencia, y podemos usar un isótopo radiactivo que emite rayos X como decae.
Obtención de rayos X de fuentes de haz de electrones
Un haz de electrones se crea calentando un filamento de alambre de tungsteno a una temperatura a la que libera electrones. Estos electrones son arrastrados hacia un objetivo metálico aplicando un voltaje de aceleración entre el objetivo metálico y el alambre de tungsteno. El resultado es el amplio continuo de emisión de rayos X en la Figura\(\PageIndex{1}\). La fuente de este espectro de emisión continua es la reducción en la energía cinética de los electrones a medida que chocan con el objetivo metálico. La pérdida de energía cinética resulta en la producción de fotones en un amplio rango de longitudes de onda y se conoce como Bremsstrahlung, o radiación de frenado.
En capítulos anteriores dividimos las fuentes de fotones en dos amplios grupos: fuentes continuas, como una lámpara de tungsteno, que producen fotones en todas las longitudes de onda entre un límite inferior y un límite superior, y fuentes lineales, como una lámpara de cátodo hueco, que producen fotones para una o más longitudes de onda discretas. Las fuentes utilizadas para generar rayos X también generan espectros continuos y/o lineales.
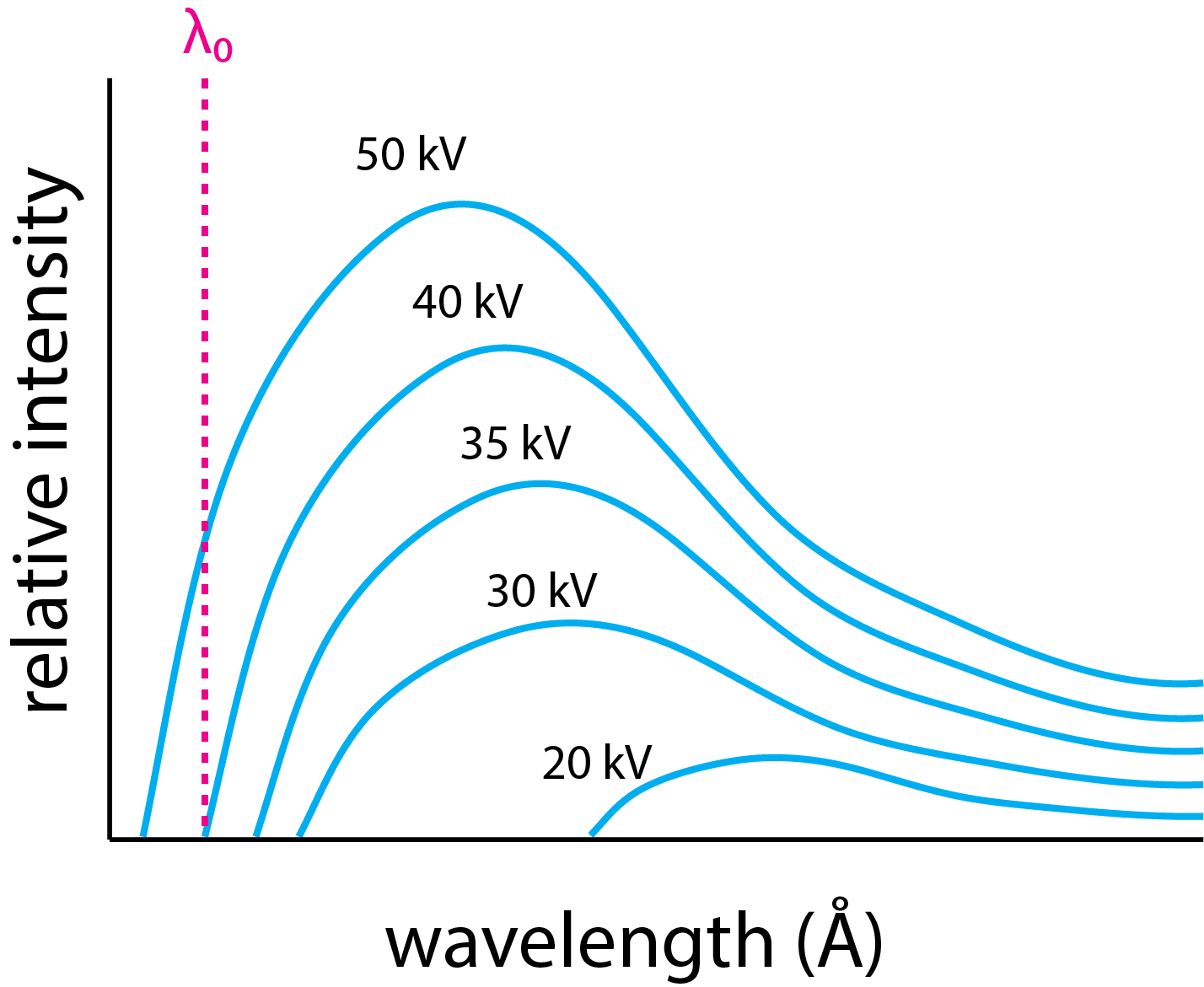
El límite de longitud de onda inferior para la emisión de rayos X\(\lambda_0\), identificado aquí como, es la pérdida máxima posible de energía cinética, KE, y es igual a
\[KE = \frac{hc}{\lambda_0} = Ve \label{lmin} \]
donde h es la constante de Planck, c es la velocidad de la luz, V es el voltaje de aceleración y e es la carga en el electrón. El producto del voltaje de aceleración y la carga en el electrón es la energía cinética de los electrones. Resolviendo Ecuación\ ref {lmin} para\(\lambda_0\) da
\[\lambda_0 = \frac{hc}{Ve} = \frac{12.398 \text{ kV Å}}{V} \label{lambdamin2} \]
donde\(\lambda_0\) está en angstroms y V está en kilovoltios. Tenga en cuenta que la Ecuación\ ref {lmin} y la Ecuación\ ref {lambdamin2} no incluyen ningún término que dependa del metal objetivo, lo que significa que para cualquier voltaje de aceleración,\(\lambda_0\) es el mismo para todos los objetivos metálicos. Tabla\(\PageIndex{1}\) da valores de\(\lambda_0\) que abarcan el rango de voltajes de aceleración en la Figura\(\PageIndex{1}\).
| voltaje de aceleración (kV) | \(\lambda_0\)(Å) |
|---|---|
| 20 | \ (\ lambda_0\) (Å) ">0.62 |
| 25 | \ (\ lambda_0\) (Å) ">0.50 |
| 30 | \ (\ lambda_0\) (Å) ">0.41 |
| 35 | \ (\ lambda_0\) (Å) ">0.35 |
| 40 | \ (\ lambda_0\) (Å) ">0.31 |
| 45 | \ (\ lambda_0\) (Å) ">0.28 |
| 50 | \ (\ lambda_0\) (Å) ">0.25 |
Si aplicamos un voltaje de aceleración suficientemente grande, entonces el espectro de emisión consistirá tanto en un espectro continuo como en un espectro lineal, como vemos en la Figura\(\PageIndex{2}\) con molibdeno como metal objetivo. El espectro consiste tanto en un continuo similar al de la Figura\(\PageIndex{1}\), como por dos líneas, una a una longitud de onda de 0.63 Å y otra a una longitud de onda de 0.71 Å. La fuente de estas líneas es la emisión de rayos X de iones de estado excitado que se forman cuando un electrón de energía suficientemente alta del haz de electrones elimina un electrón de un orbital atómico cercano al núcleo. A medida que los electrones en los orbitales atómicos a mayor distancia del núcleo caen al orbital atómico con una vacante, liberan su energía extra como fotón.
Si bien la emisión de fondo del continuo es la misma para todos los objetivos metálicos, la energía para las líneas tiene valores que son característicos para diferentes metales porque la energía para eliminar un electrón varía de elemento a elemento, aumentando con el número atómico. Por ejemplo, un voltaje de aceleración de al menos
\[V = \frac{12.398 \text{ kV Å}}{0.61 Å} = 20 \text{ kV} \nonumber \]
para generar el espectro lineal para molibdeno en la Figura\(\PageIndex{2}\).
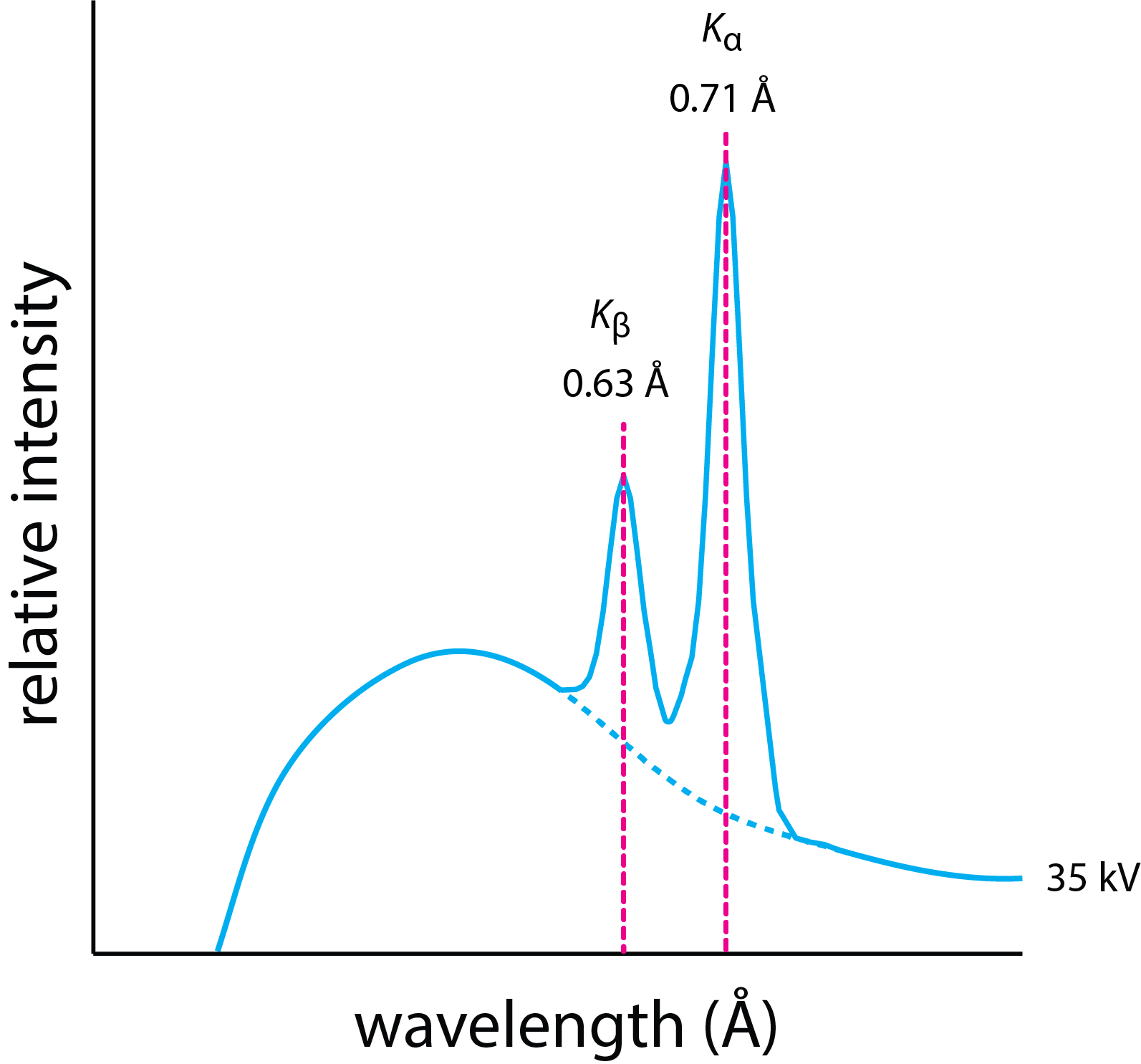
Las líneas de emisión características para molibdeno en la Figura\(\PageIndex{2}\) se identifican como\(K_{\alpha}\) y\(K_{\beta}\), una notación con la que quizás no esté familiarizado. El diagrama simplificado de nivel de energía en la Figura nos\(\PageIndex{3}\) ayudará a entender esta notación. Cada flecha en este diagrama de nivel de energía muestra una transición en la que un electrón se mueve desde un orbital a mayor distancia del núcleo a un orbital más cercano al núcleo. Las letras K, L y M corresponden al número cuántico principal n, que tiene valores de 1, 2, 3... que indican la vacante inicial creada por la colisión del haz de iones con el metal objetivo. Los símbolos griegos\(\alpha\),\(\beta\), e\(\gamma\) indican la fuente del electrón que llena esta vacante en términos de su cambio en el número cuántico principal,\(\Delta n\). Un electrón que se mueve de n = 2 a n = 1 y un electrón que se mueve de n = 4 a n = 3 tienen la misma designación de\(\alpha\). La línea de emisión en la Figura\(\PageIndex{2}\) identificada como\(K_{\beta}\), por lo tanto, es el resultado de que un electrón en el caparazón n = 3 se mueve hacia una vacante en el caparazón n = 1\(K\).
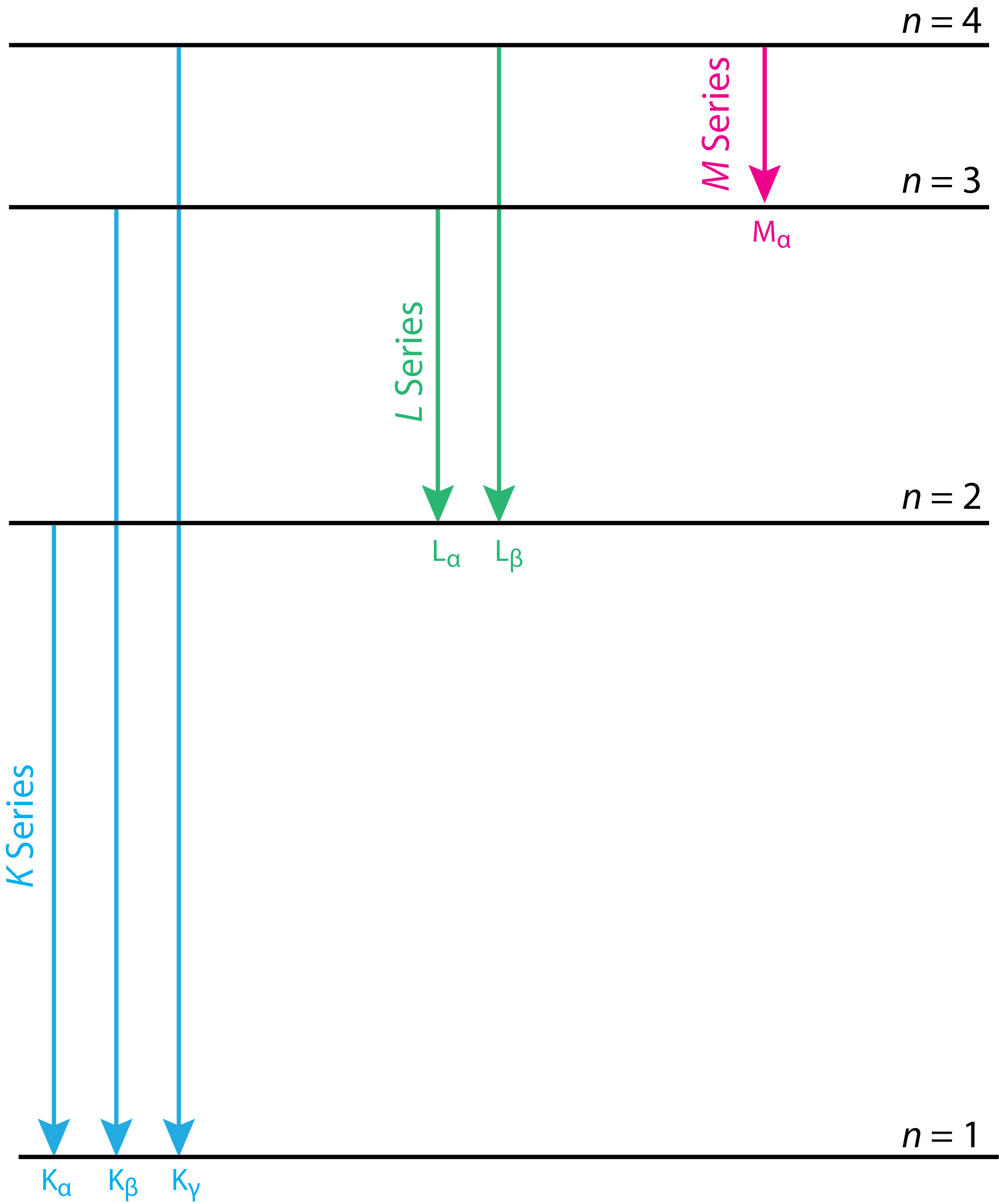
¿Por qué Figure es\(\PageIndex{3}\) un diagrama simplificado de nivel de energía? Por cada n > 1 hay más de un orbital atómico. Cuando n = 2 hay tres niveles de energía: uno que corresponde a l = 0, uno que corresponde a l = 1 y m l = 0, y otro que corresponde a l = 1 y m l = ±1. Las transiciones permitidas a los niveles de energía n = 1 requieren un cambio en el valor para l; así, esperamos encontrar dos líneas de emisión de n = 2 a n = 1 en lugar de la que se muestra en la Figura\(\PageIndex{3}\). Estas dos líneas, que podemos identificar como\(\text{K}_{\alpha 1}\) y\(\text{ K}_{\alpha 2}\), generalmente son lo suficientemente cercanas en valor como para que no se resuelvan en el espectro de emisión de rayos X. Por ejemplo,\(\text{K}_{\alpha 1} = 0.709\) y\(\text{ K}_{\alpha 2} = 0.714\) para molibdeno. Puede encontrar una tabla de líneas de emisión de rayos X aquí.
Obtención de rayos X a partir de fuentes fluorescentes
Cuando un átomo en estado excitado emite un fotón como medio para regresar a un estado energético inferior, la forma en que describamos el proceso depende de la fuente de energía que creó el estado excitado. Cuando la excitación es el resultado de la energía térmica, llamamos al proceso emisión atómica. Cuando la excitación es el resultado de la absorción de un fotón, llamamos al proceso fluorescencia atómica. En la fluorescencia de rayos X, la excitación se produce utilizando fotones de una fuente de radiación continua de rayos X. Más adelante en este capítulo se proporcionan más detalles sobre la fluorescencia de rayos X.
Obtención de Rayos X de Fuentes Radiactivas
Los átomos que tienen el mismo número de protones pero un número diferente de neutrones son isótopos. Para identificar un isótopo usamos la notación\({}_Z^A E\), donde E es el símbolo atómico del elemento, Z es el número atómico del elemento y A es el número de masa atómica del elemento. Aunque los diferentes isótopos de un elemento tienen las mismas propiedades químicas, sus propiedades nucleares no son idénticas. La diferencia más importante entre los isótopos es su estabilidad. La configuración nuclear de un isótopo estable permanece constante con el tiempo. Sin embargo, los isótopos inestables se desintegran espontáneamente, emitiendo partículas de desintegración radiactiva a medida que se transforman en una forma más estable.
El número atómico de un elemento, Z, es igual al número de protones y su masa atómica, A, es igual a la suma del número de protones y neutrones. Representamos un isótopo de carbono-13\(_{6}^{13} \text{C}\) porque el carbono tiene seis protones y siete neutrones. A veces omitimos Z de esta notación, identificando el elemento y el número atómico es repetitivo porque todos los isótopos de carbono tienen seis protones y cualquier átomo que tenga seis protones es un isótopo de carbono. Así, 13 C y C—13 son notaciones alternativas para este isótopo de carbono.
Las partículas radiactivas pueden desintegrarse de varias maneras, una de las cuales resulta en la emisión de rayos X. Por ejemplo, 55 Fe puede capturar un electrón y someterse a un proceso en el que un protón se convierte en neutrón, llegando a ser 55 Mn y liberando el exceso de energía como\(\text{K}_{\alpha}\) rayos X. No vamos a dar más consideración a las fuentes radiactivas de emisión atómica de rayos X; véase el Capítulo 32, sin embargo, para una discusión más detallada sobre los métodos de análisis radiactivos.
Absorción Rayos
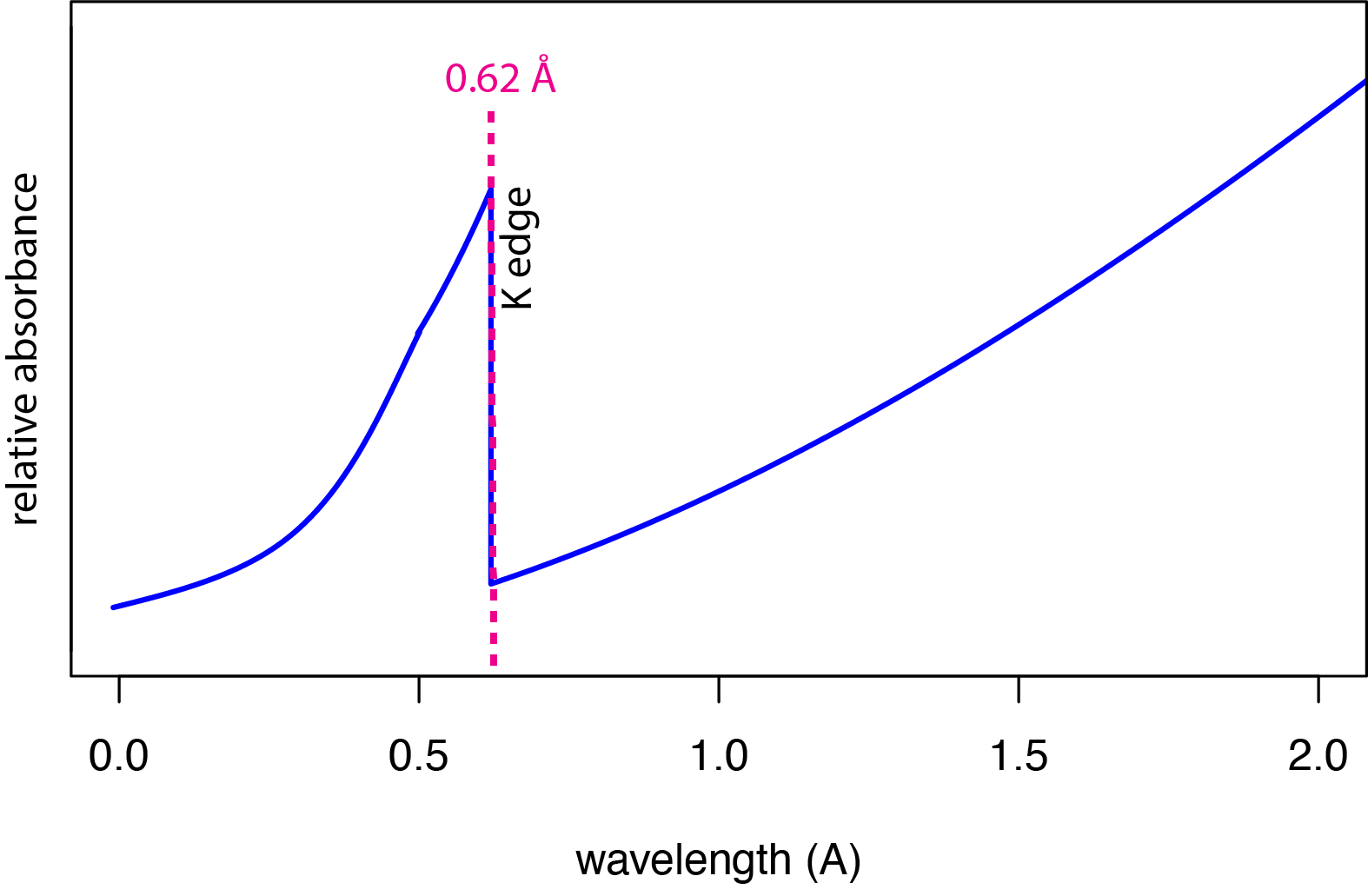
La Figura\(\PageIndex{4}\) muestra una porción del espectro de absorción de rayos X de molibdeno en el mismo rango de longitudes de onda que se muestra en la Figura\(\PageIndex{2}\) para su espectro de emisión. Ambos espectros son relativamente simples: el espectro de emisión consiste en dos líneas superpuestas sobre un fondo continuo, y el espectro de absorbancia consiste en una sola línea, identificada aquí como el borde K.
El Proceso de Absorción
Si un fotón de rayos X es de suficiente energía, entonces su absorbancia por un átomo da como resultado la expulsión de un electrón de uno de los orbitales atómicos más interiores del átomo, lo que puedes reconocer como la producción de un fotoelectrón. Para el molibdeno, se necesita una longitud de onda de 0.62 Å (una energía de 20.0 kV) para expulsar un fotoelectrón de la capa K (n = 1). A esta longitud de onda la probabilidad de absorción es mayor. A longitudes de onda más cortas (mayores energías) hay suficiente energía para expulsar el electrón, sin embargo, la probabilidad de absorción disminuye y la absorbancia relativa disminuye lentamente. La disminución abrupta de la absorbancia para longitudes de onda mayores a 0.62 Å—esta disminución abrupta es la fuente del término borde— ocurre porque los fotones ya no tienen suficiente energía para expulsar un electrón de la capa K. El lento aumento de absorbancia a longitudes de onda mayores que el borde K es el resultado de la expulsión de electrones de la cubierta L, que tiene bordes en 4.3 Å, 4.7 Å y 4.9 Å.
El diagrama simplificado de nivel de energía en\(\PageIndex{3}\) muestra solo un nivel de energía para n = 2 (la cáscara L). Como señalamos anteriormente, hay tres niveles de energía cuando n = 2: uno que corresponde a l = 0, uno que corresponde a l = 1 y m l = 0, y uno que corresponde a l = 1 y m l = ±1. Los tres bordes correspondientes a estos niveles de energía se identifican como L I, L II y L III.
Ley de la cerveza y absorción de rayos X
Cuando una fuente de rayos X pasa a través de una muestra con un grosor de x, se mantiene la siguiente ecuación
\[A = -\ln \frac{P}{P_0} = \mu_{\text{M}} \rho x \label{beerxray} \]
donde A es la absorbancia,\(P_0\) es la potencia de la fuente de rayos X incidente sobre la muestra,\(P\) es la potencia de la fuente de rayos X después de que pasa a través de la muestra,\(\mu_{\text{M}}\) es el coeficiente de absorción de masa de la muestra y\(\rho\) es la densidad de la muestra. Es posible que hayas notado la similitud entre esta ecuación y la ecuación para la ley de Beer que encontramos por primera vez en el Capítulo 6
\[A = -\ln \frac{P}{P_0} = \epsilon b C \label{beer} \]
donde\(\epsilon\) es la absortividad molar,\(b\) es la longitud de la trayectoria y\(C\) es la concentración molar. Obsérvese que tanto la densidad (g/mL) como la molaridad (mol/L) son una medida de concentración que expresa la cantidad del material absorbente presente en la muestra.
Fluorescencia Rayos
Cuando un electrón es expulsado de una concha cerca del núcleo por la absorción de una radiografía, la vacante creada finalmente se llena cuando un electrón a una mayor distancia del núcleo se mueve hacia abajo. Debido a que se necesita más energía para expulsar un electrón y crear una vacante que la que devuelve el movimiento de otros electrones a la vacante, la emisión fluorescente resultante de los rayos X es siempre a longitudes de onda que son más largas (menor energía) que la longitud de onda que se absorbió. Esto lo vemos en la Figura\(\PageIndex{4}\) y Figura\(\PageIndex{1}\) para molibdeno donde absorbe una radiografía con una longitud de onda de 0.62 Å y emite rayos X con longitudes de onda de 0.63 Å y 0.71 Å.
Difracción de rayos X
Cuando un haz de rayos X se enfoca sobre una muestra que tiene un patrón regular (cristalino) de átomos en tres dimensiones, parte de la radiación se dispersa desde la superficie y parte de la radiación pasa a través de la siguiente capa de átomos donde continúa la combinación de dispersión y paso. Como resultado de este proceso, la radiación se somete a difracción en la que los rayos X de algunas longitudes de onda parecen reflejarse fuera de la superficie mientras que los rayos X de otras longitudes de onda no lo hacen. Las condiciones del resultado en difracción son fáciles de entender usando el diagrama de la Figura\(\PageIndex{5}\).
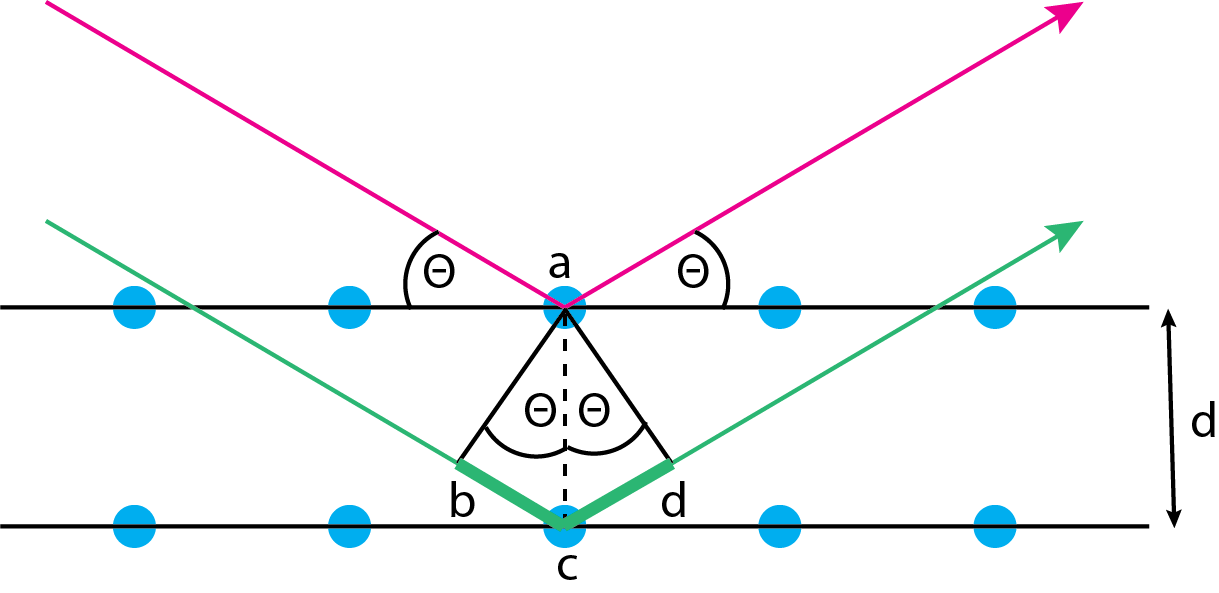
Las flechas roja y verde son dos haces paralelos de rayos X que se enfocan en un sólido cristalino ordenado que consiste en un patrón repetible en capas de átomos mostrado por los círculos azules. Los dos haces de rayos X se encuentran con el sólido en un ángulo de\(\theta\). La radiografía que se muestra en rojo se dispersa fuera de la primera capa, saliendo en el mismo ángulo de\(\theta\). La radiografía que se muestra en verde penetra a la segunda capa donde sufre dispersión, saliendo en el mismo ángulo de\(\theta\). Sabemos por la superposición de ondas (ver Capítulo 6) que los dos haces de rayos X permanecerán en fase, y así experimentarán interferencia constructiva, solo si la distancia adicional recorrida por la onda verde —la suma de los segmentos de línea\(\overline{bc}\) y\(\overline{cd}\) — es un múltiplo entero de la longitud de onda; por lo tanto
\[\overline{bc} + \overline{cd} = n \lambda \label{bragg1} \]
También sabemos que la longitud de los segmentos de línea\(\overline{bc}\) y\(\overline{cd}\) están dados por
\[\overline{bc}= \overline{cd} = d \sin \theta \label{bragg2} \]
donde\(d\) está la distancia entre las capas del cristal. Combinando la ecuación\ ref {bragg1} y la ecuación\ ref {bragg2} da
\[n \lambda = 2 d \sin \theta \label{bragg3} \]
Reordenando la ecuación\ ref {bragg3} muestra que observaremos difracción solo en ángulos que satisfagan la ecuación
\[\sin \theta = \frac{n \lambda}{2d} \label{bragg4} \]


