13.2: Ley de Cerveza
- Page ID
- 78933
Absorbancia y Concentración
Cuando la radiación electromagnética monocromática pasa a través de una capa infinitesimalmente delgada de muestra de espesor dx, experimenta una disminución en su potencia de dP (Figura\(\PageIndex{1}\)).
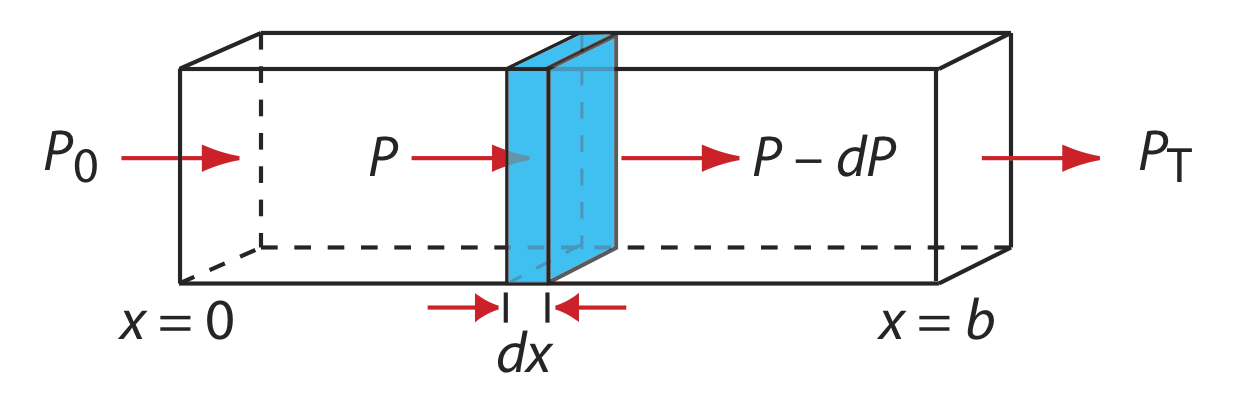
Esta disminución fraccionaria en la potencia es proporcional al grosor de la muestra y a la concentración del analito, C; así
\[-\frac{d P}{P}=\alpha C d x \label{BL1} \]
donde P es la potencia incidente sobre la capa delgada de la muestra y\(\alpha\) es una constante de proporcionalidad. Integrando el lado izquierdo de la ecuación\ ref {BL1} sobre el grosor completo de la muestra
\[-\int_{P=P_0}^{P=P_t} \frac{d P}{P}=\alpha C \int_{x=0}^{x=b} d x \nonumber \]
\[\ln \frac{P_{0}}{P_T}=\alpha b C \nonumber \]
convertir de ln a log, y sustituir en la ecuación que relaciona la transmitancia con la absorbancia
\[A = -\text{log}T = -\text{log}\frac{P_\text{T}}{P_0} \nonumber \]
da
\[A=a b C \label{BL2} \]
donde a es la absortividad del analito con unidades de cm —1 conc —1. Si expresamos la concentración usando molaridad, entonces reemplazamos a con la absortividad molar\(\varepsilon\), que tiene unidades de cm —1 M —1.
\[A=\varepsilon b C \label{BL3} \]
La absortividad y la absortividad molar son proporcionales a la probabilidad de que el analito absorba un fotón de una energía dada. Como resultado, los valores tanto para a como\(\varepsilon\) dependen de la longitud de onda del fotón absorbido.
Se coloca una solución\(5.00 \times 10^{-4}\) M de analito en una celda de muestra que tiene una longitud de trayectoria de 1.00 cm. A una longitud de onda de 490 nm, la absorbancia de la solución es 0.338. ¿Cuál es la absortividad molar del analito a esta longitud de onda?
Solución
Resolviendo la ecuación\ ref {BL3} para\(\epsilon\) y hacer sustituciones apropiadas da
\[\varepsilon=\frac{A}{b C}=\frac{0.338}{(1.00 \ \mathrm{cm})\left(5.00 \times 10^{-4} \ \mathrm{M}\right)}=676 \ \mathrm{cm}^{-1} \ \mathrm{M}^{-1} \nonumber \]
Una solución del analito del Ejemplo 13.2.1 tiene una absorbancia de 0.228 en una celda de muestra de 1.00-cm. ¿Cuál es la concentración del analito?
- Contestar
-
Hacer las sustituciones apropiadas en la ley de Beer
\[A=0.228=\varepsilon b C=\left(676 \ \mathrm{M}^{-1} \ \mathrm{cm}^{-1}\right)(1 \ \mathrm{cm}) C \nonumber \]
y resolver para C da una concentración de\(3.37 \times 10^{-4}\) M.
La ecuación\ ref {BL2} y la ecuación\ ref {BL3}, que establecen la relación lineal entre absorbancia y concentración, se conocen como ley de Beer. Las curvas de calibración basadas en la ley de Beer son comunes en los análisis cuantitativos.
Como suele ocurrir, la formulación de una ley es más complicada de lo que su nombre sugiere. Este es el caso, por ejemplo, de la ley de Beer, que también se conoce como la ley Beer-Lambert o la ley Beer-Lambert-Bouguer. Pierre Bouguer, en 1729, y Johann Lambert, en 1760, señalaron que la transmitancia de la luz disminuye exponencialmente con un aumento en el grosor de la muestra.
\[T \propto e^{-b} \nonumber \]
Posteriormente, en 1852, August Beer señaló que la transmitancia de la luz disminuye exponencialmente a medida que aumenta la concentración de las especies absorbentes.
\[T \propto e^{-C} \nonumber \]
Juntos, y cuando se escriben en términos de absorbancia en lugar de transmitancia, estas dos relaciones conforman lo que conocemos como ley de Beer.
Ley de Cerveza y Muestras Multicomponentes
Podemos extender la ley de Beer a una muestra que contenga varios componentes absorbentes. Si no hay interacciones entre los componentes, entonces las absorbancias individuales, A i, son aditivas. Para una mezcla de dos componentes de X e Y de analitos, la absorbancia total, A tot, es
\[A_{tot}=A_{X}+A_{Y}=\varepsilon_{X} b C_{X}+\varepsilon_{Y} b C_{Y} \nonumber \]
Generalizando, la absorbancia para una mezcla de n componentes, una mezcla, es
\[A_{m i x}=\sum_{i=1}^{n} A_{i}=\sum_{i=1}^{n} \varepsilon_{i} b C_{i} \label{BL4} \]
Limitaciones a la Ley de Cerveza
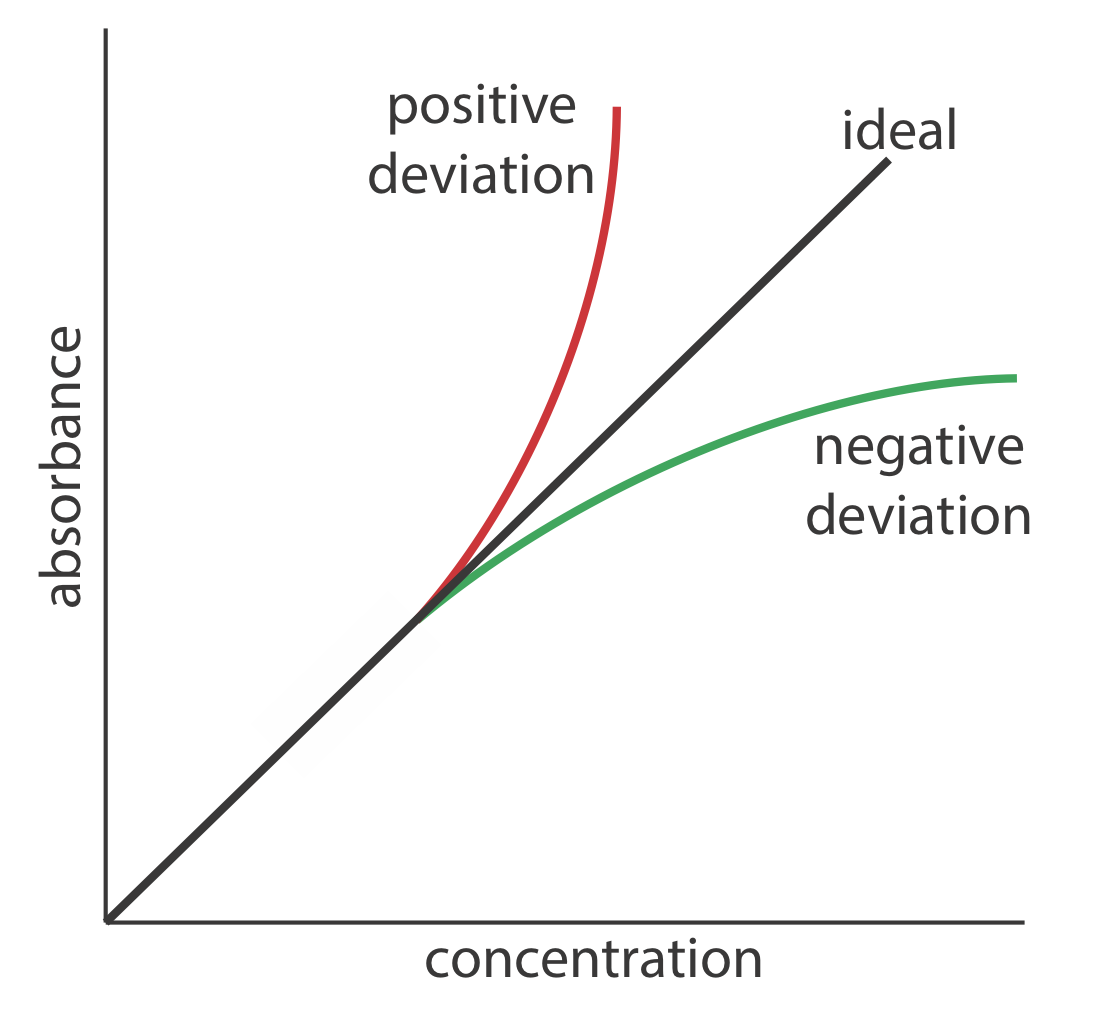
La ley de Beer sugiere que una trama de absorbancia vs. concentración —llamaremos a esto una trama de ley de Beer— es una línea recta con una intersección y de cero y una pendiente de ab o\(\varepsilon b\). En algunos casos la trama de la ley de Beer se desvía de este comportamiento ideal (ver Figura\(\PageIndex{2}\)), y tales desviaciones de la linealidad se dividen en tres categorías: fundamental, química e instrumental.
Limitaciones fundamentales a la Ley de Cerveza
La ley de la cerveza es una ley limitante que solo es válida para bajas concentraciones de analito. Hay dos aportes a esta limitación fundamental a la ley de Beer. A concentraciones más altas las partículas individuales de analito ya no son independientes entre sí. La interacción resultante entre partículas de analito puede cambiar la capacidad de absorción del analito. Una segunda contribución es que la absortividad de un analito depende del índice de refracción de la solución. Debido a que el índice de refracción de una solución varía con la concentración del analito, los valores de a y\(\varepsilon\) pueden cambiar. Para concentraciones suficientemente bajas de analito, el índice de refracción es esencialmente constante y una gráfica de la ley de Beer es lineal.
Limitaciones Químicas a la Ley de Cerveza
Una desviación química de la ley de Beer puede ocurrir si el analito está involucrado en una reacción de equilibrio. Consideremos, por ejemplo, el ácido débil, el HA. Para construir una parcela de ley de Beer, preparamos una serie de soluciones estándar, cada una de las cuales contiene una concentración total conocida de HA, y luego medimos la absorbancia de cada solución a la misma longitud de onda. Debido a que el HA es un ácido débil, está en equilibrio con su base débil conjugada, A —.
En las ecuaciones que siguen, la base débil conjugada A — a veces se escribe como A ya que es fácil confundir el símbolo con carga aniónica como un signo menos; así, escribiremos\(C_A\) en lugar de\(C_{A^-}\).
\[\mathrm{HA}(a q)+\mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons\mathrm{H}_{3} \mathrm{O}^{+}(a q)+\mathrm{A}^{-}(a q) \nonumber \]
Si tanto HA como A absorben a la longitud de onda seleccionada, entonces la ley de Beer es
\[A=\varepsilon_{\mathrm{HA}} b C_{\mathrm{HA}}+\varepsilon_{\mathrm{A}} b C_{\mathrm{A}} \label{BL5} \]
Porque la concentración total del ácido débil, C total, es
\[C_{\mathrm{total}}=C_{\mathrm{HA}}+C_{\mathrm{A}} \nonumber \]
podemos escribir las concentraciones de HA y A — como
\[C_{\mathrm{HA}}=\alpha_{\mathrm{HA}} C_{\mathrm{total}} \label{BL6} \]
\[C_{\text{A}} = (1 - \alpha_\text{HA})C_\text{total} \label{BL7} \]
donde\(\alpha_\text{HA}\) está la fracción de ácido débil presente como HA. Sustituyendo la Ecuación\ ref {BL6} y la Ecuación\ ref {BL7} en la Ecuación\ ref {BL5} y reordenando, da
\[A=\left(\varepsilon_{\mathrm{HA}} \alpha_{\mathrm{HA}}+\varepsilon_{\mathrm{A}}-\varepsilon_{\mathrm{A}} \alpha_{\mathrm{A}}\right) b C_{\mathrm{total}} \label{BL8} \]
Para obtener una parcela lineal de ley de Beer, debemos cumplir una de dos condiciones. Si\(\varepsilon_\text{HA}\) y\(\varepsilon_{\text{A}}\) tienen el mismo valor en la longitud de onda seleccionada, entonces la Ecuación\ ref {BL8} simplifica a
\[A = \varepsilon_{\text{A}}bC_\text{total} = \varepsilon_\text{HA}bC_\text{total} \nonumber \]
Alternativamente, si\(\alpha_\text{HA}\) tiene el mismo valor para todas las soluciones estándar, entonces cada término dentro de los paréntesis de la Ecuación\ ref {BL8} es constante, que reemplazamos con k, y se obtiene una curva de calibración lineal en cualquier longitud de onda.
\[A=k b C_{\mathrm{total}} \nonumber \]
Debido a que el HA es un ácido débil, el valor de\(\alpha_\text{HA}\) varía con el pH. Para mantener\(\alpha_\text{HA}\) constante, amortiguamos cada solución estándar al mismo pH. Dependiendo de los valores relativos de\(\alpha_\text{HA}\) y\(\alpha_{\text{A}}\), la curva de calibración tiene una desviación positiva o negativa de la ley de Beer si no amortiguamos los estándares al mismo pH.
Limitaciones instrumentales a la ley de la cerveza
Existen dos limitaciones instrumentales principales a la ley de Beer: la radiación parásita y la radiación no policromática.
La radiación parásita es la primera contribución a las desviaciones instrumentales de la ley de Beer. La radiación parásita surge de imperfecciones en el selector de longitud de onda que permiten que la luz ingrese al instrumento y llegue al detector sin pasar por la muestra. La radiación parásita agrega una contribución adicional, P parásita, a la potencia radiante que llega al detector; así
\[A=-\log \frac{P_{\mathrm{T}}+P_{\text { stray }}}{P_{0}+P_{\text { stray }}} \nonumber \]
Para una pequeña concentración de analito, P parásito es significativamente menor que P 0 y P T, y la absorbancia no se ve afectada por la radiación parásita. Para mayores concentraciones de analito, menos luz pasa a través de la muestra y P T y P se vuelven similares en magnitud. Este resultado es una absorbancia menor de lo esperado, y una desviación negativa de la ley de Beer.
La segunda limitación es que la ley de Beer asume que la radiación que llega a la muestra es de una sola longitud de onda, es decir, asume una fuente de radiación puramente monocromática. Incluso el mejor selector de longitud de onda, sin embargo, pasa la radiación con un ancho de banda efectivo pequeño pero finito. Supongamos que tenemos una fuente de línea que emite luz a dos longitudes de onda,\(\lambda^{\prime}\) y\(\lambda^{\prime \prime}\). Cuando se tratan por separado, las absorbancias a estas longitudes de onda, A' y A′′, son
\[A^{\prime}=-\log \frac{P_{\mathrm{r}}^{\prime}}{P_{0}^{\prime}}=\varepsilon^{\prime} b C \quad \quad A^{\prime \prime}=-\log \frac{P_{\mathrm{T}}^{\prime \prime}}{P_{0}^{\prime \prime}}=\varepsilon^{\prime \prime} b C \nonumber \]
Si ambas longitudes de onda se miden simultáneamente, la absorbancia es
\[A=-\log \frac{\left(P_{\mathrm{T}}^{\prime}+P_{\mathrm{T}}^{\prime \prime}\right)}{\left(P_{0}^{\prime}+P_{0}^{\prime \prime}\right)} \nonumber \]
Expandir la función logarítmica del lado derecho de la ecuación da
\[A = \log (P_0^{\prime} + P_0^{\prime \prime}) - \log (P_\text{T}^\prime + P_\text{T}^{\prime \prime}) \label{IL1} \]
A continuación, necesitamos encontrar una relación entre\(P_\text{T}\) y\(P_0\) para cualquier longitud de onda. Para ello, comenzamos con la ley de Beer
\[A = - \log \frac{P_\text{T}}{P_0} = \epsilon b C \nonumber \]
y luego resolver para\(P_\text{T}\) en términos de\(\P_0\)
\[\log \frac{P_\text{T}}{P_0} = - \epsilon b C \nonumber \]
\[\frac{P_\text{T}}{P_0} = 10^{- \epsilon b C} \nonumber \]
\[P_\text{T} = P_0 \times 10^{- \epsilon b C} \nonumber \]
Sustituyendo esta relación general de nuevo en nuestra ecuación específica de longitud de onda para absorbancia,\ ref {IL1}, obtenemos
\[A = \log (P_0^{\prime} + P_0^{\prime \prime}) - \log (P_0^{\prime} \times 10^{- \epsilon b C} + P_0^{\prime \prime} \times 10^{- \epsilon b C}) \label{IL2} \]
Para radiación monocromática, tenemos\(\epsilon^{\prime} = \epsilon^{\prime \prime} = \epsilon\) y Ecuación\ ref {IL2} simplifica a la ley de Beer
\[A = -\log (10^{- \epsilon b C}) = \epsilon b C \nonumber \]
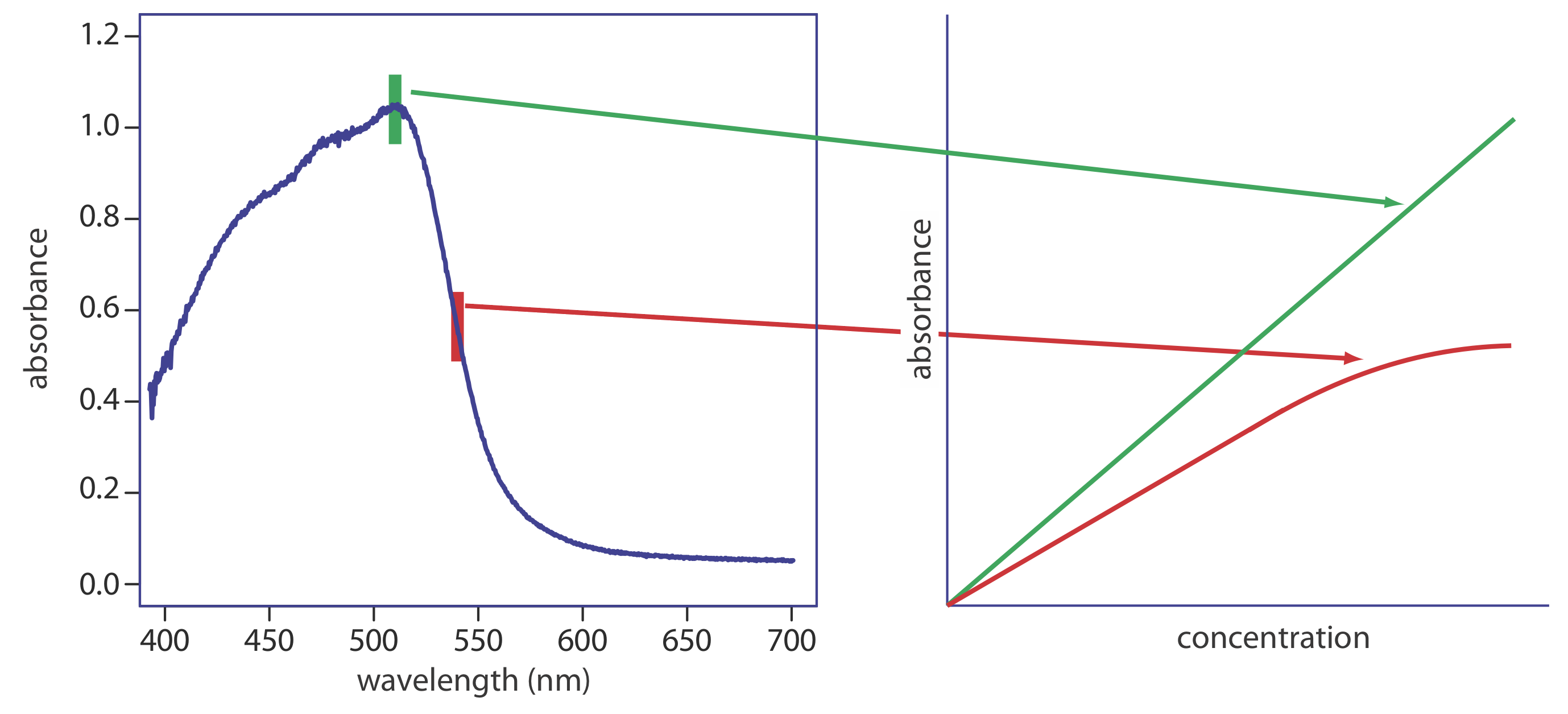
Para la radiación no monocromática, la Ecuación\ ref {IL2} predice que la absorbancia es menor de lo esperado si\(\epsilon^{\prime}\ > \epsilon^{\prime \prime}\). La radiación policromática siempre da una desviación de la ley de Beer, pero el efecto es menor si el valor de\(\varepsilon\) esencialmente es constante sobre el rango de longitud de onda pasado por el selector de longitud de onda. Por esta razón, como se muestra en la Figura\(\PageIndex{3}\), es mejor realizar mediciones de absorbancia en la parte superior de un amplio pico de absorción. Además, la desviación de la ley de Beer es menos grave si el ancho de banda efectivo de la fuente es inferior a una décima parte del ancho de banda natural de la especie absorbente [(a) Strong, F. C., III Anal. Chem. 1984, 56, 16A—34A; Gilbert, D. D. J. Chem. Educ. 1991, 68, A278—A281]. Cuando se deben realizar mediciones en una pendiente, se mejora la linealidad mediante el uso de un ancho de banda efectivo más estrecho.