17.1: Espectometría de Absorción del Infrarrojo Medio
- Page ID
- 78545
La espectrometría de infrarrojo medio se utiliza para el análisis cualitativo rutinario y, en menor medida, el análisis cuantitativo de moléculas orgánicas. En esta sección consideramos la espectrometría de absorción en la que medimos la absorbancia de la luz IR a medida que pasa a través de una muestra de gas, solución, líquido o sólido. En la Sección 17.2 consideramos la espectrometría de reflectancia en la que medimos la absorbancia de la luz IR al reflejarse en la superficie de una muestra sólida o una película delgada de una muestra líquida.
Manejo de Muestras
La espectroscopia infrarroja se utiliza rutinariamente para analizar muestras de gas, líquidos y sólidos. Sabemos por la ley de Beer,\(A = \epsilon b C\), que la absorbancia es una función lineal de la concentración del analito\(C\), y la distancia,\(b\), la luz viaja a través de la muestra. El desafío de obtener un espectro IR, rara vez es la concentración del analito o la longitud de la trayectoria; en cambio, es encontrar materiales y solventes que sean transparentes a la radiación IR. Las ventanas ópticas en las células IR están hechas de materiales, como NaCl y KBr, que son transparentes a la radiación infrarroja.
Muestras de fase gaseosa
La celda para analizar una muestra en fase gaseosa generalmente es un cilindro de vidrio de 5 a 10 cm provisto de ventanas ópticamente transparentes. Para un analito con una concentración particularmente pequeña, la celda de muestra está diseñada con superficies reflectantes que permiten que la radiación infrarroja realice varias pasadas a través de la celda antes de que salga de la celda de muestra, aumentando la longitud de la trayectoria y, por lo tanto, la absorbancia.
Soluciones de soluciones
El análisis de una muestra en solución está limitado por las propiedades de absorción de IR del solvente, siendo el tetracloruro de carbono, CCl 4, disulfuro de carbono, CS 2 y cloroformo, CHCl 3, siendo solventes comunes. Una celda de solución típica se muestra en la Figura\(\PageIndex{1}\). Está confeccionado con dos ventanas de NaCl separadas por un espaciador. Al cambiar el espaciador, se obtienen longitudes de trayectoria de 0.015—1.0 mm. La muestra se introduce en la celda usando una jeringa y el puerto de entrada de la muestra.

Muestras de fase líquida
Una muestra que es un líquido volátil puede analizarse usando la celda de solución en la Figura\(\PageIndex{1}\). Para una muestra líquida no volátil, sin embargo, se puede preparar una muestra adecuada para el trabajo cualitativo colocando una gota del líquido entre las dos placas de NaCl que se muestran en la Figura\(\PageIndex{2}a\), formando una película delgada que típicamente tiene menos de 0.01 mm de espesor. Un enfoque alternativo es colocar una gota de la muestra sobre una tarjeta desechable equipada con una “ventana” de polietileno que sea transparente al IR con la excepción de bandas de absorción fuertes a 2918 cm —1 y 2849 cm —1 (Figura\(\PageIndex{2}b\)).

Muestras en Fase Sólida
Las muestras sólidas transparentes se analizan colocándolas directamente en el haz IR. La mayoría de las muestras sólidas, sin embargo, son opacas y primero se dispersan en un medio más transparente antes de registrar el espectro IR. Si se dispone de un disolvente adecuado, entonces el sólido se analiza preparando una solución y analizando como se describió anteriormente. Cuando no se dispone de un disolvente adecuado, las muestras sólidas se analizan preparando una mezcla de la muestra finamente pulverizada con un aceite adecuado y luego untándola sobre una placa de sal de NaCl o una tarjeta IR desechable (Figura\(\PageIndex{2}\)). Alternativamente, la muestra en polvo se mezcla con KBr y se prensa, a alta presión, en un pelet delgado ópticamente transparente, como se muestra en la Figura\(\PageIndex{3}\).

Análisis Cualitativo
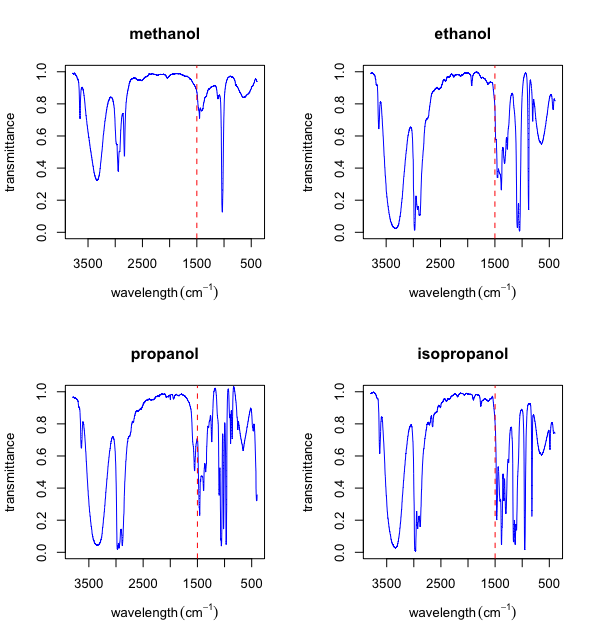
La aplicación más importante de la espectroscopia de infrarrojo medio está en la identificación cualitativa de moléculas orgánicas. La Figura\(\PageIndex{4}\) muestra los espectros de solución de IR medio para cuatro alcoholes simples: metanol, CH 3 OH, etanol, CH 3 CH 2 OH, propanol, CH 3 CH 2 CH 2 OH e isopropanol, (CH 3) 2 CHOH. Claramente hay similitudes y diferencias en estos cuatro espectros: similitudes que podrían llevarnos a esperar que cada molécula contenga los mismos grupos funcionales y diferencias que aparecen como características únicas de una molécula en particular. Las similitudes en estos cuatro espectros aparecen en el extremo del número de onda más alto de la escala del eje x; llamamos a los picos que encontramos allí frecuencias grupales. Las diferencias en estos cuatro espectros ocurren por debajo de aproximadamente 1500 cm —1 en lo que llamamos la región de huella dactilar.
La región de huella dactilar se define aquí como comenzando en 1500 cm —1, extendiéndose hasta el número de onda más bajo que se muestra en el eje x. Si haces alguna búsqueda en la región de huella dactilar verás que no hay un amplio acuerdo sobre dónde comienza. En mi búsqueda, encontré fuentes que sitúan el inicio de la región de la huella dactilar como 1500 cm —1, 1450 cm —1, 1300 cm —1, 1200 cm —1 y 1000 cm —1.
Frecuencias de grupo
Los cuatro espectros de la Figura\(\PageIndex{4}\) comparten una intensidad pequeña, pico agudo a aproximadamente 3650 cm —1, una intensidad fuerte, pico ancho a aproximadamente 3350 cm —1, y dos picos agudos de intensidad media a 2950 cm —1 y 3850 cm —1. Al comparar espectros para estos y otros compuestos, sabemos que la presencia de un pico amplio entre aproximadamente 3200 cm —1 y 3600 cm —1 es una buena evidencia de que el compuesto contiene un grupo funcional —OH unido a hidrógeno. El pico agudo a aproximadamente 3650 cm —1 también es evidencia de un grupo funcional —OH, pero uno que no está unido a hidrógeno. Los dos picos agudos a 2950 cm —1 y 3850 cm —1 son consistentes con los enlaces C—H. Los cuatro picos son para estirar vibraciones. Las tablas de frecuencias de grupo están disponibles de forma rutinaria.
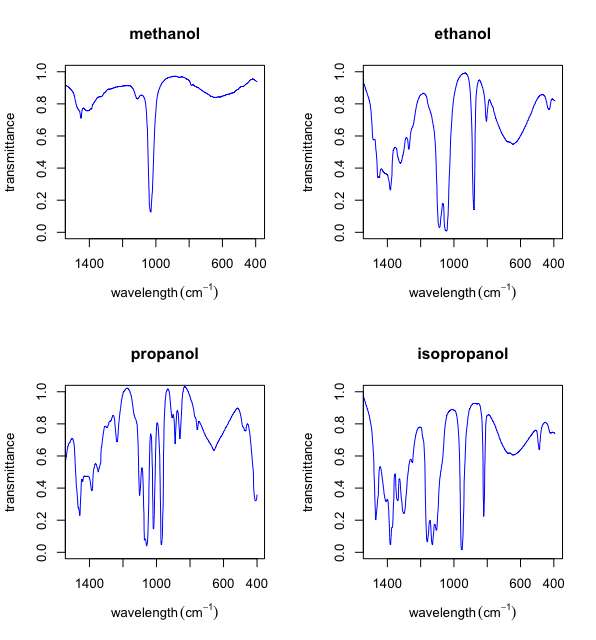
La región “huella digital”
La Figura\(\PageIndex{5}\) muestra un primer plano de la región de huella dactilar para las muestras de alcohol en la Figura\(\PageIndex{4}\). De particular interés con este conjunto de muestras es la creciente complejidad de los espectros a medida que pasamos del más simple de estos alcoholes (metanol), al más complejo de estos alcoholes (propanol e isopropanol). También es de interés que cada espectro sea único de una manera que nos permita confirmar una muestra comparándola con una biblioteca de espectros registrados. Hay una serie de colecciones accesibles de espectros que están disponibles para este propósito. Una de esas colecciones de espectros es el NIST Webbook —NIST es el Instituto Nacional de Estándares y Tecnología— que es la fuente de los datos utilizados para mostrar los espectros incluidos en las cifras de esta sección y que incluye espectros para más de 16,000 compuestos.
Sistemas de búsqueda por computadora
Con la disponibilidad de adquisición y almacenamiento de datos computarizados es posible construir bibliotecas digitales de espectros de referencia estándar. La identidad de un compuesto desconocido a menudo se puede determinar comparando su espectro con una biblioteca de espectros de referencia, un proceso conocido como búsqueda espectral. Las comparaciones se realizan utilizando un algoritmo que calcula la diferencia acumulativa entre el espectro de la muestra y un espectro de referencia. Por ejemplo, un algoritmo simple usa la siguiente ecuación
\[D = \sum_{i = 1}^n | (A_{sample})_i - (A_{reference})_i | \label{spec_sub} \]
donde D es la diferencia acumulativa, Una muestra es la absorbancia de la muestra a longitud de onda o número de onda i, Una referencia es la absorbancia del compuesto de referencia al mismo longitud de onda o número de onda, y n es el número de puntos digitalizados en los espectros. Obsérvese que los espectros se definen aquí por absobrancia en lugar de transmitancia ya que la absorbancia es directamente proporcional a la concentración. La diferencia absoluta acumulada se calcula para cada espectro de referencia. El compuesto de referencia con el valor más pequeño de D es la coincidencia más cercana al compuesto desconocido. La precisión de la búsqueda espectral está limitada por el número y tipo de compuestos incluidos en la biblioteca, y por el efecto de la matriz de la muestra en el espectro.
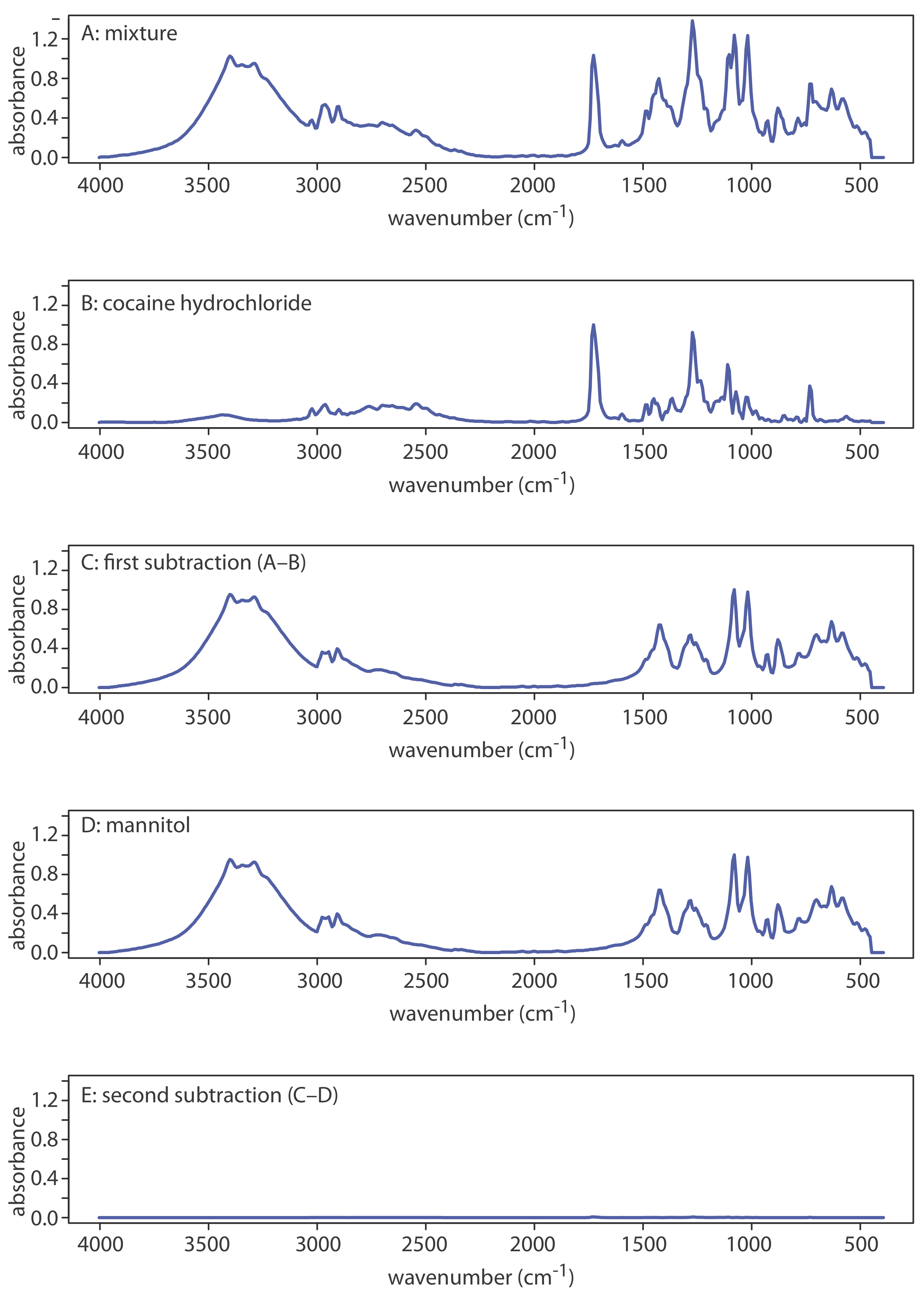
Otra ventaja de la adquisición computarizada de datos es la capacidad de restar un espectro de otro. Cuando se combina con la búsqueda espectral es posible determinar la identidad de varios componentes en una muestra sin la necesidad de una etapa de separación previa mediante la búsqueda y sustracción repetida de espectros de referencia. Un ejemplo se muestra en la Figura\(\PageIndex{6}\) en la que la composición de una mezcla de dos componentes se determina por búsqueda y resta sucesivas. La figura\(\PageIndex{6}a\) muestra el espectro de la mezcla. Una búsqueda de la biblioteca espectral selecciona la cocaina•HCl (Figura\(\PageIndex{6}b\)) como un componente probable de la mezcla. Restar el espectro de referencia para la cocaina•HCl del espectro de la mezcla deja un resultado (Figura\(\PageIndex{6}c\)) que coincide estrechamente con el espectro de referencia del manitol (Figura\(\PageIndex{6}d\)). Restar el espectro de referencia para manitol deja una pequeña señal residual (Figura\(\PageIndex{6}e\)).
Aplicaciones Cuantitativas
Un análisis cuantitativo basado en la absorción de radiación infrarroja, aunque importante, se encuentra con menor frecuencia que con la absorción UV/Vis, principalmente debido a los tres temas aquí planteados.
Desviaciones de la Ley de Cerveza
Un desafío para la IR cuantitativa es la mayor tendencia a las desviaciones instrumentales de la ley de Beer cuando se usa radiación infrarroja. Debido a que una banda de absorción infrarroja es relativamente estrecha, cualquier desviación debida a la falta de radiación monocromática es más pronunciada. Además, las fuentes infrarrojas son menos intensas que las fuentes UV/Vis, lo que hace que la radiación parásita sea un problema mayor. Las diferencias entre las longitudes de trayectoria para muestras y para estándares cuando se usan películas líquidas delgadas o pellets de KBr son un problema, aunque un estándar interno puede corregir cualquier diferencia en la longitud de trayectoria; alternativamente, podemos usar la celda que se muestra en la Figura\(\PageIndex{1}\) para mantener una longitud de trayectoria constante.
Corrección de fondo
El agua y el dióxido de carbono en el aire tienen fuertes absorbancias en el IR medio. Un instrumento dispersivo de doble haz corrige las contribuciones de vapor de CO 2 y H 2 O porque están presentes en ambas vías a través del instrumento. Un FT-IR, sin embargo, incluye solo una única trayectoria óptica, por lo que es necesario recolectar un espectro separado para compensar la absorbancia de CO 2 atmosférico y vapor H 2 O. Esto se hace recogiendo un espectro de fondo sin la muestra y almacenando el resultado en la memoria de la computadora del instrumento. El espectro de fondo se elimina del espectro de la muestra tomando la relación de las dos señales. Otro enfoque es limpiar el compartimento de la muestra con nitrogren.
Medición de absorbancia
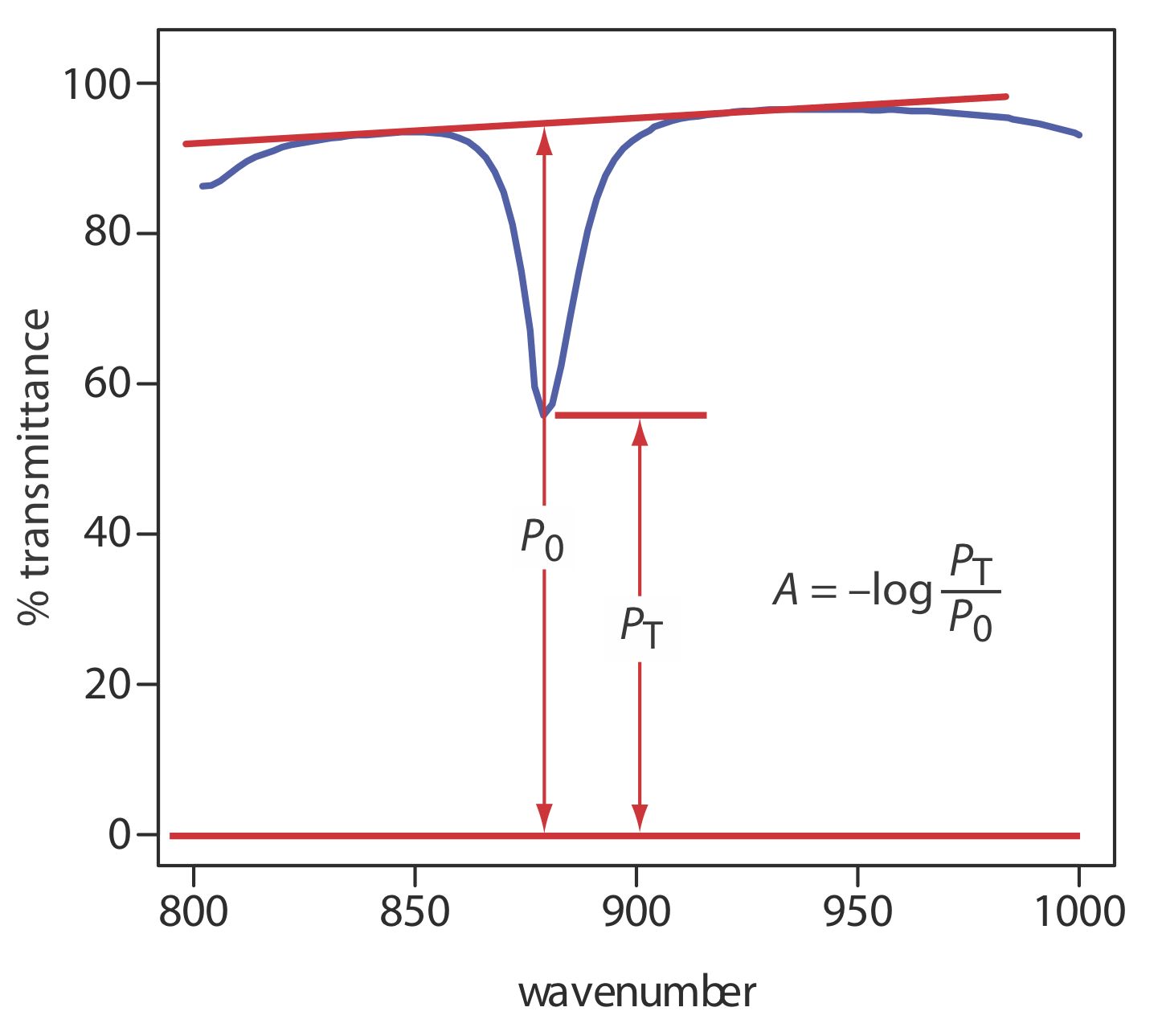
Otro reto para el IR cuantitativo es que establecer una línea base 100% T (A = 0) a menudo es difícil porque las propiedades ópticas de las células de muestra de NaCl pueden cambiar significativamente con la longitud de onda debido a la contaminación y degradación. Podemos minimizar este problema midiendo la absorbancia relativa a una línea base establecida para la banda de absorción. La figura\(\PageIndex{7}\) muestra cómo se logra esto.
Aplicaciones típicas
Un artículo de revisión reciente [Fahelelbom, K. M.; Saleh, A.; Al-Tabakha, M. A.; Ashames, A. A. Rev. Anal. Chem. 2022, 41, 21—33] resume la rica literatura en espectrometría cuantitativa de infrarrojo medio. Entre las áreas cubiertas se encuentran el análisis de productos farmacéuticos, incluyendo antibióticos, antihipertensivos, antivirales y medicamentos falsificados. La espectrometría de infrarrojo medio también encuentra uso para el análisis de gases ambientalmente significativos, como metano, CH 4, cloruro de hidrógeno, HCl, dióxido de azufre, SO 2 y óxido nítrico, NO.


