21.2: Métodos espectroscópicos de superficie
- Page ID
- 78814
En esta sección consideramos tres métodos analíticos de superficie representativos: la espectroscopia fotoelectrónica de rayos X, en la que la entrada es un haz de fotones de rayos X y la salida es electrones; la espectroscopia electrónica Auger, en la que la entrada es un haz de electrones o de fotones de rayos X y la salida es electrones; y espectrometría de masas de iones secundarios, en la que la entrada es un haz de iones y la salida es iones.
Espectroscopia fotoelectrónica de rayos X (XPS)
En la espectroscopia fotoelectrónica de rayos X, también conocida como espectroscopia electrónica para análisis químico (ESCA), se mide la energía cinética de los electrones expulsados de una muestra tras la absorción de fotones de rayos X. El espectro resultante es un recuento de estos electrones emitidos en función de su energía.
Principios de XPS
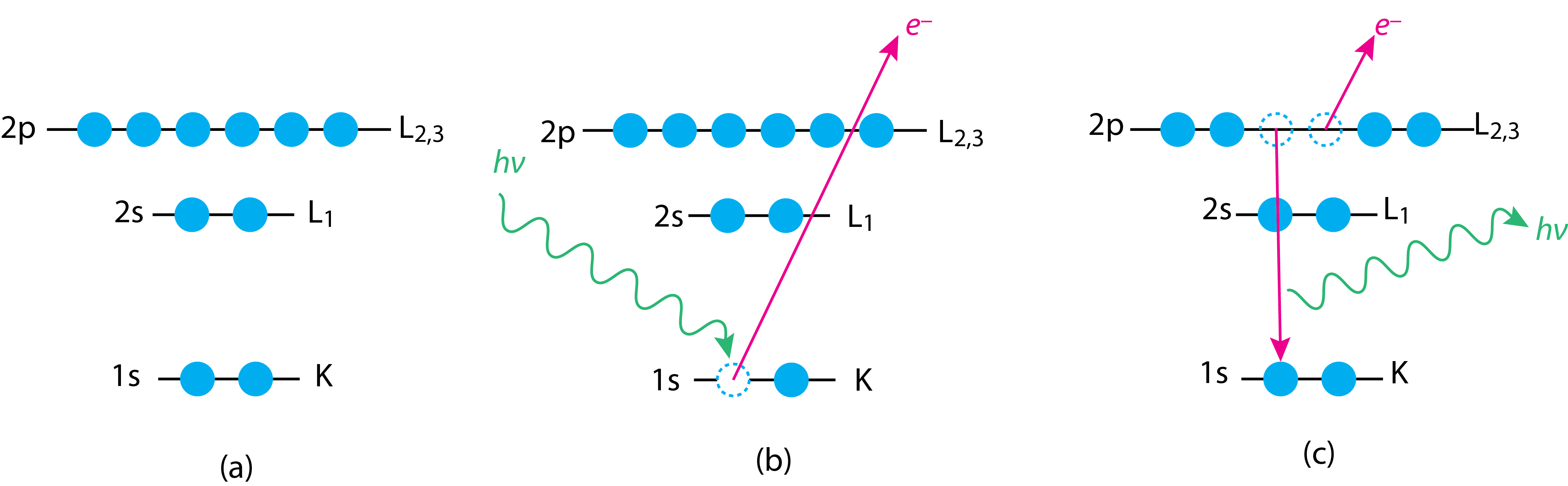
Podemos explicar el origen de la espectroscopia fotoelectrónica de rayos X utilizando el efecto fotoeléctrico. La figura\(\PageIndex{1}a\) muestra el diagrama de nivel de energía para los electrones a nivel de núcleo de 1 s, 2 s y 2 p de un elemento junto con sus designaciones KLM (ver Capítulo 12.1 para una discusión previa de esta manera de designar electrones). Un haz de rayos X casi monoenergético de energía conocida se enfoca en la muestra, lo que resulta en la expulsión de un fotoelectrón a nivel de núcleo, como se muestra en la Figura\(\PageIndex{1}b\). La energía cinética de este electrón emitido\(E_{KE}\),, está relacionada con su energía de unión al núcleo,\(E_{BE}\), por la ecuación
\[E_{KE} = h \nu - E_{EB} - \Phi_w \label{xps1} \]
donde\(h \nu\) está la energía del fotón de rayos X y\(\Phi_w\) es la función de trabajo del espectrómetro (la energía necesaria para eliminar el electrón de la superficie y al vacío). Las fuentes más comunes de rayos X son la\(K_{\alpha}\) línea Mg con una energía de 1253.6 eV o la\(K{\alpha}\) línea Al con una energía de 1486.6 eV.
La vacante a nivel de núcleo creada por el fotoelectrón deja al átomo con una configuración de electrones inestable. La relajación al estado fundamental se produce cuando esta vacante es llenada por un electrón de una capa de mayor energía, con el exceso de energía liberada ya sea como la emisión de un segundo electrón o la emisión fluorescente de una radiografía característica, como se ve en la Figura\(\PageIndex{1}c\). El electrón secundario en la Figura\(\PageIndex{1}c\) se llama un electrón Auger.
La figura\(\PageIndex{2}\) proporciona un ejemplo de un espectro de sondeo XPS para óxido de aluminio\(\ce{Al2O3}\), utilizando la\(K_{\alpha}\) línea para el aluminio como fuente de rayos X. La tabla de picos da las energías de unión de los picos para aluminio y para oxígeno usando el\(K_{\alpha}\) para Al y, para comparación, la\(K_{\alpha}\) línea para Mg. Observe la diferencia en cómo se etiquetan los picos principales. Los fotoelectrones expulsados en el proceso mostrado en la Figura\(\PageIndex{1}b\) son designados por el elemento y la notación ns que especifica el orbital de donde se expulsó el electrón. Los electrones de barrena se designan usando la notación KLM, especificando la vacante inicial creada por el fotón absorbido, la fuente del electrón que llena esa vacante y la fuente del electrón Auger expulsado. El pico O KLL en este espectro es consistente con el esquema mostrado en la Figura\(\PageIndex{1}c\). Cuando la fuente del segundo y tercer electrones es de la capa de cenefa, entonces la notación a veces se escribe como KVV; el pico O KLL aquí podría designarse como O KVV.
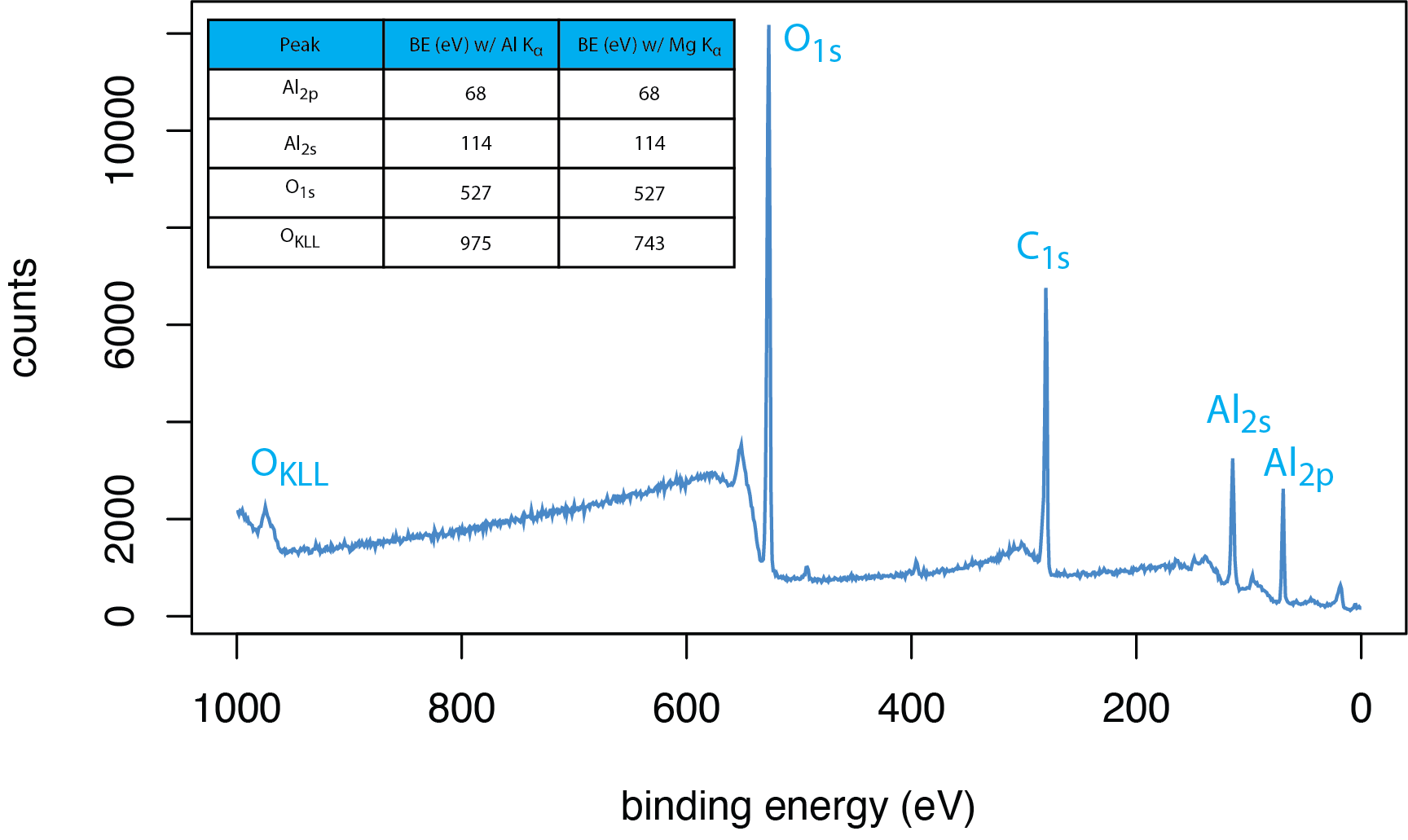
Hay algunas características interesantes adicionales a tener en cuenta en el espectro de la encuesta para Al 2 O 3. Una es la presencia de un pico para carbono aunque la muestra, Al 2 O 3, no contiene carbono. La prevalencia de carbono en la atmósfera significa que los niveles traza de carbono aparecen en casi todos los espectros XPS.
Una segunda característica es el aumento en la señal en el lado de alta energía de unión (baja energía cinética) de los picos, que es particularmente visible aquí para el pico O 1s, el pico C 1s y el pico de Al 2s. La fuente de este fondo son los electrones que no logran escapar de la muestra sin sufrir colisiones inelásticas que resultan en una pérdida de energía cinética y, dada la Ecuación\ ref {xps1}, se registran como si tuvieran una energía de unión mayor a la esperada. Debido a que los rayos X penetran más profundamente en la muestra que la profundidad desde la cual los electrones pueden viajar sin sufrir una colisión inelástica, este trasfondo es inevitable. Tenga en cuenta que el fondo es más significativo en energías de unión más altas (energías cinéticas más pequeñas).
Una tercera característica es que la energía de unión de un pico XPS es independiente de la fuente de rayos X, pero la energía de unión para un pico de Auger varía con la energía de la fuente de rayos X (ver tabla en la Figura\(\PageIndex{2}\)). La energía cinética de los fotoelectrones O 1s, Al 2s y Al 2p es la diferencia entre la energía del fotón de rayos X\(h \nu\), y la energía de unión de cada electrón, BE; si cambiamos la fuente de rayos X, entonces\(h \nu\) y KE aumentan de valor, pero el BE permanece fijo. Para el electrón O KLL Auger, la energía cinética depende de la diferencia en las energías de unión de los tres electrones involucrados
\[\text{KE} \approx \text{BE}_K - \text{BE}_L - \text{BE}_L \label{xps2} \]
y es, por tanto, independiente de la energía de la fuente de rayos X. Dada la Ecuación\ ref {xps1}, si el KE permanece constante, entonces un aumento en la energía del fotón de rayos X\(h \nu\),, significa que el BE aparente debe aumentar. Este cambio en la energía de unión cuando se usa una fuente diferente es una forma de identificar un pico como resultado de electrones Auger.
Instrumentación
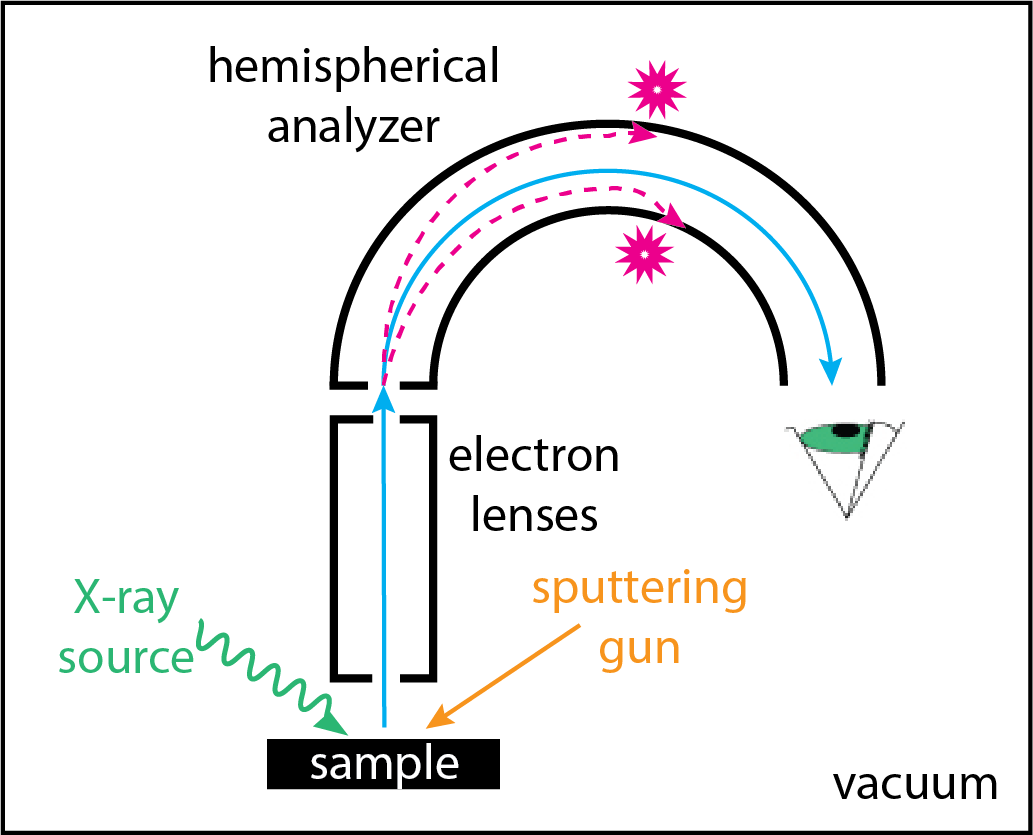
La instrumentación básica para XPS se muestra en la Figura\(\PageIndex{3}\). Las fuentes de rayos X más comunes, como se señaló anteriormente, son Mg (1253.6 eV) y Al (1486.6 ev), las cuales tienen la ventaja de anchos de línea relativamente estrechos (0.7 y 0.9 eV, respectivamente) y, por lo tanto, un rango de energías relativamente estrecho. Hay fuentes de energía más altas disponibles, como Ag (2984.4 ev), pero a costa de un ancho de línea más amplio (2.6 eV). Un sistema de lentes de electrones recoge y enfoca los electrones expulsados en la ranura de entrada de un analizador hemisférico. La trayectoria de un electrón a través del analizador depende de su energía cinética. Al variar los potenciales aplicados a las placas interna y externa del analizador hemisférico, los electrones de diferentes energías cinéticas llegan al detector. Una pistola de pulverización catódica es una característica opcional que se puede utilizar para limpiar la superficie de la muestra o para eliminar capas sucesivas de la muestra, permitiendo la recolección de espectros a diversas profundidades dentro de la muestra. La calibración de la escala de energía de unión del espectrómetro, que da cuenta de la función de trabajo del espectrómetro, se realiza utilizando líneas específicas para uno o más metales conductores; ejemplos incluyen Au 4f 7 /2 a 83.95 eV y Cu 2p 3 /2 a 932.63 ev. El pico de carbono que aparece en casi todos los espectros XPS proporciona una forma adicional de verificar la calibración de la escala de energía de unión.
Aplicaciones
La espectroscopia fotoelectrónica de rayos X es una herramienta particularmente útil para determinar la composición y estructura de una muestra. XPS también puede proporcionar información sobre cómo la composición de una muestra varía con la profundidad y la información cuantitativa sobre los componentes de una muestra.
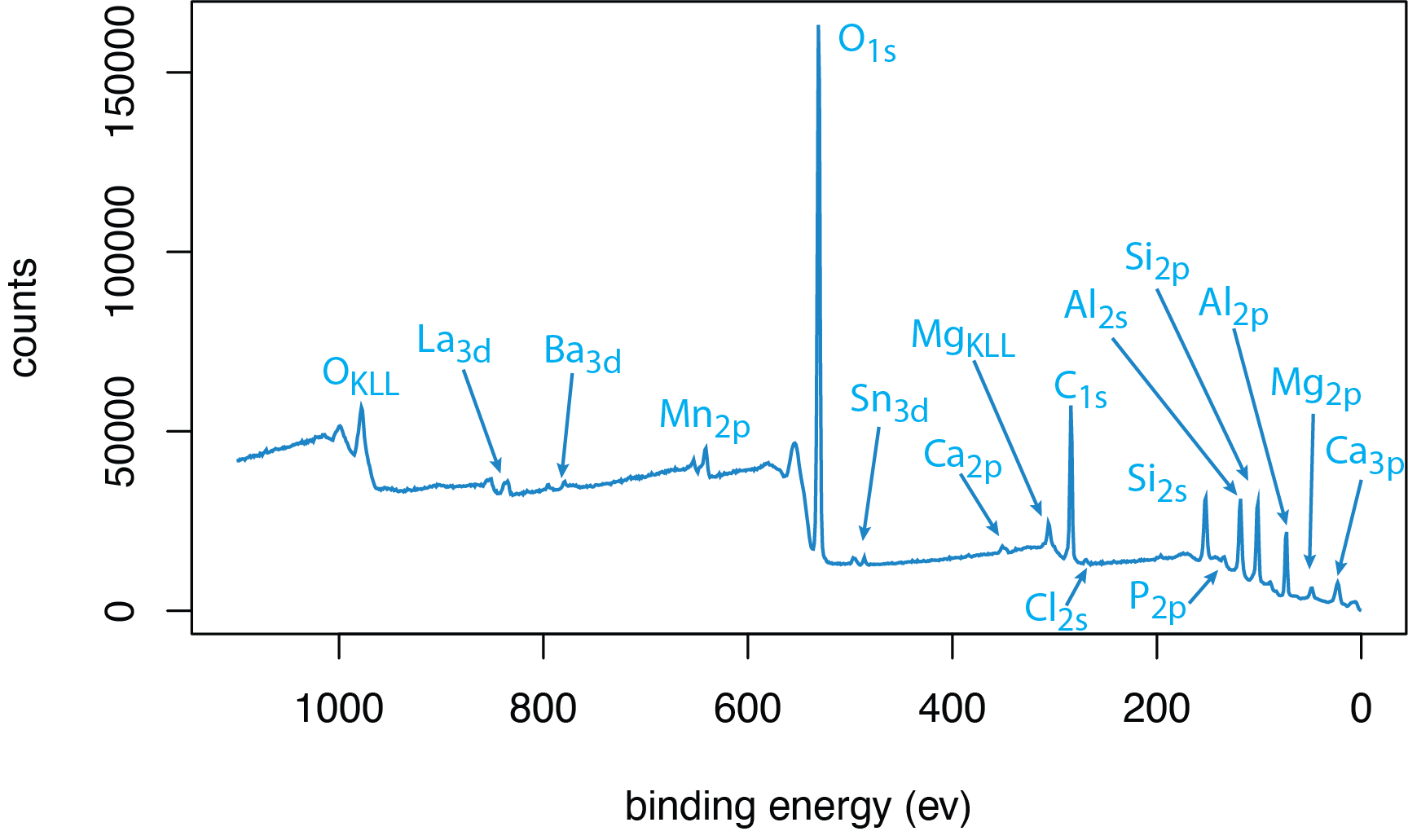
Análisis Cualitativo. Una de las fortalezas de la espectroscopia fotoelectrónica de rayos X es la capacidad de determinar los elementos que componen la superficie de una muestra. La figura\(\PageIndex{4}\) muestra un barrido de levantamiento de 0 eV a 1100 eV de un material cerámico. Además del pico de O1s, vemos picos fuertes para Si y Al, probablemente una cerámica de aluminosilicato, y pequeños picos para una variedad de elementos: La, Ba, Mn, Sn, Ca, Cl, P y Mg. El NIST mantiene una base de datos extensa y con capacidad de búsqueda de picos XPS que ayudan a identificar los elementos en una muestra.
Desplazamientos Químicos. La energía de unión de un elemento es sensible a su entorno químico, particularmente con respecto a los estados de oxidación y estructura. Por ejemplo, Table\(\PageIndex{1}\) proporciona la energía de unión para la línea 2p de cloro en tres sales de potasio extraídas de la base de datos NIST con todos los valores de la misma fuente bibliográfica. Usando KCl, en el que el cloro tiene un estado de oxidación de —1, como línea base, el pico de Cl 2p para KClO 3 se desplaza en +8.4 eV y el pico de Cl 2p para KClO 4 se desplaza en +10.3 eV. La dirección del cambio tiene sentido, ya que esperamos que requerirá más energía para eliminar un electrón de un elemento que tiene un estado de oxidación más positivo.
| compuesto | estado de oxidación para cloro | energía de unión (eV) para la línea Cl 2p | \(\Delta \text{BE}\)relativo a KCl |
|---|---|---|---|
| KCl | —1 | 198.1 | \ (\ Delta\ text {BE}\) relativo a KCL">— |
| KClO 3 | +5 | 206.5 | \ (\ Delta\ text {BE}\) relativo a KCL">+8.4 |
| KClO 4 | +7 | 208.4 | \ (\ Delta\ text {BE}\) relativo a KCL">+10.3 |
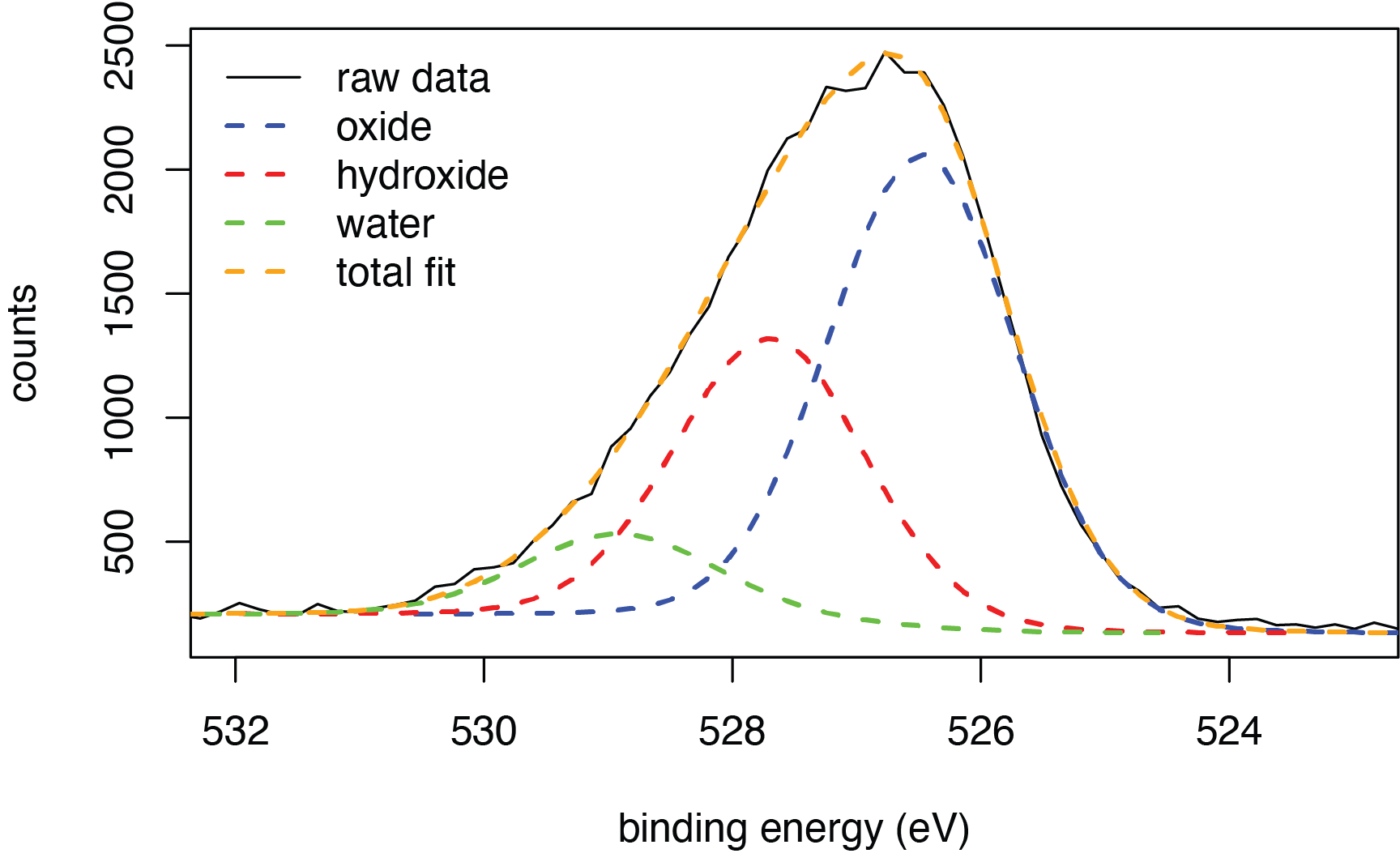
Los cambios químicos también reflejan cambios en la estructura química. La Figura\(\PageIndex{5}\), por ejemplo, muestra una exploración de alta resolución para el pico de oxígeno 2p para la misma muestra de óxido de aluminio, Al 2 O 3, en la Figura\(\PageIndex{1}\). La superficie de un óxido metálico a menudo tiene tres fuentes distintas de oxígeno: óxidos, que constituyen el grueso de la muestra, hidróxidos que se forman en la superficie después de la quimisorción del agua, y agua que se absorbe físicamente a la superficie. El ajuste de curvas de los datos brutos muestra la contribución de cada tipo de oxígeno a los datos brutos y, a través de las áreas pico, su abundancia relativa.
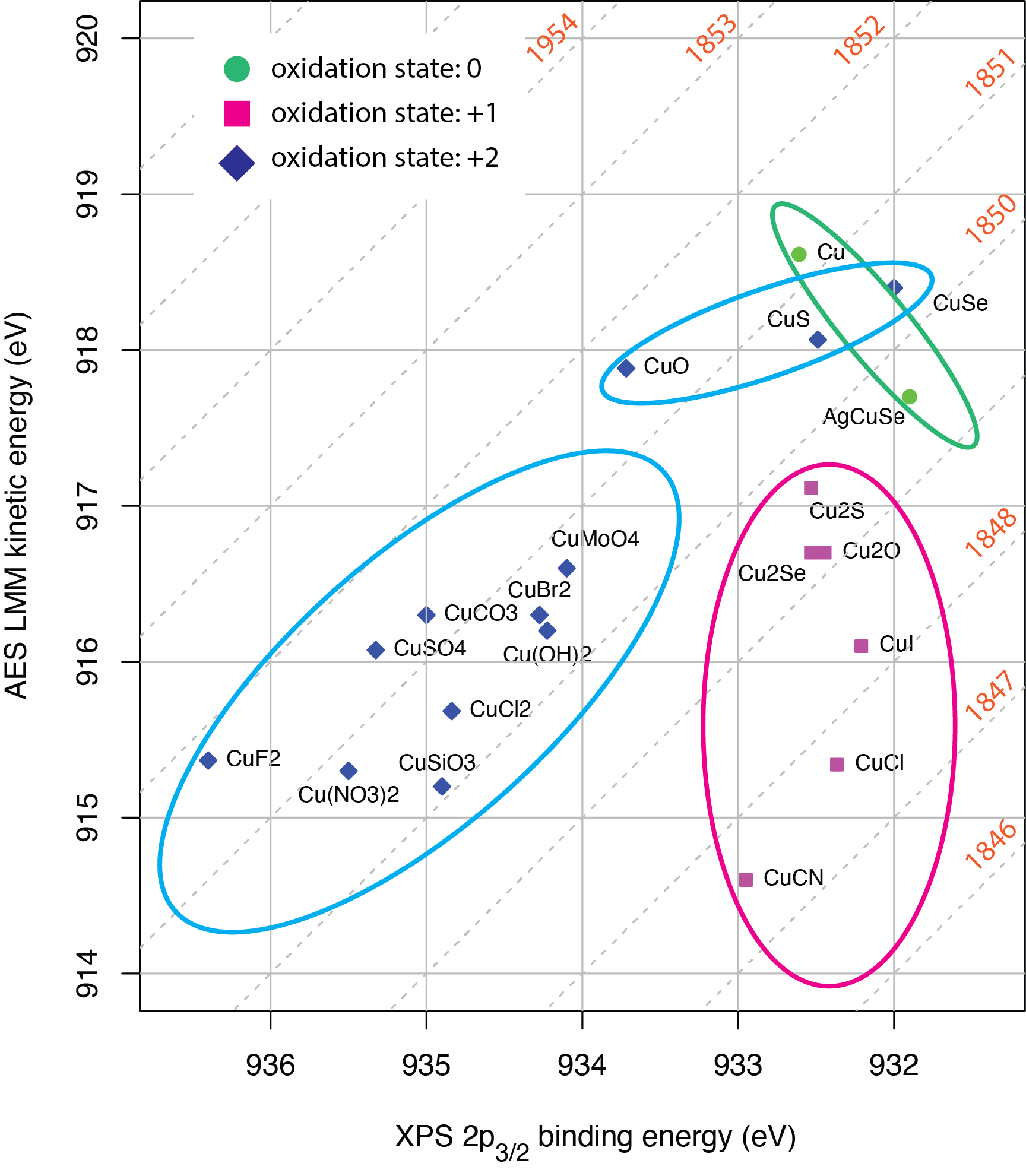
Parcelas Wagner. Tanto la energía de unión de un fotoelectrón de rayos X como la energía cinética de un electrón Auger transmiten información sobre el elemento a partir del cual se emitieron los electrones. Una gráfica de Wagner muestra tanto la energía de unión para un fotoelectrón que deja una vacante particular a nivel de núcleo como la energía cinética del electrón Auger cuyo origen surge del llenado de esta vacante a nivel de núcleo. La figura\(\PageIndex{6}\) muestra un ejemplo de una gráfica Wagner para cobre basada en su fotoelectrón de rayos X 2p 3 /2 y su electrón LMM Auger. Las líneas diagonales se denominan el parámetro Auger modificado, que se define como la suma de la energía de unión de XPS y la energía cinética de AES. Los valores para 20 compuestos se incluyen en esta parcela. De interés aquí es el agrupamiento de los compuestos individuales. Por ejemplo, todas las muestras para las que el cobre tiene un estado de oxidación de +1 (mostradas como cuadrados magenta) tienen energías de unión similares entre 932 eV y 933 eV, pero con energías cinéticas más variables, que van desde 914 eV hasta 917 eV. La mayoría de los compuestos en los que el cobre tiene un estado de oxidación de +2 (mostrados como diamantes azules) tienen parámetros de Auger modificados entre aproximadamente 1850 eV y 1851 eV, aunque existe una variación significativa en sus energías de unión individuales y energías cinéticas. Los dos metales (mostrados como círculos verdes) y los compuestos CU y CuSe ocupan un espacio similar dentro de la parcela de Wagner. Curiosamente, tanto CU como CuSe son calcogenuros de metales de transición y tienen propiedades semiconductoras.
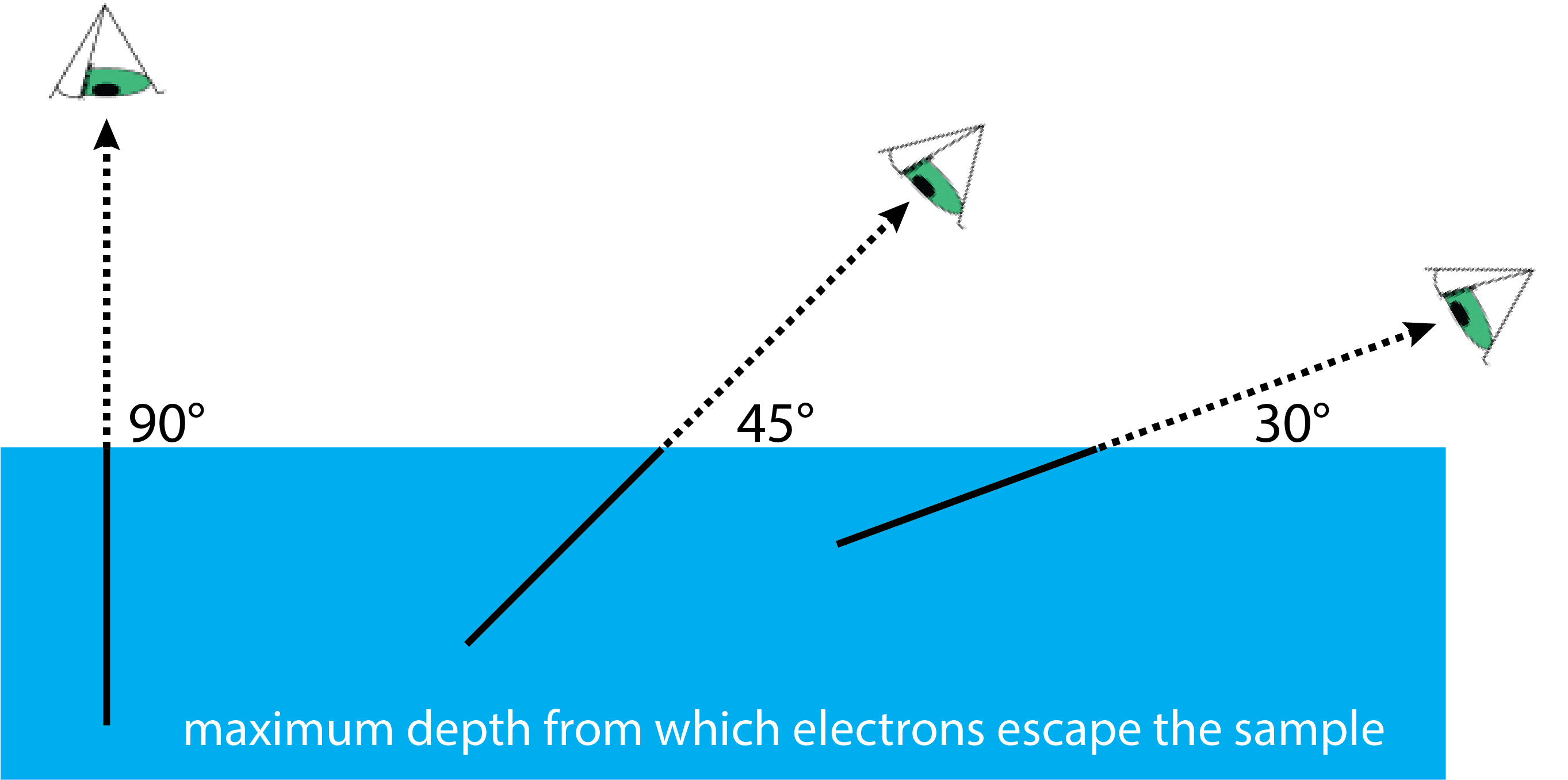
Información a Profundidad. Los rayos X penetran en una muestra a una profundidad que es mayor que la distancia que el fotoelectrón puede recorrer sin perder energía ante colisiones inelásticas. Podemos aprovechar esto para variar la profundidad a partir de la cual recopilamos información. La figura\(\PageIndex{7}\) muestra cómo esto se logra cambiando el ángulo desde el que recolectamos y analizamos los fotoelectrones. La longitud de la línea negra continua es la distancia que puede recorrer un electrón sin perder energía en una colisión inelástica. Cuando el detector se coloca a 90° con respecto a la superficie de la muestra, la profundidad de muestreo es máxima. Ajustar el detector para que esté a 30° con respecto a la superficie, resulta en su detección de electrones desde una profundidad que es apenas la mitad de esa cuando el detector está a 90°.
Análisis Cuantitativo. La intensidad de un pico XPS, ya sea la altura del pico o su área del pico, es proporcional al número de átomos del elemento responsable del pico. Esto permite determinar la concentración relativa,\(C_x\), de un elemento en una muestra; así
\[C_x = \frac {I_x / S_x} {\sum{(I_i / S_i)} } \label{xps3} \]
donde\(I_x\) es la intensidad pico para el elemento,\(S_x\) es el factor de sensibilidad para el elemento y\(I_i\) y\(S_i\) son las intensidades de pico y factores de sensibilidad para todos los demás elementos de la muestra. Los factores de sensibilidad explican las diferencias en la facilidad con la que se producen los fotoelectrones y escapan de la muestra. Se encuentran disponibles tablas publicadas de factores de sensibilidad, aunque pueden variar algunas de instrumento a instrumento. Los factores de sensibilidad se refieren a una línea estándar, típicamente C 1s, a la que se le asigna un factor de sensibilidad de 1.00.
En muchos casos nos interesa sólo la concentración relativa de sólo dos elementos. En este caso, escribimos la Ecuación\ ref {xps3} como
\[\frac{C_x}{C_y} = \frac{I_x / S_x}{I_y / S_y} \label{xps4} \]
donde\(x\) y\(y\) son los dos elementos. Por ejemplo, utilizando los datos de la Figura\(\PageIndex{4}\), el pico Si 2p tiene una altura de 30 mm y el pico Al 2p tiene una altura de pico de 20 mm. Sus factores de sensibilidad son, respectivamente 0.817 y 0.737. Usando estos valores, encontramos que
\[\frac{C_\text{Si}}{C_\text{Al}} = \frac{30/0.817}{20/0.737} = 1.4 \nonumber \]
hay aproximadamente\(1.4 \times\) tantos átomos de silicio como átomos de aluminio.
Espectroscopia electrónica de barrena (AES)
En la Figura\(\PageIndex{2}\) aprendimos que tras la expulsión de un fotoelectrón del núcleo de un átomo, el ahora inestable átomo libera energía ya sea emitiendo un electrón secundario desde un orbital de mayor energía o liberando un fotón. En XPS medimos la intensidad de los electrones fotoeyectados expulsados en función de su energía de unión; en la espectroscopia Auger medimos la intensidad de estos electrones secundarios en función de sus energías cinéticas.
La instrumentación para AES se puede acoplar con un espectrómetro XPS o ser un instrumento independiente. En cualquier caso, la instrumentación básica es similar a la mostrada en la Figura\(\PageIndex{3}\), aunque los espectros AES generalmente se inician usando un cañón de electrones como fuente en lugar de una fuente de rayos X. Una ventaja de usar un cañón de electrones es que puede enfocarse en un haz más pequeño y luego se puede trazar fácilmente a través de una superficie, lo que permite obtener imágenes de la superficie de la muestra. El perfilado de profundidad, utilizando un haz de iones para eliminar capas de la muestra, es otro uso común de AES.
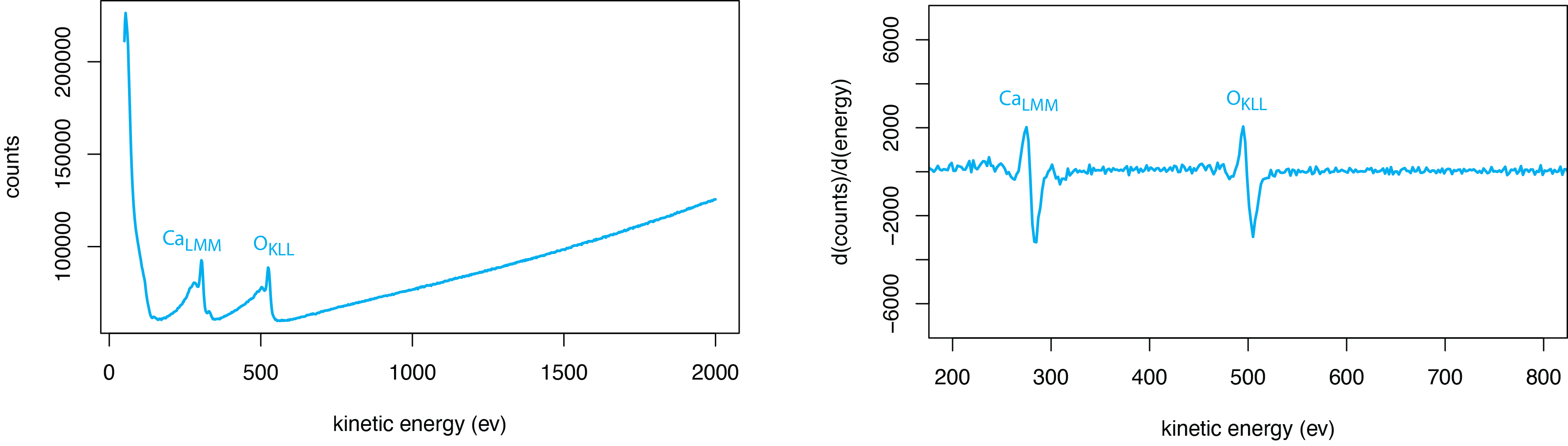
La figura\(\PageIndex{8}\) proporciona un ejemplo de un espectro AES típico, en este caso para la calcita mineral, CaCo 3. Los datos brutos, a la izquierda, muestran la intensidad de la señal como un recuento de electrones con una energía cinética particular. La gran señal de fondo proviene de electrones que pierden energía cinética como resultado de colisiones inelásticas. Las dos características amplias entre aproximadamente 100 eV y 600 eV son los picos Auger para calcio y para oxígeno. Los picos en este caso son fáciles de ver porque los dos analitos están presentes a granel. Para un analito a nivel de trazas, los picos de Auger en una parcela normal pueden ser difíciles de ver. Por esta razón, los espectros de Auger generalmente se presentan trazando la derivada de los datos brutos dando el espectro a la derecha.
La Figura\(\PageIndex{9}\) proporciona un ejemplo de cómo se usa AES para estudiar los cambios en la composición de un monocristal de CaCo 3 que se dejó equilibrar con una solución que contenía iones Mg 2 +. La muestra se montó en una sonda de muestra y se registró el espectro AES. Se utilizó un haz de iones Ar + para eliminar capas de la muestra mientras que el espectrómetro se utilizó para registrar espectros de la muestra. Como era de esperar, la superficie se enriquece en iones Mg 2 + que se difundieron en el cristal con la concentración relativa de Mg 2 + decreciente. La abundancia relativa de Ca 2 + aumenta con la profundidad; la concentración relativa de oxígeno permanece más o menos constante con la profundidad.
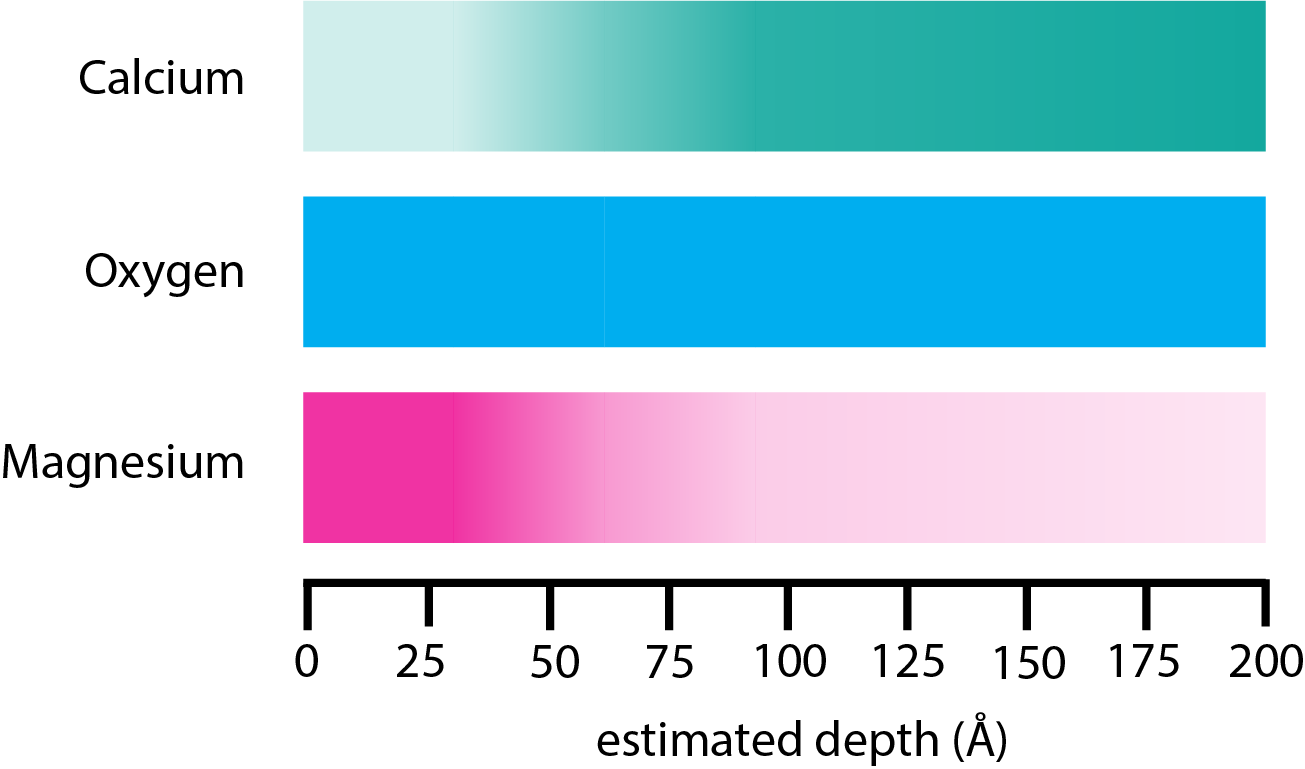
Espectrometría de masas de iones secundarios (SIMS)
En SIMS bombardeamos la superficie de una muestra con un haz primario energético, típicamente 5-20 Kev—de un ion, como Ar +, O 2 + o Cs +. El ion primario penetra en la superficie de la muestra, expulsando una variedad de partículas, incluyendo átomos neutros, electrones y, lo que es más importante, iones secundarios (cationes y aniones de carga simple o de carga multiplicada, y grupos de iones). Estos iones secundarios se caracterizan por sus relaciones masa-carga y por sus energías cinéticas. El uso de un haz de iones primario de Cs + favorece la formación de iones secundarios que son aniones, y un haz primario de O 2 + favorece la formación de iones secundarios que son cationes.
La instrumentación para SIMS incluye una pistola de iones para generar el haz primario y un espectrómetro de masas para analizar los iones secundarios. En modo estático, el haz de iones primario se ejecuta utilizando una baja densidad de corriente que minimiza el grado en que se eliminan las capas más externas de la muestra. En modo dinámico, el haz primario se ejecuta a una densidad de corriente más alta que elimina más de la superficie de la muestra. Los SIMS dinámicos son adecuados para el perfilado de profundidad. La alta resolución de masa se obtiene utilizando un analizador de masas de tiempo de vuelo o un analizador de masas de doble enfoque; consulte el Capítulo 20 para una discusión de diferentes tipos de analizadores de masas.
SIMS es muy adecuado para la obtención de imágenes, ya que el ion primario cargado positivamente se puede trazar a través de la superficie de la muestra. La Figura\(\PageIndex{10}\) proporciona un ejemplo de obtención de imágenes de una superficie usando SIMS midiendo el rendimiento de 14 iones N 12 C mientras rastrea el haz de iones primario a través de una sección de\(\times \) 10 µm de 10 µm de la muestra.



