22.3: Potenciales de electrodo
- Page ID
- 78709
Comenzamos este capítulo examinando la celda electroquímica en la Figura 22.1.1 donde\(\ce{Zn(s)}\) se oxida\(\ce{Zn^{2+}(aq)}\) y\(\ce{Ag^{+}(aq)}\) se reduce a\(\ce{Ag(s)}\), como se muestra por la siguiente reacción.
\[2 \mathrm{Ag}(s)+\mathrm{Zn}^{2+}(\mathrm{aq}) \rightleftharpoons \mathrm{Zn}(s)+2 \mathrm{Ag}^{+}(a q) \nonumber \]
La reacción procede según lo escrito porque la reducción de Ag + (aq) a Ag (s)
\[\mathrm{Ag}^{+}(a q)+e^{-} \rightleftharpoons \mathrm{Ag}(s) \label{red_ag} \]
es más favorable termodinámicamente que la reducción de\(\ce{Zn^{2+}(aq)}\) a\(\ce{Zn(s)}\)
\[\text{ Zn}^{2+}(aq)+2 e^{-} \rightleftharpoons \mathrm{Zn}(s) \label{red_zn} \]
Pero, ¿cómo sabemos que esto es cierto? En esta sección respondemos a esta pregunta analizando de cerca los potenciales de los electrodos.
Naturaleza de los potenciales de electrodo
El potencial de una celda electroquímica es la diferencia entre el potencial en el cátodo\(E_\text{cathode}\), y el potencial en el ánodo\(E_\text{anode}\), donde ambos potenciales se definen en términos de una reacción de reducción (y se denominan potenciales de reducción); así
\[E_\text{cell} = E_\text{cathode} - E_\text{anode} \label{cell_pot} \]
\[\mathrm{H}^{+}(a q)+e^{-}=\frac{1}{2} \mathrm{H}_{2}(g) \label{she} \]
que es la reacción que define el electrodo estándar de hidrógeno, o SHE.
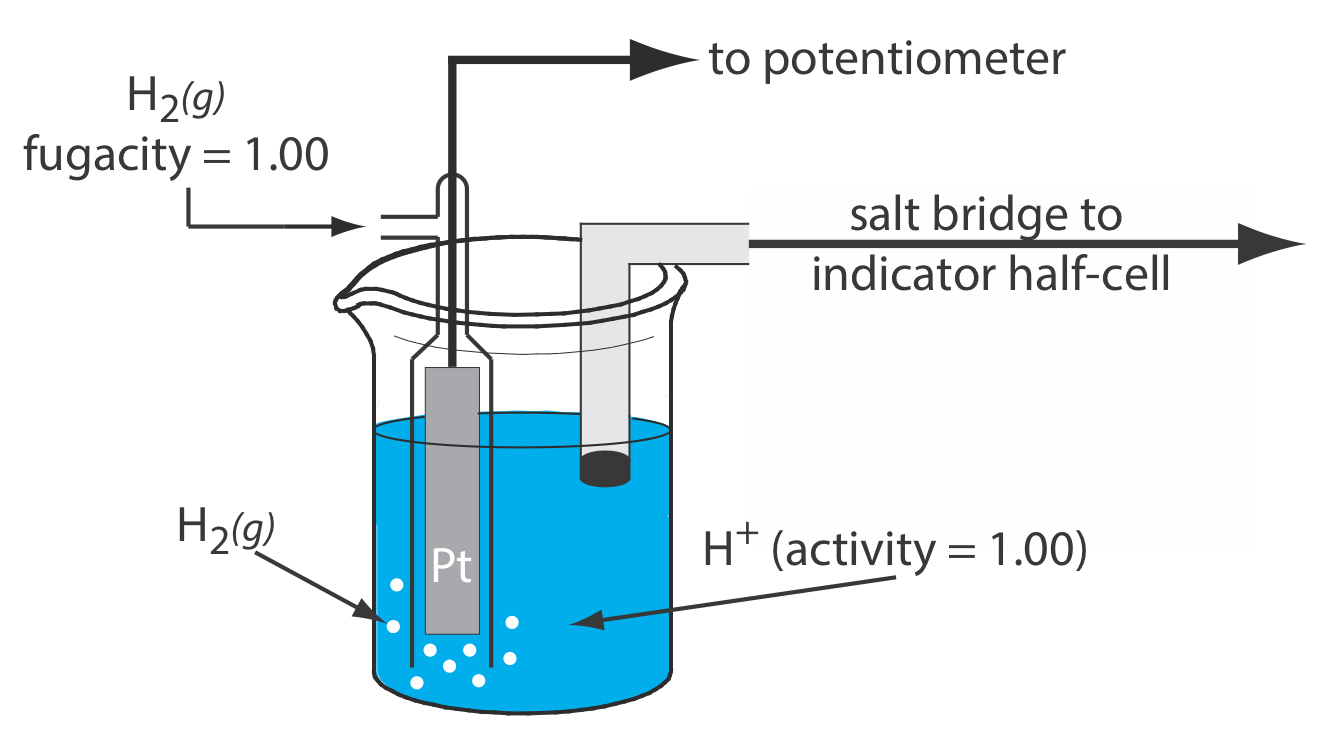
El electrodo de hidrógeno estándar (SHE)
El SHE consiste en un electrodo de Pt sumergido en una solución en la que la actividad del ion hidrógeno es de 1.00 y en la que la presión parcial de H2 (g) es de 1.00 atm (Figura\(\PageIndex{1}\)). Un puente salino convencional conecta la SHE a la semicelda indicadora. La notación de mano corta para el electrodo de hidrógeno estándar es
\[\text{Pt}(s), \text{ H}_{2}\left(g, f_{\mathrm{H}_{2}}=1.00\right) | \text{ H}^{+}\left(a q, a_{\mathrm{H}^{+}}=1.00\right) \| \label{she_cell} \]
y el potencial de estado estándar para la reacción\ ref {ella} es, por definición, 0.000 V a todas las temperaturas.
Electrodos Prácticos de Referencia
Aunque el electrodo de hidrógeno estándar es el estándar contra el cual se hace referencia a todos los demás potenciales, no es práctico para el uso rutinario ya que es difícil de preparar y mantener. En su lugar, usamos uno de varios otros electrodos de referencia. Los dos electrodos de referencia alternativos más comunes son el calomel, o electrodo Hg/Hg 2 Cl 2, el cual se basa en el siguiente par redox entre Hg 2 Cl 2 y Hg (calomel es el nombre común para Hg 2 Cl 2)
\[\mathrm{Hg}_{2} \mathrm{Cl}_{2}(s)+2 e^{-}\rightleftharpoons2 \mathrm{Hg}(l)+2 \mathrm{Cl}^{-}(a q) \nonumber \]
y el electrodo de referencia Ag/AgCl, que se basa en la reducción de AgCl a Ag
\[\operatorname{AgCl}(s)+e^{-} \rightleftharpoons \mathrm{Ag}(s)+\mathrm{Cl}^{-}(a q) \nonumber \]
Un examen más detallado de estos dos electrodos de referencia se encuentra en el Capítulo 23.1.
Definición de potencial de electrodo
Para determinar el potencial de reducción de Zn 2 + (aq) a Zn (s) lo hacemos el cátodo en la siguiente celda electroquímica
\[\text{Pt}(s), \text{ H}_{2}\left(g, P_{\mathrm{H}_{2}}=1.00\right) | \text{ H}^{+}\left(a q, a_{\mathrm{H}^{+}}=1.00\right) \| \ce{Zn^{2+}}\left(a q, a_{\mathrm{Zn}^{2+}}=x\right) | \ce{Zn}(s) \label{she_zn} \]
donde x es la actividad de Zn 2 + en su media celda. Por ejemplo, cuando\(a_{\mathrm{Zn}^{2+}} = 1.00\), el potencial de la celda electroquímica es\(-0.763 \text{V}\). Si encontramos que el potencial para la celda electroquímica
\[\ce{Zn}(s) | \ce{Zn^{2+}} (aq, a_{\mathrm{Zn}^{2+}} = 1.00) \| \ce{Ag+} (aq, a_{\mathrm{Ag}^{+}} = 1.00) | \ce{Ag}(s) \nonumber \]
es +1.562 V, luego sabiendo que
\[E_{cell} = E_{\ce{Ag+} / \ce{Ag}} - E_{\ce{Zn^{2+}} / \ce{Zn}} = E_{\ce{Ag+} / \ce{Ag}} - (-0.763 \text{V}) \nonumber \]
da\(E_{\ce{Ag+} / \ce{Ag}} = +0.799\). De esta manera, podemos construir tablas de potenciales para medias reacciones individuales.
Convención de Signos para Potenciales de Electrodo
En la Sección 22.2 observamos la siguiente relación entre un potencial electroquímico,\(E\), y la energía libre de Gibbs,\(\Delta G\)
\[\Delta G = - n F E \label{dg} \]
lo que nos dice que un potencial positivo corresponde a una reacción termodinámicamente favorable. Saber que el potencial para la celda electroquímica en la Ecuación\ ref {she_zn} es nos\(-0.763 \text{V}\) dice que la reducción de Zn 2 + (aq) a Zn (s) no es termodinámicamente favorable respecto a la reducción de H + (aq) a H 2 (g); es decir, no esperamos la reacción
\[\ce{Zn^{2+}}(aq) + \ce{H2}(g) \rightleftharpoons 2 \ce{H+}(aq) + \ce{Zn}(s) \label{zn_h} \]
que ocurra; sin embargo, con un potencial de +0.799 V, sí esperamos que la reacción
\[2 \ce{Ag+}(aq) + \ce{H2}(g) \rightleftharpoons 2 \ce{H+}(aq) + 2 \ce{Ag}(s) \label{ag_h} \]
que se produzca. O, viendo esto de otra manera, esperamos que los Zn (s), pero no Ag (s), se disuelvan en ácido.
Efecto de la Actividad sobre los Potenciales de Electrodo
En el capítulo 22.2 escribimos la ecuación de Nernst para la reacción
\[\mathrm{Zn}(s)+2 \mathrm{Ag}^{+}(a q) \rightleftharpoons 2 \mathrm{Ag}(s)+\mathrm{Zn}^{2+}(\mathrm{aq}) \label{net_rxn} \]
en términos de las concentraciones de Zn 2 + (aq) y Ag + (aq)
\[E = E^{\circ} - \frac{0.05916}{2} \log \frac {\left[ \ce{Zn^{2+}} \right]} {\left[ \ce{Ag+} \right]^2} \label{zn_ag_conc} \]
Si bien hay momentos en los que vamos a escribir la ecuación de Nernst en términos de concentraciones, las funciones termodinámicas se escriben más correctamente en términos de las actividades de los iones. En condiciones ideales, los iones individuales y las moléculas de gases se comportan como partículas independientes. Cuando esto es cierto, entonces la actividad y concentración de un ion son iguales y podemos escribir la ecuación de Nernst usando concentraciones; bajo otras condiciones, entonces la ecuación de Nernst se escribe más correctamente en términos de actividades
\[E = E^{\circ} - \frac{0.05916}{2} \log \frac {a_{\ce{Zn^{2+}}}} {\left( a_{\ce{Ag+}} \right)^2} \label{zn_ag_activity} \]
donde\(a_{\ce{Zn^{2+}}}\) y\(a_{\ce{Ag+}}\) son las actividades de Zn 2 + y Ag +. La ecuación\ ref {zn_ag_activity} nos muestra cómo cambia el potencial a medida que cambian las actividades de Zn 2 + y Ag +.
Si no está familiarizado con la actividad, o necesita un recordatorio sobre la relación entre actividad y concentración, entonces vea el apéndice en el Capítulo 35.7, que explica qué es la actividad, por qué es importante hacer una distinción entre actividad y concentración, y cuándo es razonable usar concentraciones en lugar de actividades.
El potencial estándar del electrodo\(E^{\circ}\)
El potencial estándar del electrodo,\(E^{\circ}\), para una media reacción es el potencial cuando todas las especies están presentes en la actividad unitaria o, para los gases, la fugacidad de la unidad. Su valor es independiente de cómo elegimos escribir la media reacción; es decir, el potencial de estado estándar para la reducción de Ag + (aq) a Ag (s), que es el cátodo en la celda electroquímica en la Figura 22.1.1, es +0.799 V ya sea que escribamos la media reacción como
\[\ce{Ag+}(aq) + e^{-} \rightleftharpoons \ce{Ag}(s) \label{ag1} \]
o como
\[2 \ce{Ag+}(aq) + e^{-} \rightleftharpoons 2 \ce{Ag}(s) \label{ag2} \]
A primera vista, esto parece contradictorio; sin embargo, si calculamos el potencial cuando la actividad de Ag+ es 0.50 obtenemos
\[E = E^{\circ} - \frac{0.05916}{1} \log \frac{1}{a_{\ce{Ag+}}} = 0.799 - \frac{0.05916}{1} \log \frac{1}{0.50} = 0.781 \text{V} \nonumber \]
cuando se utiliza la reacción\ ref {ag1}, y
\[E = E^{\circ} - \frac{0.05916}{2} \log \frac{1}{(a_{\ce{Ag+}})^2} = 0.799 - \frac{0.05916}{2} \log \frac{1}{0.50^2} = 0.781 \text{V} \nonumber \]
El apéndice del Capítulo 35.8 proporciona una tabla de potenciales de reducción de estado estándar para una amplia variedad de medias reacciones a 298 K.
Algunas limitaciones al uso de potenciales de electrodos estándar
Aunque los potenciales de electrodo estándar son valiosos, son varias limitaciones importantes para su uso, que describimos aquí.
Sustitución de Concentración por Actividades
Una limitación importante es que la ecuación de Nernst se define en términos de la actividad de los iones en lugar de sus concentraciones. Si bien es fácil preparar una solución para la cual la concentración de Na + es 0.100 M usando NaCl—solo pesar 5.844 g de NaCl y disolverla en 1.00 L de agua— es mucho más desafiante preparar una solución para la cual la actividad de Na + sea 0.100. Por esta razón, en los cálculos solemos sustituir las concentraciones por actividades cuando se utiliza la ecuación de Nernst. Esta simplificación generalmente está bien para soluciones diluidas donde la diferencia entre actividades y concentraciones es pequeña.
Efecto de otras reacciones de equilibrio
Un potencial de estado estándar nos habla de la posición de equilibrio de una reacción de media reacción redox en condiciones de estado estándar. Si una o más de las especies en la media reacción están involucradas en otras reacciones de equilibrio, entonces estas reacciones afectarán el valor del potencial estándar. Por ejemplo, Fe 2 + y Fe 3 + forman una variedad de complejos metal-ligando con Cl —lo que explica por qué\(E_{\ce{Fe^{3+}}/\ce{Fe^{2+}}}^{\circ}\) es 0.771 en ausencia de ión cloruro, pero es 0.70 en HCl 1 M.
Potenciales formales
Una forma de compensar el uso de concentraciones y presiones parciales en lugar de actividades y fugacidades, y compensar otras reacciones de equilibrio, es reemplazar los potenciales de estado estándar,\(E^{\circ}\) por un potencial formal\(E^{\circ \prime}\), que se mide usando concentraciones de 1.00 para iones, presiones parciales de 1.00 para gases, y para una concentración específica de otros reactivos. La siguiente tabla, que se adapta del apéndice del Capítulo 35.8, proporciona potenciales formales para la media reacción de Fe 3 + /Fe 2 + en cinco disolventes diferentes.
| hierro | \(E^{\circ}\)(V) | \(E^{\circ \prime}\)(V) |
|---|---|---|
| \(\ce{Fe^{3+}} + e^{-} \rightleftharpoons \ce{Fe^{2+}}\) | \ (E^ {\ circ}\) (V) ">0.771 | \ (E^ {\ circ\ prime}\) (V) ">
0.70 en 1 M\(\ce{HCl}\) 0,767 en 1 M\(\ce{HClO4}\) 0,746 en 1 M\(\ce{HNO3}\) 0.68 en 1 M\(\ce{H2SO4}\) 0.44 in 0.3 M\(\ce{H3PO4}\) |
Tasas de Reacción
La reducción de Fe 3 + a Fe 2 + consume un electrón, el cual se extrae del electrodo. La oxidación de otra especie, tal vez el disolvente, en un segundo electrodo es la fuente de este electrón. Debido a que la reducción de Fe 3 + a Fe 2 + consume un electrón, el flujo de electrones entre los electrodos, es decir, la corriente, es una medida de la velocidad a la que se reduce Fe 3 +. Una consecuencia importante de esta observación es que la corriente es cero cuando la reacción\(\text{Fe}^{3+}(aq) \rightleftharpoons \text{ Fe}^{2+}(aq) + e^-\) está en equilibrio. Si la media reacción redox no puede mantener un equilibrio porque la reacción en una dirección es demasiado lenta, entonces no podemos medir un potencial de estado estándar significativo.


