24.3: Coulometría de Corriente Controlada
- Page ID
- 79084
Una segunda aproximación a la coulometría consiste en utilizar una corriente constante en lugar de un potencial constante, lo que da como resultado el perfil de corriente frente a tiempo que se muestra en la Figura\(\PageIndex{1}\). La culometría de corriente controlada tiene dos ventajas sobre la coulometría de potencial controlado. Primero, el tiempo de análisis es más corto porque la corriente no disminuye con el tiempo. Un tiempo de análisis típico para la coulometría de corriente controlada es inferior a 10 min, en comparación con aproximadamente 30—60 min para la culometría de potencial controlado. En segundo lugar, debido a que la carga total es simplemente producto de la corriente y el tiempo, no hay necesidad de integrar la curva de corriente-tiempo en la Figura\(\PageIndex{1}\).
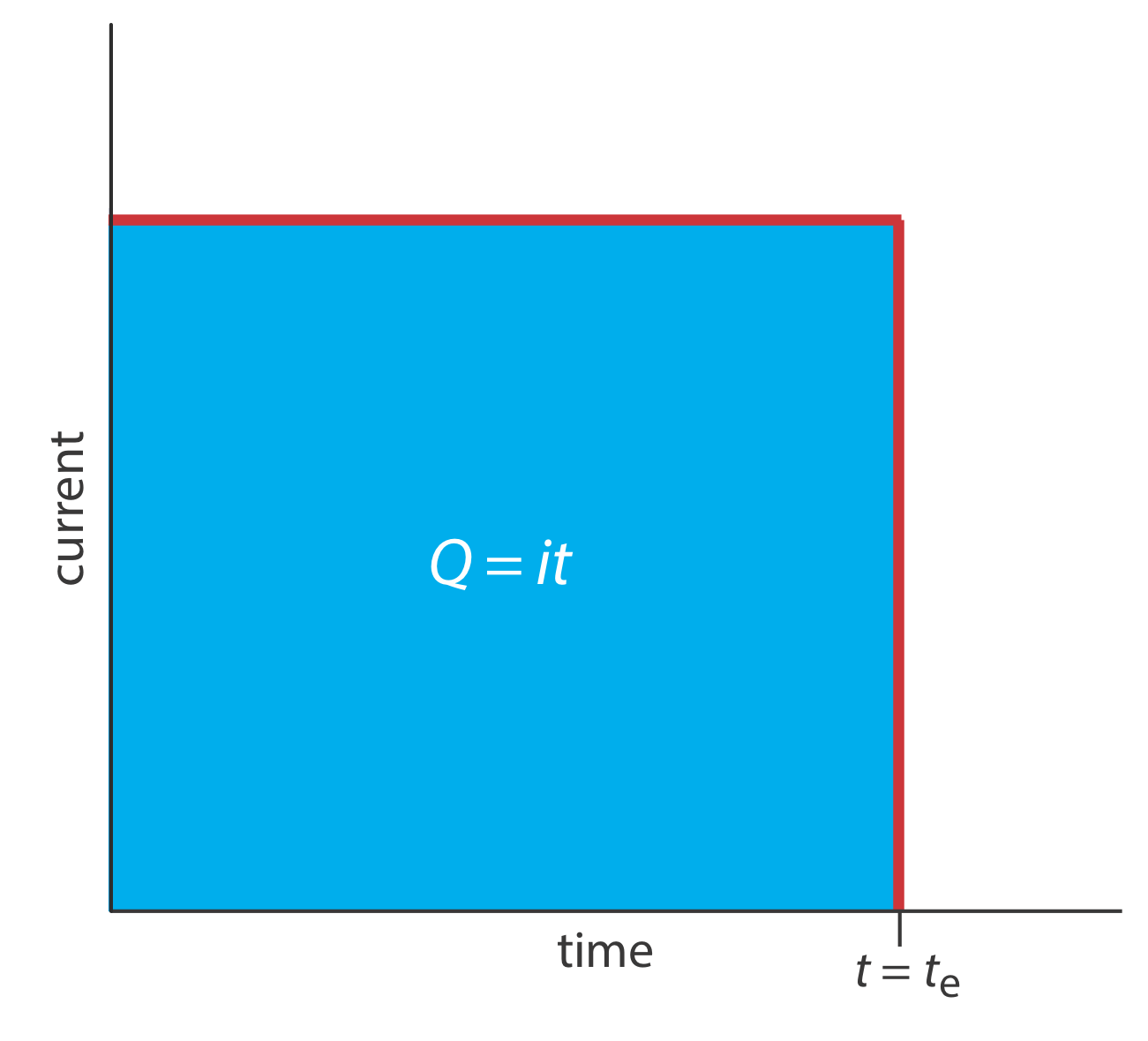
El uso de una corriente constante nos presenta dos problemas experimentales importantes. Primero, durante la electrólisis la concentración del analito y, por lo tanto, la corriente que resulta de su oxidación o reducción, disminuye continuamente. Para mantener una corriente constante debemos permitir que el potencial cambie hasta que ocurra otra reacción de oxidación o reacción de reducción en el electrodo de trabajo. A menos que diseñemos el sistema cuidadosamente, esta reacción secundaria da como resultado una eficiencia de corriente inferior al 100%. El segundo problema es que necesitamos un método para determinar cuándo se completa la electrólisis del analito. En un análisis coulométrico de potencial controlado sabemos que la electrólisis se completa cuando la corriente alcanza cero, o cuando alcanza un fondo constante o corriente residual. En un análisis coulométrico de corriente controlada, sin embargo, la corriente continúa fluyendo incluso cuando la electrólisis del analito está completa. Se necesita un método adecuado para determinar el punto final de la reacción, t e.
Mantenimiento de la eficiencia actual
Para ilustrar por qué un cambio en el potencial del electrodo de trabajo puede resultar en una eficiencia de corriente inferior al 100%, consideremos el análisis coulométrico para Fe 2 + basado en su oxidación a Fe 3 + en un electrodo de trabajo de Pt en 1 M H 2 SO 4.
\[\mathrm{Fe}^{2+}(a q) \rightleftharpoons \text{ Fe}^{3+}(a q)+e^{-} \label{ci1} \]
La figura\(\PageIndex{2}\) muestra los potenciales relevantes para este sistema. Al inicio del análisis, el potencial del electrodo de trabajo permanece casi constante a un nivel cercano a su valor inicial.
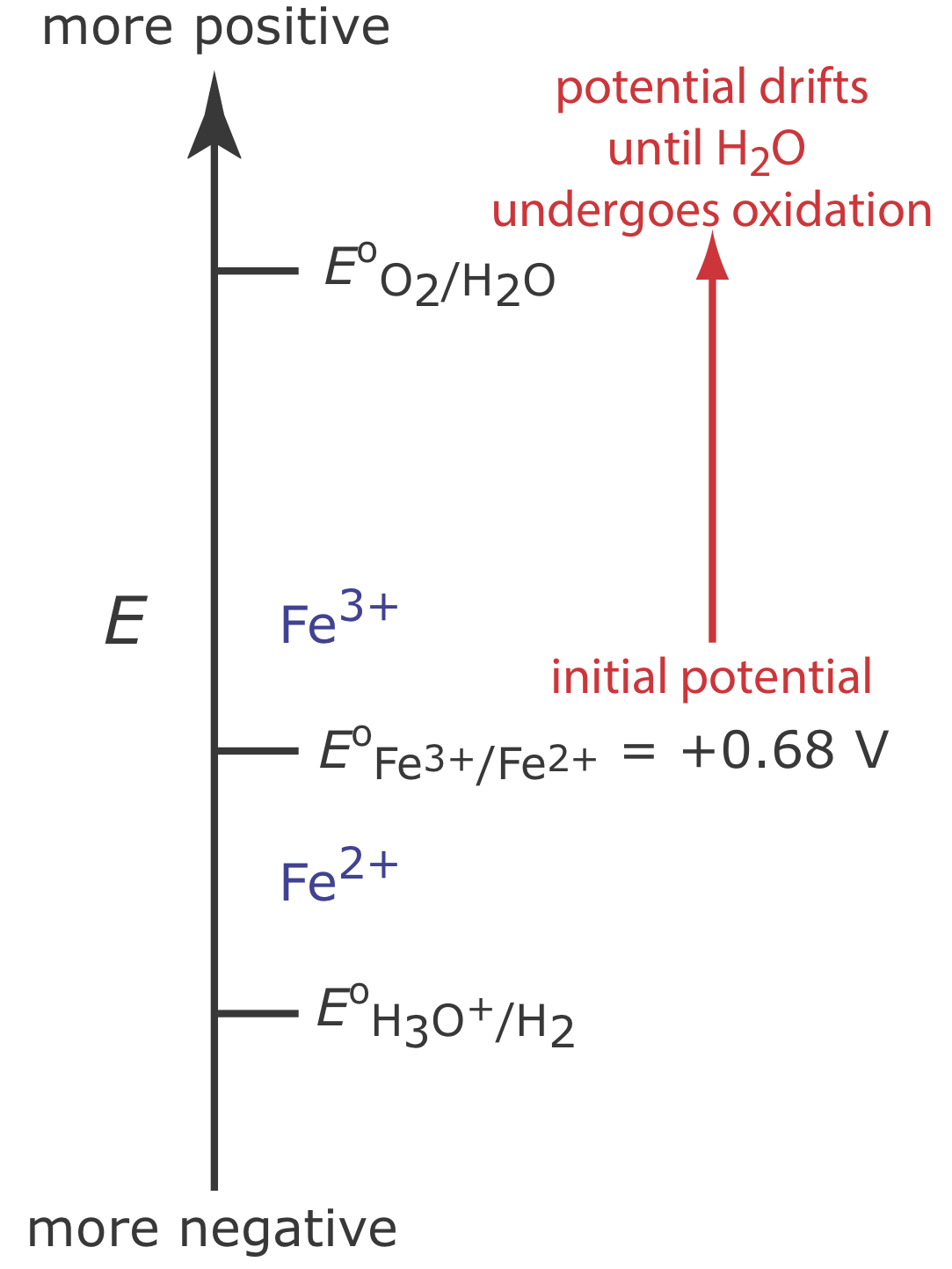
A medida que disminuye la concentración de Fe 2 + y aumenta la concentración de Fe 3 +, el potencial del electrodo de trabajo se desplaza hacia valores más positivos hasta que comienza la oxidación de H 2 O.
\[2 \mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons \text{ O}_{2}(g)+4 \mathrm{H}^{+}(a q)+4 e^{-} \label{ci2} \]
Debido a que una porción de la corriente total proviene de la oxidación de H 2 O, la eficiencia de corriente para el análisis es inferior al 100% y no podemos usar la ecuación\(Q = it\) para determinar la cantidad de Fe 2 + en la muestra.
Aunque no podemos evitar que el potencial se desvíe hasta que otra especie sufra oxidación, podemos mantener una eficiencia de corriente del 100% si el producto de esa reacción de oxidación secundaria reacciona rápida y cuantitativamente con el Fe 2 + restante. Para lograrlo agregamos un exceso de Ce 3 + a la solución analítica. Como se muestra en la Figura\(\PageIndex{3}\), cuando el potencial del electrodo de trabajo cambia a un potencial más positivo, Ce 3 + comienza a oxidarse a Ce 4 +
\[\mathrm{Ce}^{3+}(a q) \rightleftharpoons \text{ Ce}^{4+}(a q)+e^{-} \label{ci3} \]
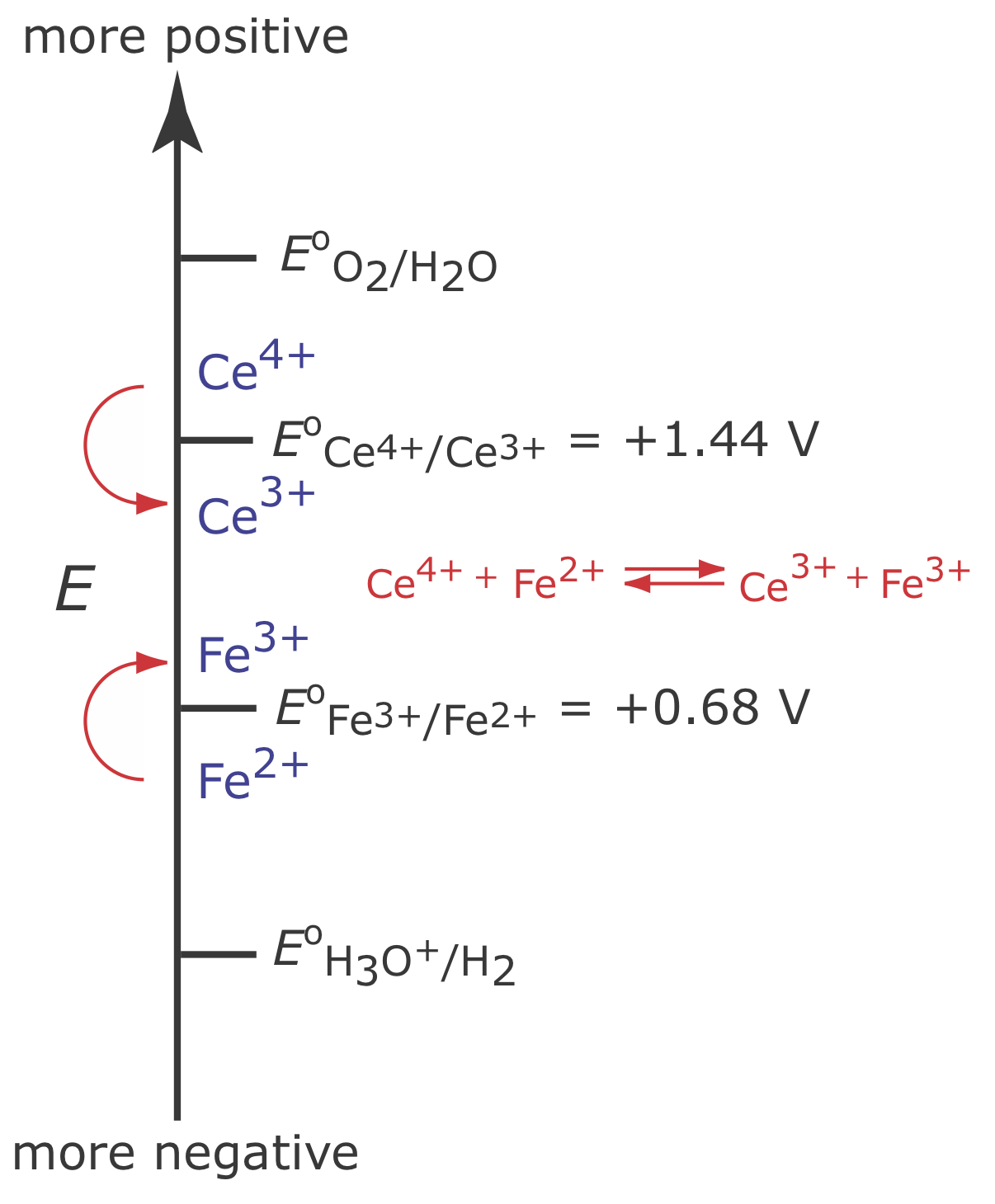
El Ce 4 + que se forma en el electrodo de trabajo se mezcla rápidamente con la solución donde reacciona con cualquier Fe 2 + disponible.
\[\mathrm{Ce}^{4+}(a q)+\text{ Fe}^{2+}(a q) \rightleftharpoons \text{ Ce}^{3+}(a q)+\text{ Fe}^{3+}(a q) \label{ci4} \]
Combinando la reacción\ ref {ci3} y la reacción\ ref {ci4} muestra que la reacción neta es la oxidación de Fe 2 + a Fe 3 +
\[\mathrm{Fe}^{2+}(a q) \rightleftharpoons \text{ Fe}^{3+}(a q)+e^{-} \label{ci5} \]
que mantiene una eficiencia actual del 100%. Una especie utilizada para mantener una eficiencia de corriente del 100% se llama mediador.
Determinación de punto final
Agregar un mediador resuelve el problema de mantener la eficiencia de corriente del 100%, pero no resuelve el problema de determinar cuándo se completa la electrólisis del analito. Utilizando el análisis para Fe 2 + en la Figura\(\PageIndex{3}\), cuando la oxidación de Fe 2 + es completa la corriente continúa fluyendo de la oxidación de Ce 3 +, y, eventualmente, la oxidación de H 2 O. Lo que necesitamos es una señal que nos dice cuando no hay más Fe 2 + presente en la solución.
Para nuestros propósitos, es conveniente tratar un análisis coulométrico de corriente controlada como una reacción entre el analito, Fe 2 +, y el mediador, Ce 3 +, como lo muestra la reacción\ ref {ci4}. Esta reacción es idéntica a una valoración redox; por lo tanto, podemos usar los puntos finales para una valoración redox (indicadores visuales y mediciones potenciométricas o conductométricas) para señalar el final de un análisis culombimétrico de corriente controlada. Por ejemplo, la ferroína proporciona un punto final visual útil para el análisis coulométrico mediado por Ce 3 + para Fe 2 +, cambiando de color de rojo a azul cuando se completa la electrólisis de Fe 2 +.
Instrumentación
Podemos llevar a cabo la coulometría de corriente controlada utilizando el galvanostato de dos electrodos mostrado en la Figura\(\PageIndex{4}\), el cual consiste en un electrodo de trabajo y un contraelectrodo. El electrodo de trabajo, a menudo un simple electrodo de Pt, también se llama electrodo generador ya que es donde reacciona el mediador para generar la especie que reacciona con el analito. Si es necesario, el contraelectrodo se aísla de la solución analítica mediante un puente salino o una frita porosa para evitar que sus productos de electrólisis reaccionen con el analito. La corriente de la fuente de alimentación a través del electrodo de trabajo es
\[i=\frac{E_{\mathrm{PS}}}{R+R_{\mathrm{cell}}} \label{ci6} \]
donde E PS es el potencial de la fuente de alimentación, R es la resistencia de la resistencia y la celda R es la resistencia de la celda electroquímica. Si R >> celda R, entonces la corriente entre los electrodos auxiliar y de trabajo
\[i=\frac{E_{\mathrm{PS}}}{R} \approx \text{constant} \label{ci7} \]
mantiene un valor constante. Para monitorear el potencial del electrodo de trabajo, que cambia a medida que cambia la composición de la celda electroquímica, podemos incluir un electrodo de referencia opcional y un potenciómetro de alta impedancia.

Alternativamente, podemos generar el agente oxidante o el agente reductor externamente, y permitir que fluya hacia la solución analítica. La figura\(\PageIndex{5}\) muestra un método sencillo para lograrlo. Una solución que contiene el mediador fluye hacia una celda electroquímica de pequeño volumen con los productos saliendo a través de tubos separados. Dependiendo del analito, el agente oxidante o el reactivo reductor se suministra a la solución analítica. Por ejemplo, podemos generar Ce 4 + usando una solución acuosa de Ce 3 +, dirigiendo el Ce 4 + que se forma en el ánodo a nuestra muestra.
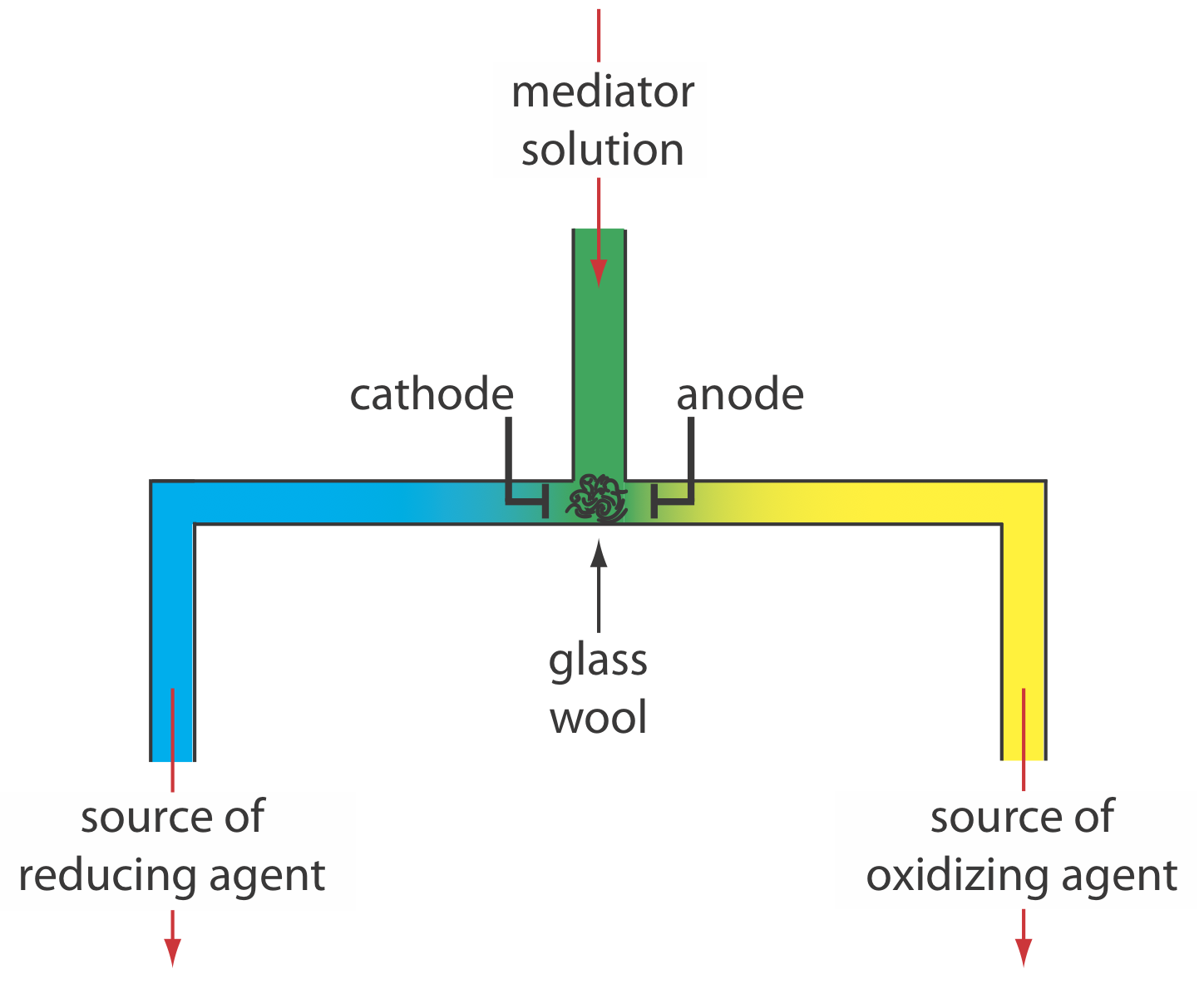
Hay otras dos necesidades cruciales para la coulometría de corriente controlada: un reloj preciso para medir el tiempo de electrólisis, t e, y un interruptor para iniciar y detener la electrólisis. Un reloj analógico puede registrar el tiempo a los ±0.01 s más cercanos, pero la necesidad de detener e iniciar la electrólisis a medida que nos acercamos al punto final puede resultar en una incertidumbre general de ±0.1 s. Un reloj digital permite una medición más precisa del tiempo, con una incertidumbre general de ±1 ms. El interruptor debe controlar tanto la corriente como el reloj para que podamos hacer una determinación precisa del tiempo de electrólisis.
Titulaciones coulométricas
Un método coulométrico de corriente controlada a veces se denomina titulación coulométrica debido a su similitud con una titulación convencional. Por ejemplo, en el análisis coulométrico de corriente controlada para Fe 2 + usando un mediador Ce 3 +, la oxidación de Fe 2 + por Ce 4 + (reacción\ ref {ci4}) es idéntica a la reacción en una valoración redox.
Hay otras similitudes entre la culometría de corriente controlada y la titulación. Si combinamos la ecuación\(Q = nFN_a\) y la ecuación\(Q = it_e\) y resolvemos para los moles de analito, N A, obtenemos la siguiente ecuación.
\[N_{A}=\frac{i}{n F} \times t_{e} \label{ci8} \]
Comparar la Ecuación\ ref {ci8} con la relación entre los moles de analito, N A, y los moles de valorante, N T, en una titulación
\[N_{A}=N_{T}=M_{T} \times V_{T} \label{ci9} \]
donde M T y V T son la molaridad del valorante y el volumen de valorante en el punto final. En la coulometría de corriente constante, la fuente de corriente es equivalente al valorante y el valor de esa corriente es análogo a la molaridad del valorante. El tiempo de electrólisis es análogo al volumen del valorante, y t e es equivalente al punto final de la titulación a. Finalmente, el interruptor para iniciar y detener la electrólisis cumple la misma función que la llave de paso de una bureta.
Por simplicidad, asumimos anteriormente que la estequiometría entre el analito y el valorante es 1:1. La suposición, sin embargo, no es importante y no afecta nuestra observación de la similitud entre la culometría de corriente controlada y una titulación.
Aplicaciones Cuantitativas
El uso de un mediador hace que la valoración culombimétrica sea una técnica analítica más versátil que la coulometría de potencial controlado. Por ejemplo, la oxidación o reducción directa de una proteína en un electrodo de trabajo es difícil si el sitio redox activo de la proteína se encuentra profundamente dentro de su estructura. Una titulación coulométrica de la proteína es posible, sin embargo, si utilizamos la oxidación o reducción de un mediador para producir una especie de solución que reaccione con la proteína. La tabla\(\PageIndex{1}\) resume varios métodos coulométricos de corriente controlada basados en una reacción redox utilizando un mediador.
Para un analito que no es fácil de oxidar o reducir, podemos completar una titulación culombimétrica acoplando la oxidación o reducción de un mediador a una reacción ácido-base, precipitación o complejación que involucra al analito. Por ejemplo, si usamos H 2 O como mediador, podemos generar H 3 O + en el ánodo
\[6 \mathrm{H}_{2} \mathrm{O}(l) \rightleftharpoons 4 \mathrm{H}_{3} \text{O}^{+}(a q)+\text{ O}_{2}(g)+4 e^{-} \nonumber \]
y generar OH — en el cátodo.
\[2 \mathrm{H}_{2} \mathrm{O}(l)+2 e^{-} \rightleftharpoons 2 \mathrm{OH}^{-}(a q)+\text{ H}_{2}(g) \nonumber \]
Si realizamos la oxidación o reducción de H 2 O usando la celda generadora en la Figura\(\PageIndex{5}\), entonces podemos dispensar selectivamente H 3 O + u OH — en una solución que contenga el analito. La reacción resultante es idéntica a la de una valoración ácido-base. Las titulaciones coulométricas ácido-base se han utilizado para el análisis de ácidos y bases fuertes y débiles, tanto en matrices acuosas como no acuosas. La tabla\(\PageIndex{2}\) resume varios ejemplos de titulaciones culombimétricas que involucran reacciones ácido-base, complejación y precipitación.
En comparación con una valoración convencional, una valoración culombimétrica tiene dos ventajas importantes. La primera ventaja es que generar electroquímicamente un valorante nos permite utilizar un reactivo que es inestable. Aunque no podemos preparar y almacenar una solución de un reactivo altamente reactivo, como Ag 2 + o Mn 3 +, podemos generarlos electroquímicamente y usarlos en una titulación coulométrica. Segundo, debido a que es relativamente fácil medir una pequeña cantidad de carga, podemos usar una titulación culombimétrica para determinar un analito cuya concentración es demasiado pequeña para una valoración convencional.
El siguiente ejemplo muestra los cálculos para un análisis coulométrico típico.
Para determinar la pureza de una muestra de Na 2 S 2 O 3, se valora culombimétricamente una muestra usando I —como mediador y\(\text{I}_3^-\) como valorante. Una muestra que pesa 0.1342 g se transfiere a un matraz aforado de 100 mL y se diluye a volumen con agua destilada. Se transfiere una porción de 10.00 ml a una celda electroquímica junto con 25 mL de KI 1 M, 75 mL de un tampón fosfato pH 7.0 y varias gotas de una solución indicadora de almidón. La electrólisis a una corriente constante de 36.45 mA requiere 221.8 s para alcanzar el punto final del indicador de almidón. Determinar la pureza de la muestra.
Solución
Como se muestra en la Tabla\(\PageIndex{1}\), la valoración coulométrica de\(\text{S}_2 \text{O}_3^{2-}\) con\(\text{I}_3^-\) es
\[2 \mathrm{S}_{2} \mathrm{O}_{3}^{2-}(a q)+\text{ I}_{3}^{-}(a q)\rightleftharpoons \text{ S}_{4} \mathrm{O}_{6}^{2-}(a q)+3 \mathrm{I}^{-}(a q) \nonumber \]
La oxidación de\(\text{S}_2 \text{O}_3^{2-}\) a\(\text{S}_4 \text{O}_6^{2-}\) requiere un electrón por\(\text{S}_2 \text{O}_3^{2-}\) (n = 1). Combinando las ecuaciones\(Q = nFN_A\) y\(Q = it_e\), y resolviendo para los moles y gramos de Na 2 S 2 O 3 da
\[N_{A} =\frac{i t_{e}}{n F}=\frac{(0.03645 \text{ A})(221.8 \text{ s})}{\left(\frac{1 \text{ mol } e^{-}}{\text{mol Na}_{2} \mathrm{S}_{2} \mathrm{O}_{3}}\right)\left(\frac{96487 \text{ C}}{\text{mol } e^{-}}\right)} =8.379 \times 10^{-5} \text{ mol Na}_{2} \mathrm{S}_{2} \mathrm{O}_{3} \nonumber \]
Esta es la cantidad de Na 2 S 2 O 3 en una porción de 10.00-mL de una muestra de 100-mL; así, hay 0.1325 gramos de Na 2 S 2 O 3 en la muestra original. La pureza de la muestra, por lo tanto, es
\[\frac{0.1325 \text{ g} \text{ Na}_{2} \mathrm{S}_{2} \mathrm{O}_{3}}{0.1342 \text{ g} \text { sample }} \times 100=98.73 \% \text{ w} / \text{w } \mathrm{Na}_{2} \mathrm{S}_{2} \mathrm{O}_{3} \nonumber \]
Tenga en cuenta que para esta calcuación, no importa si\(\text{S}_2 \text{O}_3^{2-}\) se oxida en el electrodo de trabajo o se oxida por\(\text{I}_3^-\).


