27.4: Aplicaciones de Cromatografía de Gases
- Page ID
- 79007
Aplicaciones Cuantitativas
La cromatografía de gases es ampliamente utilizada para el análisis de una amplia gama de muestras en laboratorios ambientales, clínicos, farmacéuticos, bioquímicos, forenses, de ciencias de los alimentos y petroquímicos. Table 27.4.1 proporciona algunos ejemplos representativos de aplicaciones.
| zona | aplicaciones |
|---|---|
| análisis ambiental |
gases de invernadero (CO 2, CH 4, NO x) en el aire pesticidas en agua, aguas residuales y suelo emisiones vehiculares trihalometanos en agua potable |
| análisis clínicos |
drogas alcoholes de la sangre |
| análisis forense |
análisis de acelerantes de incendios detección de explosivos |
| productos de consumo |
orgánicos volátiles en especias y fragancias trace organics en whisky monómeros en pintura látex |
| industria petroquímica y química |
pureza de disolventes gas de refinería composición de la gasolina |
Cálculos cuantitativos
En un análisis GC el área bajo el pico es proporcional a la cantidad de analito inyectado en la columna. El área de un pico está determinada por la integración, que generalmente es manejada por la computadora del instrumento o por una grabadora electrónica integradora. Si dos picos se resuelven completamente, la determinación de sus respectivas áreas es sencilla.
Antes de integrar grabadoras electrónicas y computadoras, se utilizaron dos métodos para encontrar el área bajo una curva. Un método utilizó un planímetro manual; al usar el planímetro para trazar el perímetro de un objeto, registra el área. Un segundo enfoque para encontrar el área de un pico es el método de cortar y pesar. El cromatograma se registra en una hoja de papel y cada pico de interés se corta y se pesa. Suponiendo que el papel es uniforme en grosor y densidad de fibras, la relación de pesos para dos picos es la misma que la relación de áreas. Por supuesto, este enfoque destruye tu cromatograma.
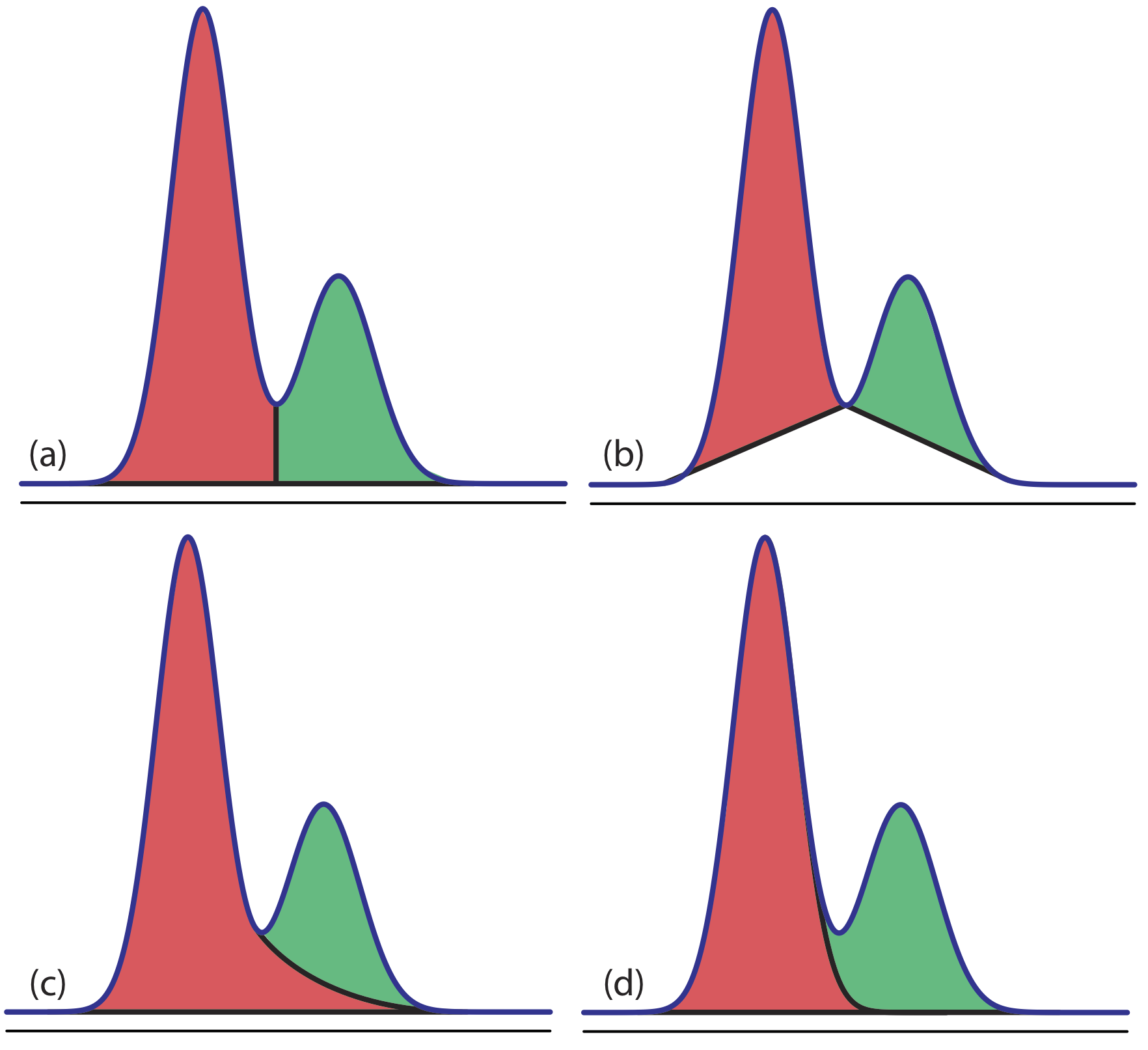
Los picos superpuestos, sin embargo, requieren una elección entre una de varias opciones para dividir el área compartida por los dos picos (Figura 27.4.1 ). El método que utilizamos depende del tamaño relativo de los dos picos y su resolución. En algunos casos, el uso de alturas de pico proporciona resultados más precisos [(a) Bicking, M. K. L. Chromatography Online, abril de 2006; (b) Bicking, M. K. L. Chromatography Online, junio de 2006].
Para el trabajo cuantitativo necesitamos establecer una curva de calibración que relacione la respuesta del detector con la concentración del analito. Si el volumen de inyección es idéntico para cada estándar y muestra, entonces una estandarización externa proporciona resultados precisos y precisos. Desafortunadamente, incluso en las mejores condiciones la precisión relativa de las inyecciones replicadas puede diferir en un 5%; a menudo es sustancialmente peor. Para trabajos cuantitativos que requieran alta precisión y precisión, se recomienda el uso de estándares internos.
Marriott y Carpenter reportan los siguientes datos para cinco inyecciones replicadas de una mezcla que contiene 1% v/v de metil isobutil cetona y 1% v/v de p-xileno en diclorometano [Marriott, P. J.; Carpenter, P. D. J. Chem. Educ. 1996, 73, 96—99].
| inyección | pico | área de pico (unidades arb.) |
|---|---|---|
| I | 1 | 48075 |
| 2 | 78112 | |
| II | 1 | 85829 |
| 2 | 135404 | |
| III | 1 | 84136 |
| 2 | 132332 | |
| IV | 1 | 71681 |
| 2 | 112889 | |
| V | 1 | 58054 |
| 2 | 91287 |
Supongamos que p-xileno (pico 2) es el analito, y que la metil isobutil cetona (pico 1) es el estándar interno. Determinar el intervalo de confianza del 95% para una estandarización de punto único con y sin usar el estándar interno.
Solución
Para una estandarización externa de un solo punto ignoramos el estándar interno y determinamos la relación entre el área del pico para p-xileno, A 2, y la concentración, C 2, de p-xileno.
\[A_{2}=k C_{2} \nonumber \]
Sustituyendo la concentración conocida por p-xileno (1% v/v) y las áreas de pico apropiadas, da los siguientes valores para la constante k.
\[78112 \quad 135404 \quad 132332 \quad 112889 \quad 91287 \nonumber \]
El valor promedio para k es de 110 000 con una desviación estándar de 25 100 (una desviación estándar relativa de 22.8%). El intervalo de confianza del 95% es
\[\mu=\overline{X} \pm \frac{t s}{\sqrt{n}}=111000 \pm \frac{(2.78)(25100)}{\sqrt{5}}=111000 \pm 31200 \nonumber \]
Para una estandarización interna, la relación entre el área del pico del analito, A2, el área del pico del patrón interno, A1, y sus respectivas concentraciones, C 2 y C1, es
\[\frac{A_{2}}{A_{1}}=k \frac{C_{2}}{C_{1}} \nonumber \]
Sustituyendo en las concentraciones conocidas y las áreas de pico apropiadas da los siguientes valores para la constante k.
\[1.5917 \quad 1.5776 \quad 1.5728 \quad 1.5749 \quad 1.5724 \nonumber \]
El valor promedio para k es de 1.5779 con una desviación estándar de 0.0080 (una desviación estándar relativa de 0.507%). El intervalo de confianza del 95% es
\[\mu=\overline{X} \pm \frac{t s}{\sqrt{n}}=1.5779 \pm \frac{(2.78)(0.0080)}{\sqrt{5}}=1.5779 \pm 0.0099 \nonumber \]
Aunque existe una variación sustancial en las áreas de pico individuales para este conjunto de inyecciones replicadas, el estándar interno compensa estas variaciones, proporcionando una calibración más precisa y precisa.
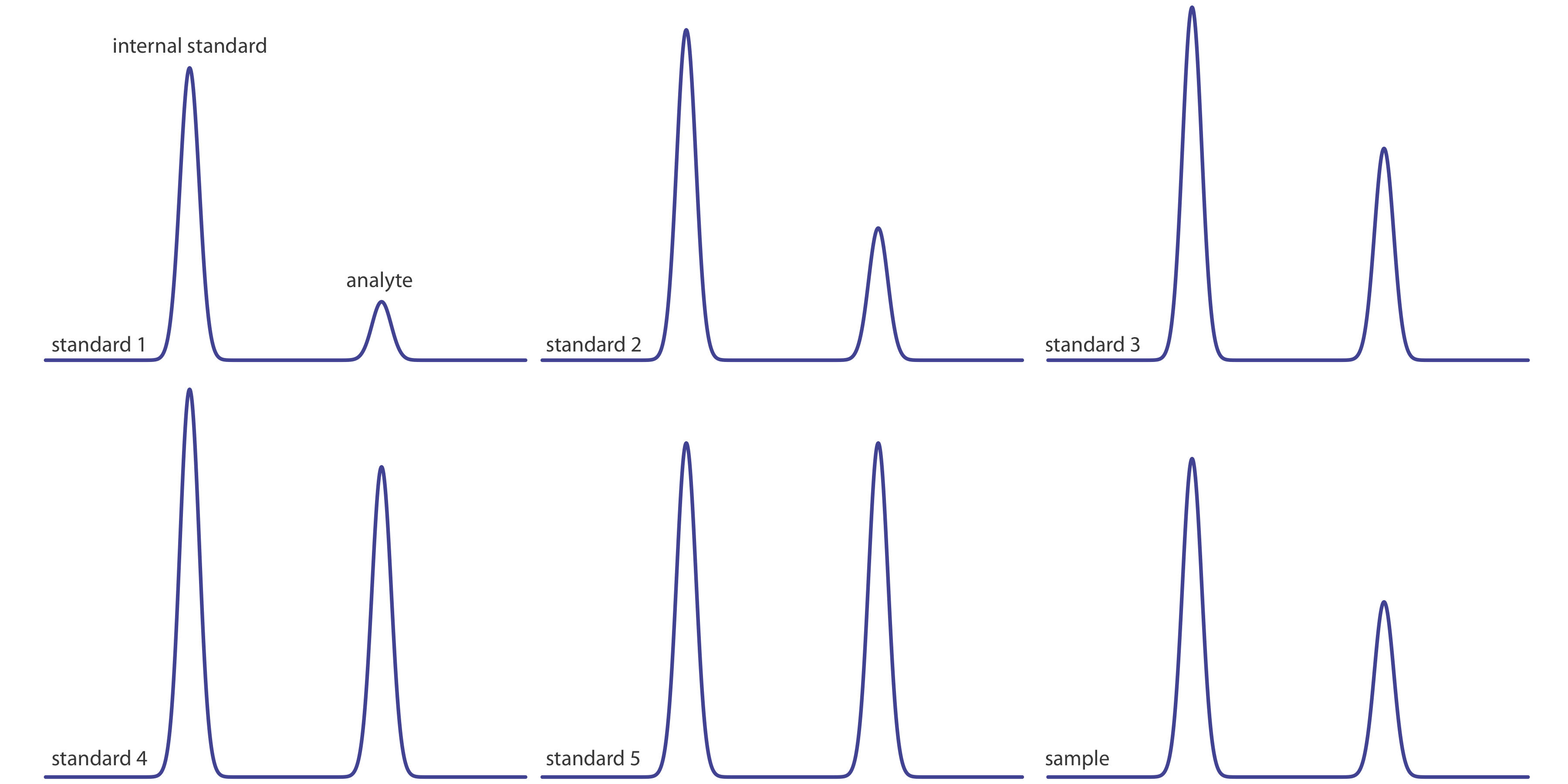
La Figura 27.4.2 muestra cromatogramas para cinco patrones y para una muestra. Cada patrón y muestra contiene la misma concentración de un patrón interno, que es de 2.50 mg/mL. Para los cinco estándares, las concentraciones de analito son 0.20 mg/mL, 0.40 mg/mL, 0.60 mg/mL, 0.80 mg/mL y 1.00 mg/mL, respectivamente. Determinar la concentración de analito en la muestra (a) ignorando los estándares internos y creando una curva de calibración de estándares externos, y (b) creando una curva de calibración estándar interna. Para cada abordaje, reportar la concentración del analito y el intervalo de confianza del 95%. Use alturas de pico en lugar de áreas de picos.
- Contestar
-
En la siguiente tabla se resumen mis medidas de las alturas de los picos para cada estándar y la muestra, y su relación (aunque sus valores absolutos para alturas de pico diferirán de los míos, dependiendo del tamaño de su monitor o impresión, sus relaciones relativas de altura máxima deben ser similares a las mías).
[estándar] (mg/mL) altura de pico estándar (mm) altura pico del analito (mm) relación de altura de pico 0.20 35 7 0.20 0.40 41 16 0.39 0.60 44 27 0.61 0.80 48 39 0.81 1.00 41 41 1.00 muestra 39 21 0.54 La figura (a) muestra la curva de calibración y la ecuación de calibración cuando ignoramos el estándar interno. Sustituyendo la altura del pico de la muestra en la ecuación de calibración da la concentración del analito en la muestra como 0.49 mg/mL. El intervalo de confianza del 95% es de ±0.24 mg/mL. La curva de calibración muestra bastante dispersión en los datos debido a la incertidumbre en los volúmenes de inyección.
La Figura (b) muestra la curva de calibración y la ecuación de calibración cuando se incluye el estándar interno. Sustituir la relación de altura máxima de la muestra en la ecuación de calibración da la concentración del analito en la muestra como 0.54 mg/mL. El intervalo de confianza del 95% es de ±0.04 mg/mL.

Los datos para este ejercicio se crearon de manera que la concentración real del analito sea de 0.55 mg/mL. Dada la resolución de la escala de mi gobernante, mi respuesta es bastante razonable. Sus medidas pueden ser ligeramente diferentes, pero sus respuestas deben estar cerca de los valores reales.
Aplicaciones Cualitativas
Además de un análisis cuantitativo, también podemos utilizar la cromatografía para identificar los componentes de una mezcla. Como se señaló anteriormente, cuando se usa un FT—IR o un espectrómetro de masas como detector tenemos acceso al espectro completo del eluyente para cualquier tiempo de retención. Interpretando el espectro o buscando contra una biblioteca de espectros, podemos identificar el analito responsable de cada pico cromatográfico.
Además de identificar el componente responsable de un pico cromatográfico particular, también podemos usar los espectros guardados para evaluar la pureza máxima. Si solo un componente es responsable de un pico cromatográfico, entonces los espectros deben ser idénticos a lo largo de la elución del pico. Si un espectro al comienzo de la elución del pico es diferente de un espectro tomado cerca del final de la elución del pico, entonces al menos dos componentes están coeluyendo.
Cuando se utiliza un detector no espectroscópico, como un detector de ionización de llama, debemos encontrar otro enfoque si queremos identificar los componentes de una mezcla. Un enfoque consiste en espigar una muestra con el compuesto sospechoso y buscar un aumento en la altura del pico. También podemos comparar el tiempo de retención de un pico con el tiempo de retención para un compuesto conocido si usamos condiciones de operación idénticas.
Debido a que no es probable que los tiempos de retención de un compuesto en dos columnas idénticas sean los mismos, las diferencias en la eficiencia del empaque, por ejemplo, afectarán el tiempo de retención de un soluto en una columna empaquetada, no es posible crear una tabla de tiempos de retención estándar. El índice de retención de Kovat proporciona una solución al problema de igualar los tiempos de retención. En condiciones isotérmicas, los tiempos de retención ajustados para alcanos normales aumentan logarítmicamente. Kovat definió el índice de retención, I, para un alcano normal como 100 veces el número de átomos de carbono. Por ejemplo, el índice de retención es de 400 para butano, C 4 H 10 y 500 para pentano, C 5 H 12. Para determinar el índice de retención de un compuesto, I cpd, utilizamos la siguiente fórmula
\[I_{cpd} = 100 \times \frac {\log t_{r,cpd}^{\prime} - \log t_{r,x}^{\prime}} {\log t_{r, x+1}^{\prime} - \log t_{r,x}^{\prime}} + I_x \label{12.1} \]
donde\(t_{r,cpd}^{\prime}\) está el tiempo de retención ajustado del compuesto,\(t_{r,x}^{\prime}\) y\(t_{r,x+1}^{\prime}\) son los tiempos de retención ajustados para los alcanos normales que eluyen inmediatamente antes del compuesto e inmediatamente después del compuesto, respectivamente, e I x es el índice de retención para la normal alcano que eluye inmediatamente antes del compuesto. El índice de retención de un compuesto para un conjunto particular de condiciones cromatográficas (fase estacionaria, fase móvil, tipo de columna, longitud de columna, temperatura, etc.) es razonablemente consistente de día a día y entre diferentes columnas e instrumentos.
Se encuentran disponibles tablas de los índices de retención de Kovat; véase, por ejemplo, el Webbook de Química del NIST. La búsqueda de tolueno devuelve 341 valores de I para más de 20 fases estacionarias diferentes, y para columnas empaquetadas y columnas capilares.
En una separación de una mezcla de hidrocarburos se miden los siguientes tiempos de retención ajustados: 2.23 min para propano, 5.71 min para isobutano y 6.67 min para butano. ¿Cuál es el índice de retención de Kovat para cada uno de estos hidrocarburos?
Solución
El índice de retención de Kovat para un alcano normal es 100 veces el número de carbonos; así, para propano, I = 300 y para butano, I = 400. Para encontrar el índice de retención de Kovat para isobutano utilizamos la Ecuación\ ref {12.1}.
\[I_\text{isobutane} =100 \times \frac{\log (5.71)-\log (2.23)}{\log (6.67)-\log (2.23)}+300=386 \nonumber \]
Al usar una columna con la misma fase estacionaria que en el Ejemplo 27.4.2 , se encuentra que los tiempos de retención para propano y butano son de 4.78 min y 6.86 min, respectivamente. ¿Cuál es el tiempo de retención esperado para el isobutano?
- Contestar
-
Debido a que estamos usando la misma columna podemos suponer que el índice de retención de isobutano de 386 permanece sin cambios. Usando la ecuación\ ref {12.1}, tenemos
\[386=100 \times \frac{\log x-\log (4.78)}{\log (6.86)-\log (4.78)}+300 \nonumber \]
donde x es el tiempo de retención para isobutano. Resolviendo para x, encontramos que
\[0.86=\frac{\log x-\log (4.78)}{\log (6.86)-\log (4.78)} \nonumber \]
\[0.135=\log x-0.679 \nonumber \]
\[0.814=\log x \nonumber \]
\[x=6.52 \nonumber \]
el tiempo de retención para isobutano es de 6.5 min.


