2.2: Determinación del peso molecular
- Page ID
- 71139
Peso molecular en solución de moléculas pequeñas
El método crioscópico se introdujo formalmente en la década de 1880 cuando François-Marie Raoult publicó cómo los solutos deprimieron los puntos de congelación de diversos solventes como benceno, agua y ácido fórmico. Concluyó de su experimentación “si una molécula de una sustancia puede disolverse en cien moléculas de cualquier disolvente dado entonces la temperatura del disolvente se baja en un incremento de temperatura específico”. Con base en la investigación de Raoult, Ernst Otto Beckmann inventó el termómetro Beckmann y el aparato de punto de congelación asociado, lo que fue una mejora significativa en la medición de los valores de depresión del punto de congelación para un solvente puro. La simplicidad, facilidad y precisión de este aparato le ha permitido permanecer como un estándar actual con pocas modificaciones para la determinación del peso molecular de compuestos desconocidos.


El significado histórico de la investigación de Raoult y Beckmann, entre muchos otros investigadores, ha revolucionado una técnica de química física que actualmente se aplica a una amplia gama de disciplinas, desde la ciencia de los alimentos hasta los fluidos petrolíferos. Por ejemplo, los pesos moleculares crioscópicos medidos del petróleo crudo se utilizan para predecir la viscosidad y la tensión superficial para los cálculos de flujo de fluido necesarios en tuberías.
Depresión del punto de congelación
La depresión del punto de congelación es una propiedad coligativa en la que la temperatura de congelación de un disolvente puro disminuye en proporción al número de moléculas de soluto disueltas en el disolvente. La masa conocida del soluto agregado y el punto de congelación de la información del solvente puro permiten un cálculo exacto del peso molecular del soluto.
En la Ecuación\ ref {1} se describe la depresión del punto de congelación de una solución no iónica. Donde ∆T f es el cambio en la temperatura inicial y final del disolvente puro, K f es la constante de depresión del punto de congelación para el disolvente puro, y m (moles soluto/kg disolvente) es la molalidad de la solución.
\[\Delta T _ { f } = K _ { f } m \label{1} \]
Para una solución iónica mostrada en la Figura\(\PageIndex{2}\), las partículas de disociación deben contabilizarse con el número de partículas de soluto por unidad de fórmula,\(i\) (el factor van't Hoff).
\[\Delta T _ { f } = K _ { f } m i\ \label{2} \]
Procedimientos Crioscópicos
Aparato Crioscópico
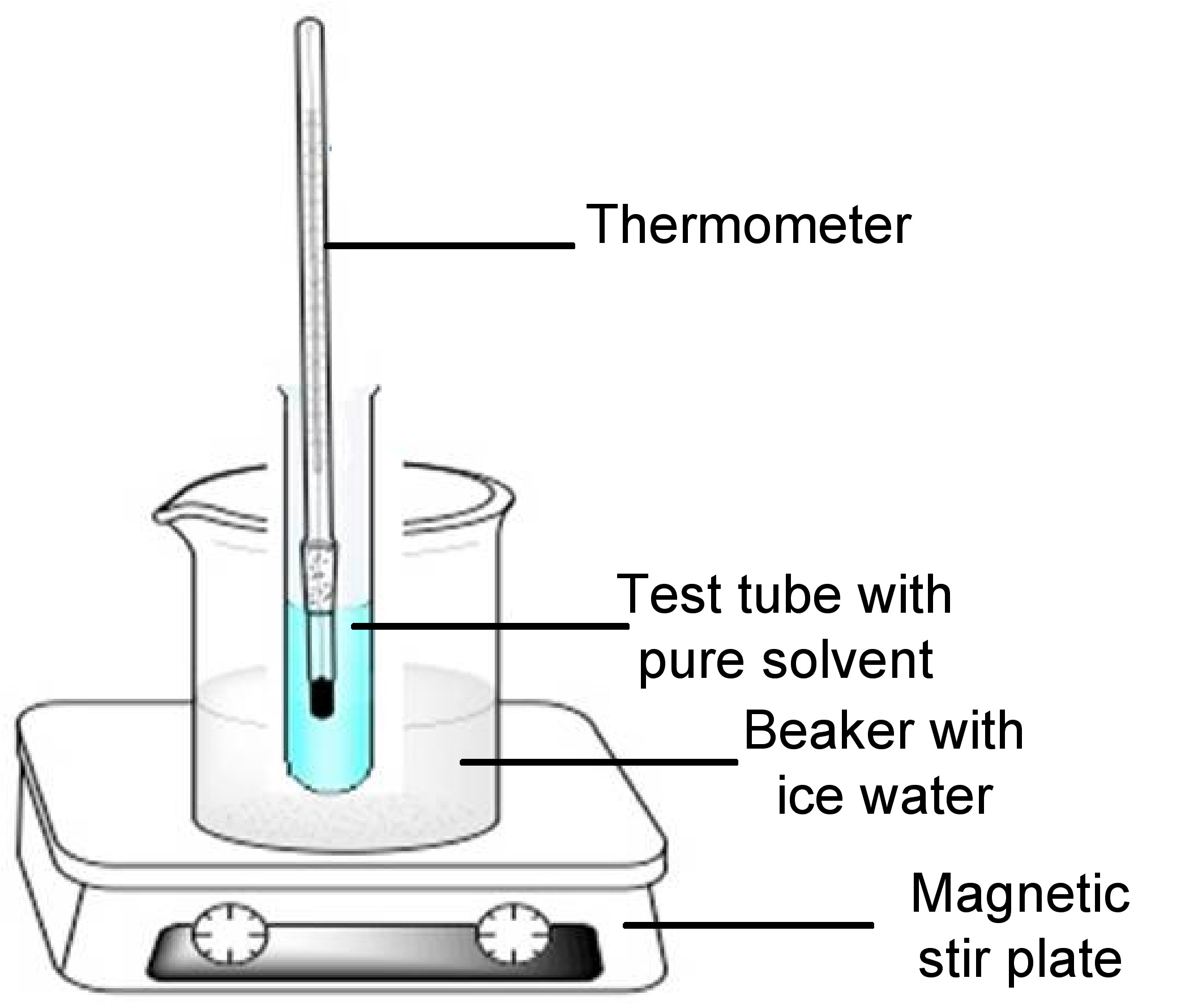
Para la crioscopía, el aparato para medir la depresión del punto de congelación de un disolvente puro puede ser representativo del aparato Beckmann previamente mostrado en la Figura\(\PageIndex{3}\). El aparato consiste en un tubo de ensayo que contiene el soluto disuelto en un solvente puro, barra agitadora o alambre magnético y cerrado con un tapón de goma que encierra un termómetro de mercurio. El componente del tubo de ensayo se sumerge en un baño de agua helada en un vaso de precipitados. Un ejemplo del aparato se muestra en la Figura\(\PageIndex{4}\). El tapón de goma y el agitador de barra/alambre de agitación no se muestran en la figura.
Selección de Muestras y Solventes
El método crioscópico puede ser utilizado para una amplia gama de muestras con diversos grados de polaridad. La selección de soluto y disolvente debe seguir la premisa de como disuelto como o en términos del principio de Raoult de la disolución de una molécula de soluto en cien moléculas de un disolvente. Los solventes más comunes como el benceno generalmente se seleccionan porque es no reactivo, volátil y miscible con muchos compuestos.\(\PageIndex{1}\) La tabla muestra las constantes crioscópicas (K f) para los solventes comunes utilizados para la crioscopía. Una lista completa de los valores de K f están disponibles en las Tablas Críticas de Knovel.
| Compuesto | K f |
|---|---|
| Ácido acético | 3.90 |
| Benceno | 5.12 |
| Alcanfor | 39.7 |
| Disulfuro de carbono | 3.8 |
| Tetracloruro de carbono | 30 |
| cloroformo | 4.68 |
| Ciclohexano | 20.2 |
| Etanol | 1.99 |
| Naftaleno | 6.8 |
| Fenol | 7.27 |
| Agua | 1.86 |
Método Crioscópico
A continuación se muestra la información detallada sobre el procedimiento utilizado para la crioscopía:
Permita que la solución se revuelva continuamente para evitar el sobreenfriamiento
- Pesar (15 a 20 gramos) del disolvente puro en un tubo de ensayo y registrar el valor de peso medido del disolvente puro.
- Coloque una barra agitadora o agitador de alambre en el tubo de ensayo y cierre con un tapón de goma que tenga un orificio para encerrar un termómetro de mercurio.
- Coloque un termómetro de mercurio en el orificio del tapón de goma.
- Sumerja el aparato de tubo de ensayo en un baño de agua helada.
- Permita que el disolvente se mueva continuamente y equilibre a unos grados por debajo del punto de congelación del disolvente.
- Registrar la temperatura a la que el disolvente alcanza el punto de congelación, que permanece en una lectura de temperatura constante.
- Repita la recolección de datos del punto de congelación para al menos dos mediciones más sin una diferencia menor a 0.5 °C entre las mediciones.
- Pesar una cantidad del soluto para la investigación y registrar el valor medido.
- Añadir el soluto pesado al tubo de ensayo que contiene el disolvente puro.
- Vuelva a cerrar el tubo de ensayo con un tapón de goma que encierra un termómetro de mercurio.
- Vuelva a sumergir el tubo de ensayo en un baño de agua helada y dejar que la mezcla se revuelva para disolver completamente el soluto en el solvente puro.
- Mida el punto de congelación y registre el valor de temperatura.
El punto de congelación observado de la solución es cuando la lectura de temperatura permanece constante.
Cálculo de la muestra para determinar el peso molecular
Conjunto de datos de muestra
Tabla\(\PageIndex{2}\) representa un ejemplo de una colección de conjunto de datos para crioscopía.
| Parámetro | Juicio 1 | Juicio 2 | Juicio 3 | Avg. |
|---|---|---|---|---|
| Masa de ciclohexano (g) | 9.05 | 9.00 | 9.04 | 9.03 |
| Masa de soluto desconocido (g) | 0.4000 | 0.41010 | 0.4050 | 0.4050 |
| Punto de congelación del ciclohexano (°C) | 6.5°C | 6.5°C | 6.5°C | 6.5°C |
| Punto de congelación del ciclohexano mezclado con soluto desconocido (°C) | 4.2°C | 4.3°C | 4.2°C | 4.2°C |
Cálculo del peso molecular usando la ecuación de depresión del punto de congelación
Calcular la depresión del punto de congelación (Fpt) de la solución (TΔ f) a partir de la Ecuación\ ref {3}
\[T \Delta _{f} =\ (Fpt\ of\ pure\ solvent)\ -\ (Fpt\ of\ solution)\ \label{3} \]
\[T \Delta_{f} = \ 6.5^{\circ}C-4.2^{\circ}C \nonumber \]
\[T \Delta_{f} =\ 2.3^{\circ} \nonumber \]
Calcular la concentración molal, m, de la solución usando la depresión del punto de congelación y K f (ver\ etiqueta {4})
\[ T \Delta_{f} = K_{f}m\ \label{4} \]
\[m = (2.3^{\circ}C)/(20.2^{\circ}C/molal) \nonumber \]
\[m = 0.113 molal \nonumber \]
\[m = g(solute)/kg(solvent) \nonumber \]
Calcular el M W de la muestra desconocida.
i = 1 para compuestos covalentes en\ ref {2}
\[M_{W} =\frac{K_{f}(g\ solute)}{\Delta T_{f} (kg solvent)} \nonumber \]
\[M_{W} = \frac{20.2^{\circ}C*kg/moles \times 0.405\ g}{2.3^{\circ}C \times 0.00903\ kg} \nonumber \]
\[M_{W} =\ 393\ g/mol \nonumber \]
Problemas
1. Nicotina (La figura\(\PageIndex{5}\) es un aceite amarillo pálido extraído de hojas de tabaco que se disuelve en agua a temperaturas inferiores a 60°C ¿Cuál es la molalidad de la nicotina en una solución acuosa que comienza a congelarse a -0.445°C? Ver Tabla\(\PageIndex{1}\) para valores de K f.
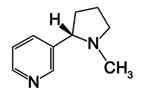
2. Si la solución utilizada en el Problema 1 se obtiene disolviendo 1.200 g de nicotina en 30.56 g de agua, ¿cuál es la masa molar de la nicotina?
3. ¿Cuál sería la depresión del punto de congelación cuando se disuelven 0.500 molales de Ca (NO 3) 2 en 60 g de agua?
4. Calcular el número de gramos ponderados de Ca (NO 3) 2 añadidos a los 60 g de agua para lograr la depresión del punto de congelación del Problema 3.
RESPUESTAS
1.



2.



3.

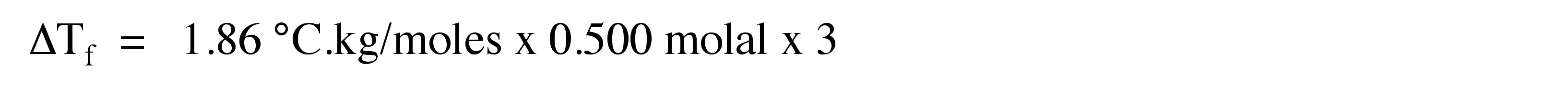

4.
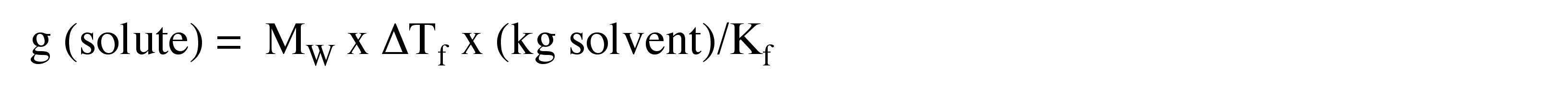
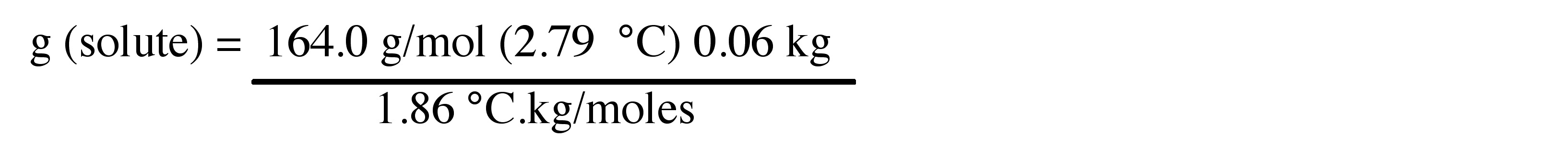

Peso Molecular de Polímeros
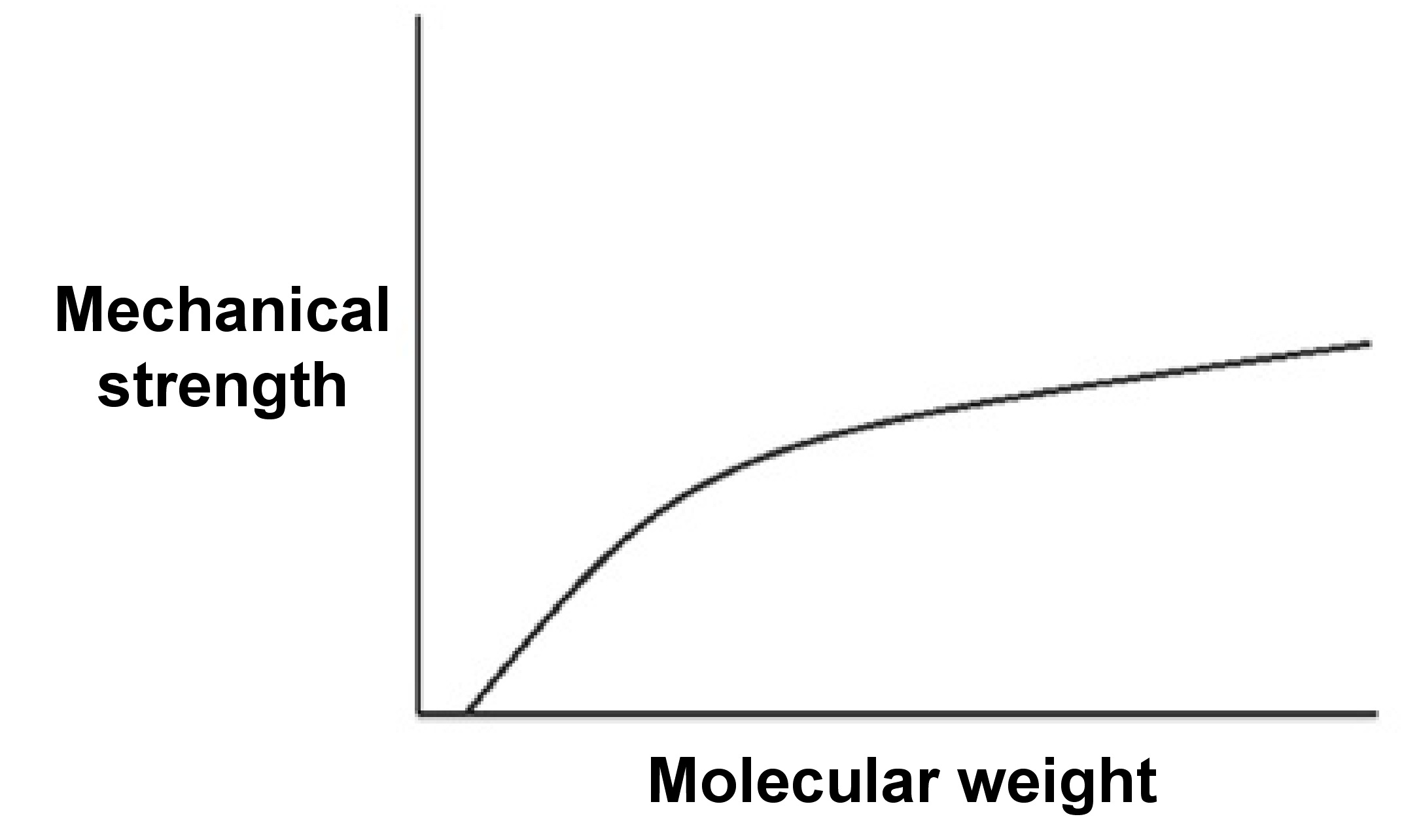
El conocimiento del peso molecular de los polímeros es muy importante porque las propiedades físicas de las macromoléculas se ven afectadas por su peso molecular. Por ejemplo, se muestra en\(\PageIndex{6}\) la Figura la interrelación entre el peso molecular y la resistencia para un polímero típico. Dependencia de la resistencia mecánica del peso molecular del polímero. Adaptado de G. Odián, Principles of Polimerization, 4ª edición, Willey-Interscience, Nueva York (2004).
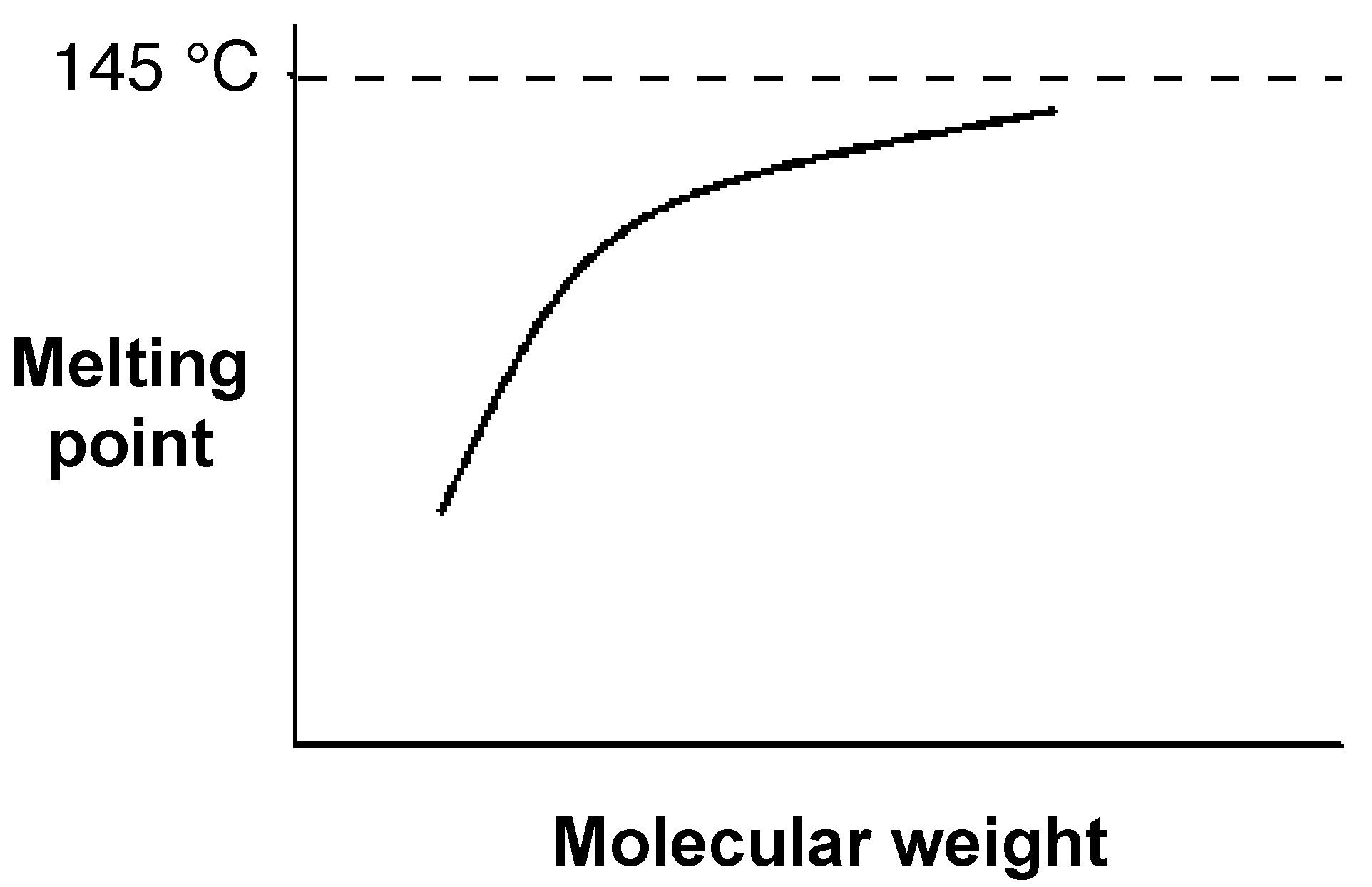
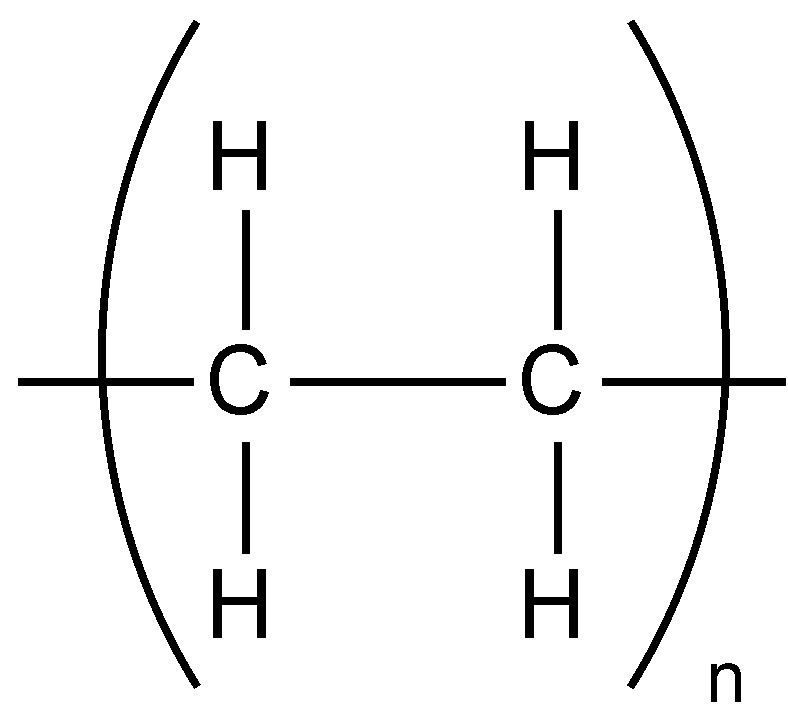
El punto de fusión de los polímeros también dependen ligeramente de su peso molecular. La figura\(\PageIndex{7}\) muestra la relación entre el peso molecular y las temperaturas de fusión del polietileno (Figura\(\PageIndex{8}\)) La mayoría de los polietilenos lineales tienen temperaturas de fusión cercanas a los 140 °C. La aproximación a la asíntota teórica, es decir, una línea cuya distancia a una curva dada tiende a cero, indicativo de que un polietileno teórico de peso molecular infinito (es decir, M = ∞) tendría un punto de fusión de 145 °C.
Relación peso molecular/temperatura de fusión para la serie alcano. Adaptado de L. H. Sperling, Introducción a la ciencia física de polímeros, 4ª edición, Wiley-Interscience, Nueva York (2005).
Hay varias formas de calcular el peso molecular de los polímeros como promedio numérico del peso molecular, promedio en peso del peso molecular, peso molecular promedio Z, peso molecular promedio de viscosidad y distribución del peso molecular.
Cálculos de peso molecular
Promedio numérico del peso molecular (M n)
El promedio numérico del peso molecular se mide para determinar el número de partículas. El promedio numérico del peso molecular es el peso total del polímero,\ ref {5}, dividido por el número de moléculas de polímero,\ ref {6}. El peso molecular promedio en número (M n) viene dado por\ ref {7}, donde M i es el peso molecular de una molécula de oligómero n, y N i es el número de moléculas de ese peso molecular.
\[ Total\ weight =\ \Sigma _{i=1} ^{∞} M_{i} N_{i} \label{5} \]
\[ Total\ number = \ \Sigma _{i=1} ^{∞} N _{i} \label{6} \]
\[ M_{n} =\frac{ \Sigma _{i=1} ^{∞} M_{i} N_{i}}{\Sigma _{i=1} ^{∞} N _{i}} \label{7} \]
Considerar una muestra de polímero que comprende 5 moles de moléculas de polímero que tienen un peso molecular de 40.000 g/mol y 15 moles de moléculas de polímero que tienen un peso molecular de 30.000 g/mol.

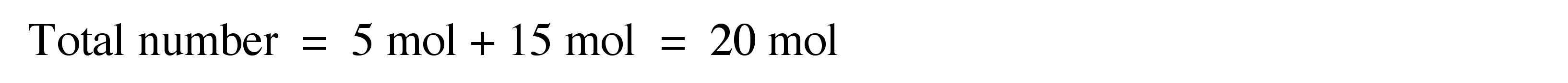

Promedio ponderal del peso molecular (M W)
Se mide el promedio ponderal del peso molecular (M W) para determinar la masa de las partículas. M W se define como\ ref {8}, donde M i es el peso molecular del oligómero n, y N i es el número de moléculas de ese peso molecular.
\[ M_{W} =\frac{\Sigma _{i=1} ^{∞} N_{i} (M_{i})^{2}}{\Sigma _{i=1} ^{∞} N_{i} M_{i}} \label{8} \]
Ejemplo:
Considera el polímero descrito en el problema anterior.
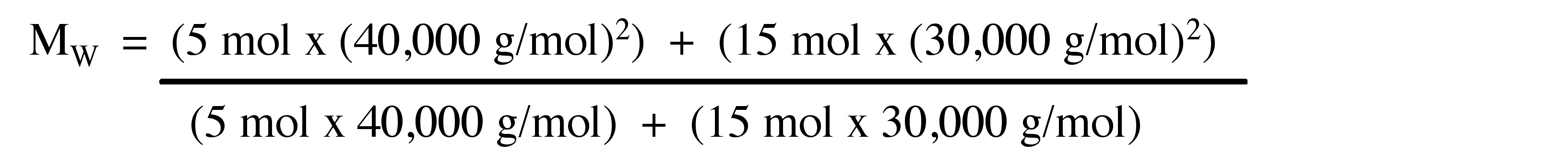

Calcular el M W para una muestra de polímero que comprende 9 moles de moléculas de polímero que tienen un peso molecular de 30.000 g/mol y 5 moles de moléculas de polímero que tienen un peso molecular de 50.000 g/mol.
Respuesta:
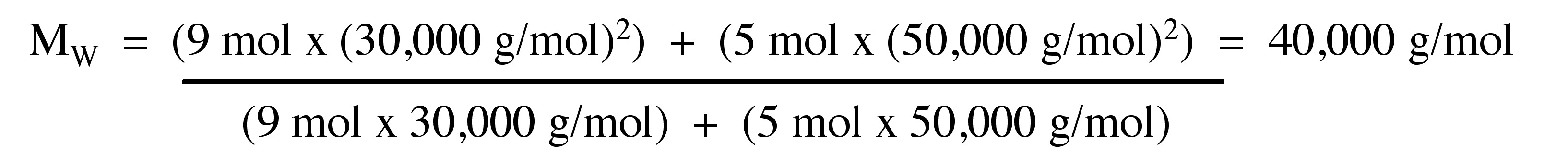
Z-peso molecular promedio (M Z)
El peso molecular promedio Z (Mz) se mide en algunos experimentos de equilibrio de sedimentación. Mz no es una técnica común para el peso molecular de los polímeros. La masa molar depende del tamaño y la masa de las moléculas. Las técnicas de ultra centrifugación emplean para determinar Mz. M z enfatiza partículas grandes y define el EQ, donde M i es peso molecular y N i es número de moléculas.
\[ M_{W} =\frac{\Sigma N_{i} M_{i}^{3}}{\Sigma N_{i} M{i}^{2}} \nonumber \]
Considera el polímero descrito en el problema anterior.
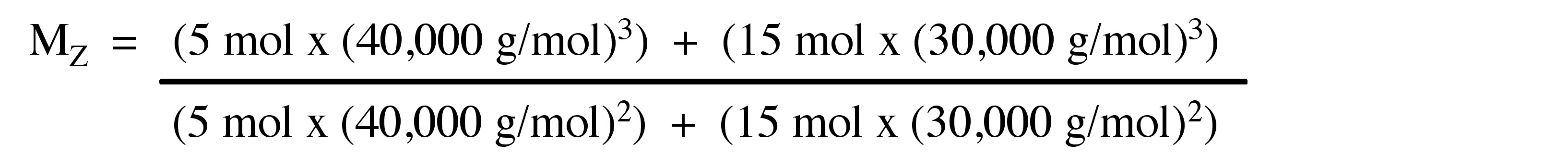


Peso molecular promedio de viscosidad (M V)
Una de las formas de medir el peso molecular promedio de los polímeros es la viscosidad de la solución. La viscosidad de un polímero depende de la concentración y peso molecular de los polímeros. Las técnicas de viscosidad son comunes ya que es experimentalmente simple. El peso molecular promedio de viscosidad se define como\ ref {9}, donde M i es el peso molecular y N i es el número de moléculas, a es una constante que depende del polímero-disolvente en los experimentos de viscosidad. Cuando a es igual a 1, M v es igual al peso molecular promedio en peso, si no es igual a 1 está entre el peso molecular promedio en peso y el peso molecular promedio en número.
\[(\frac{\Sigma N_{i} M_{i} ^{1+a}}{\Sigma N_{i} M_{i}})^{\frac{1}{2}} \label{9} \]
Distribución del peso molecular
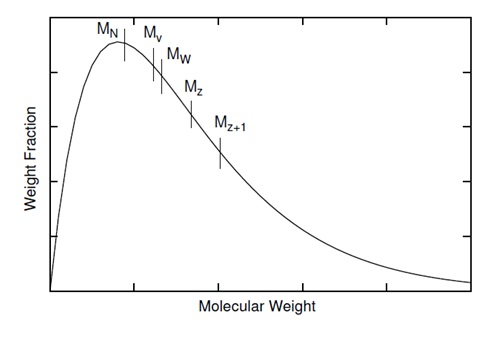
La distribución del peso molecular es una de las características importantes del polímero porque afecta las propiedades del polímero. Una distribución molecular típica de polímeros se muestra en\(\PageIndex{6}\). Hay varios pesos moleculares en el rango de curva. La distribución de tamaños en una muestra de polímero no está totalmente definida por su tendencia central. Se debe conocer el ancho y la forma de distribución. Siempre es cierto que los diversos rangos de peso molecular es\ ref {10}. La igualdad se produce cuando todos los polímeros de la muestra tienen el mismo peso molecular.
\[ M_{N} \geq M_{V} \geq M_{W} \geq M_{Z} \geq M_{Z+1} \label{10} \]
Análisis de peso molecular de polímeros
Cromatografía de permeación en gel (GPC)
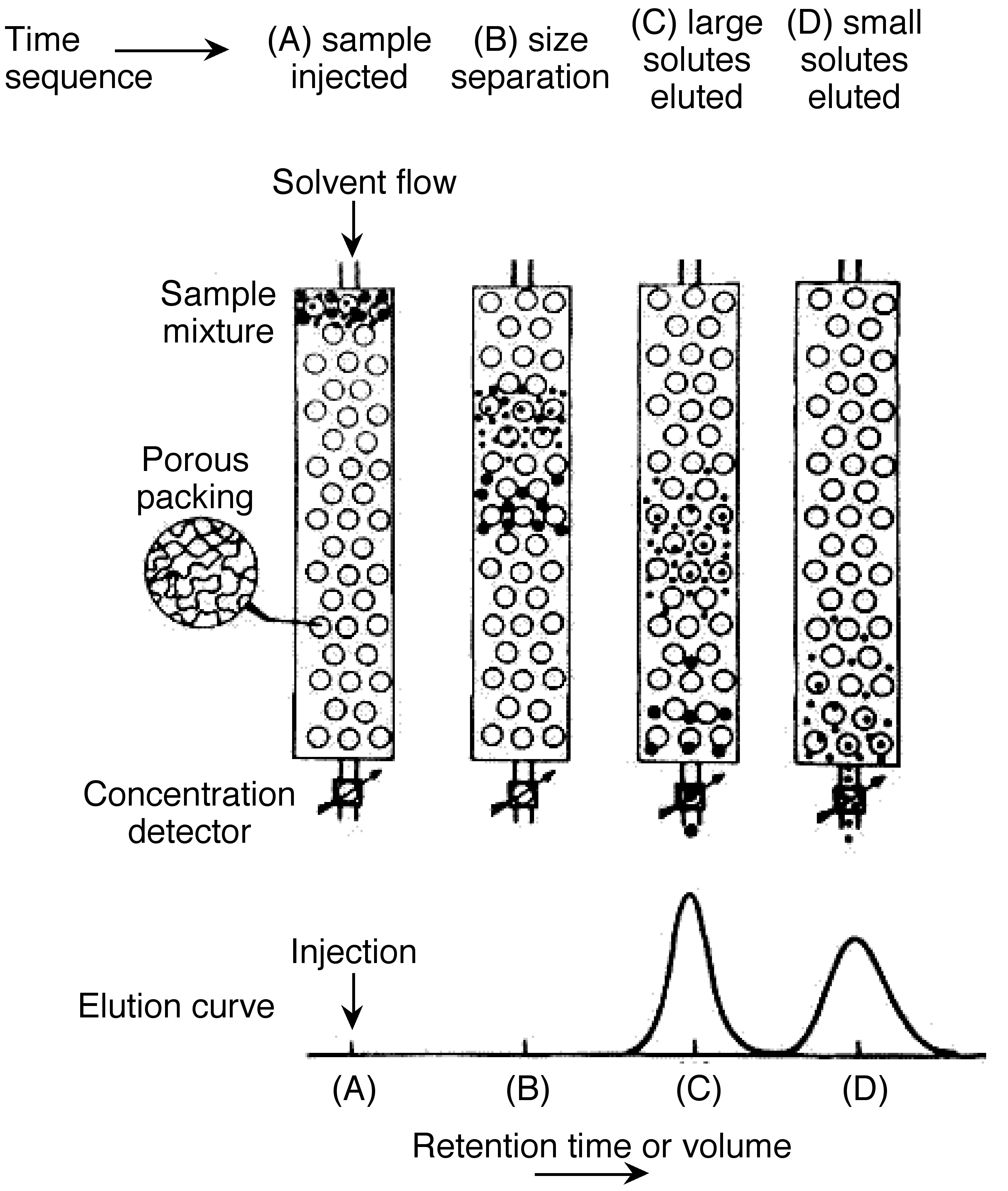
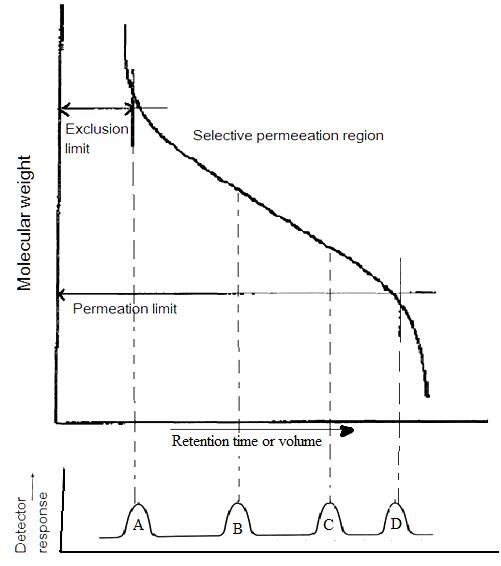
La cromatografía de permeación en gel también se llama cromatografía de exclusión por tamaño. Es un método ampliamente utilizado para determinar la distribución de alto peso molecular. En esta técnica, las sustancias se separan según su tamaño de molécula. En primer lugar, las moléculas grandes comienzan a eluir luego las moléculas más pequeñas se eluyen Figura\(\PageIndex{7}\). La muestra se inyecta en la fase móvil luego la fase móvil entra en las columnas. El tiempo de retención es el tiempo que una fracción en particular permanece en la columna. Como se muestra en la Figura\(\PageIndex{7}\), mientras la fase móvil pasa a través de las partículas porosas, el área entre moléculas grandes y moléculas pequeñas está aumentando. GPC da una distribución molecular completa, pero su costo es alto.
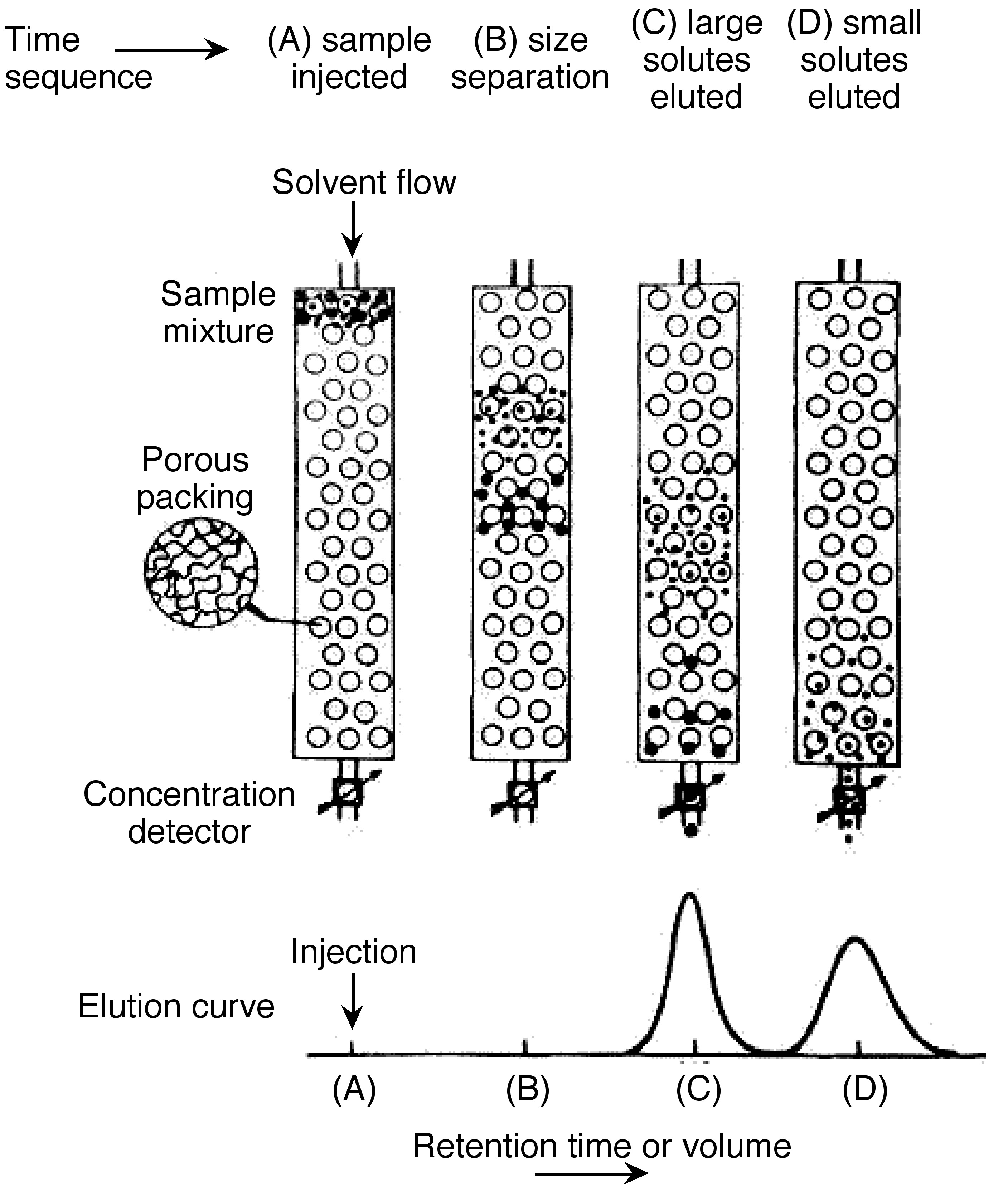
De acuerdo con la teoría básica de GPC, la cantidad básica medida en cromatografía es el volumen de retención,\ ref {11}, donde V 0 es volumen de fase móvil y V p es el volumen de una fase estacionaria. K es un coeficiente de distribución relacionado con el tamaño y los tipos de las moléculas.
\[V_{e} = V_{0} + V_{p} K \label{11} \]
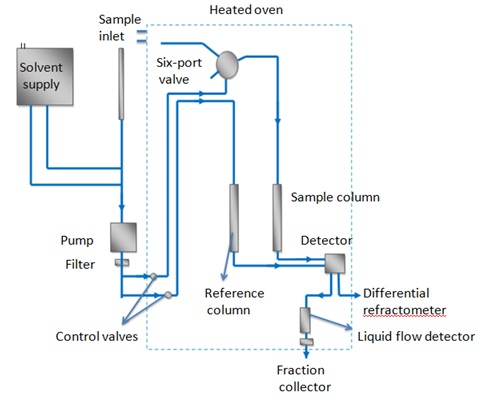
Las características esenciales de la cromatografía de permeación en gel se muestran en la Figura\(\PageIndex{8}\). El solvente sale del suministro de solvente, luego el solvente se bombea a través de un filtro. La cantidad deseada de flujo a través de la columna de muestra se ajusta mediante válvulas de control de muestra y el flujo de referencia se ajusta para que el flujo a través de la referencia y el flujo a través de la columna de muestra lleguen al detector en frente común. La columna de referencia se utiliza para eliminar cualquier impureza leve en el disolvente. Para determinar la cantidad de muestra, se ubica un detector al final de la columna. Además, se pueden usar detectores para verificar continuamente el peso molecular de las especies que eluyen de la columna. El flujo de volumen de disolvente también se monitorea para proporcionar un medio para caracterizar el tamaño molecular de las especies eluyentes.
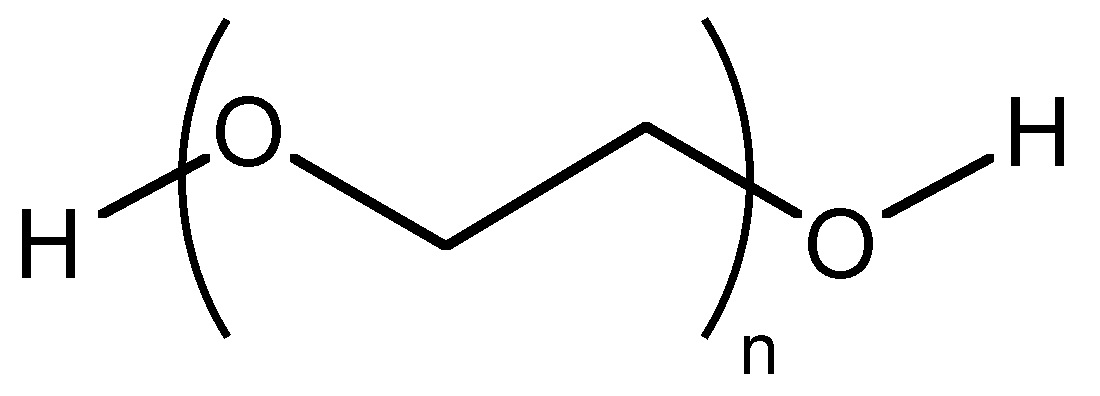
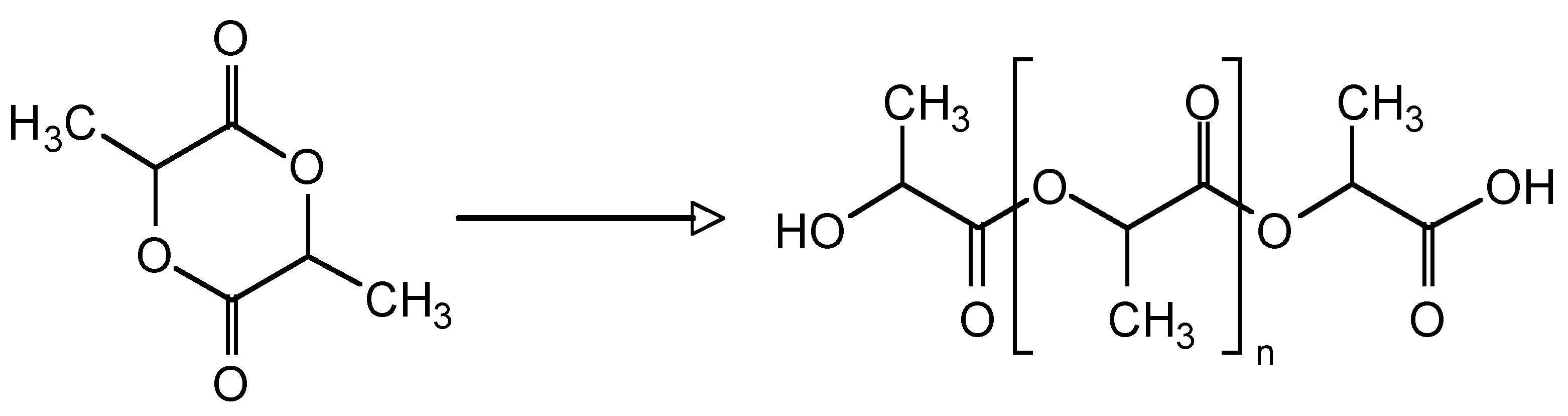
Como ejemplo, considere el copolímero de bloques de etilenglicol (PEG, Figura\(\PageIndex{9}\)) y poli (lactida) (PLA, Figura\(\PageIndex{10}\)), es decir, Figura\(\PageIndex{11}\). En la primera etapa se inicia con una muestra de PEG con un M n de 5,700 g/mol. Después de la polimerización, el peso molecular aumentó debido al progreso de la polimerización de lactida iniciada desde el final de la cadena de PEG. La composición variable de PEG-PLA mostrada en la Tabla\(\PageIndex{3}\) puede ser detectada por GPC (Figura\(\PageIndex{12}\)).
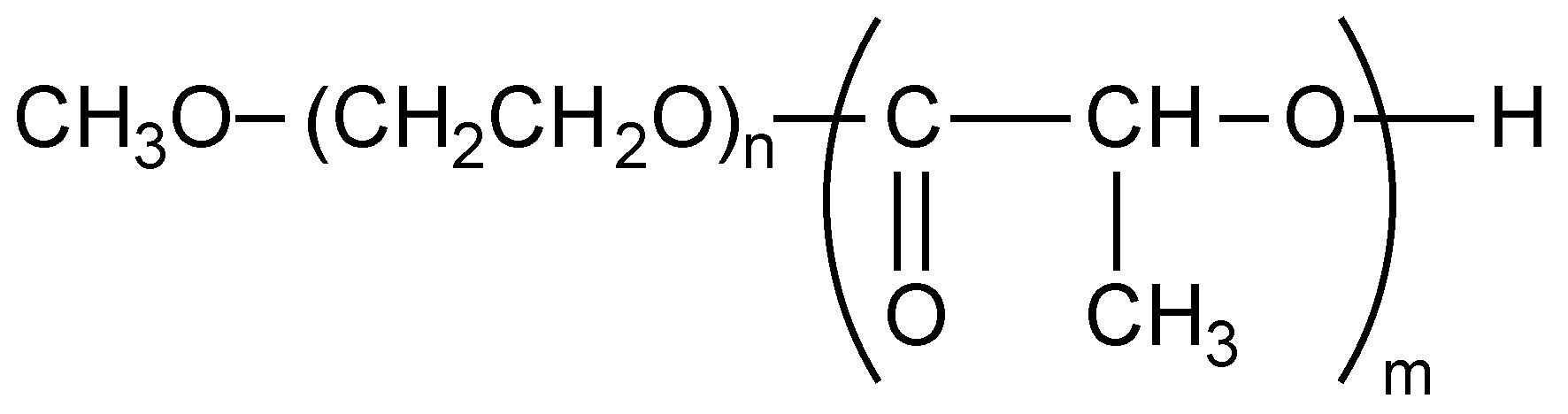
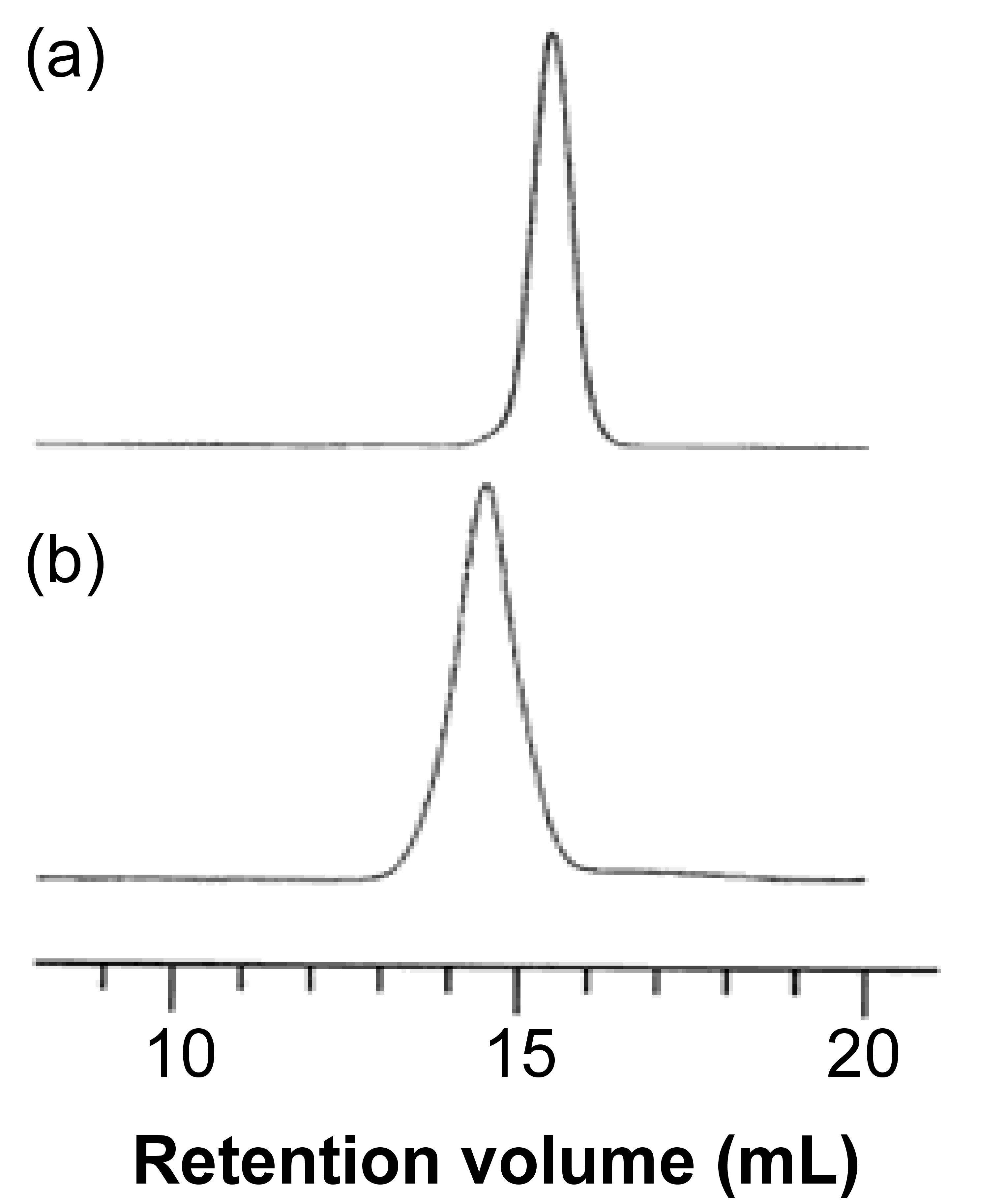
| Polímero | M n de PEG | M w /M n de PEG | M n de PLA | M w /M n de copolímero de bloque | Relación en peso de PLA a PEG |
| PEG-PLA (41-12) | 4100 | 1.05 | 1200 | 1.05 | 0.29 |
| PEG-PLA (60-30) | 6000 | 1.03 | 3000 | 1.08 | 0.50 |
| PEG-PLA (57-54) | 5700 | 1.03 | 5400 | 1.08 | 0.95 |
| PEG-PLA (61-78) | 6100 | 1.03 | 7800 | 1.11 | 1.28 |
Dispersión de luz
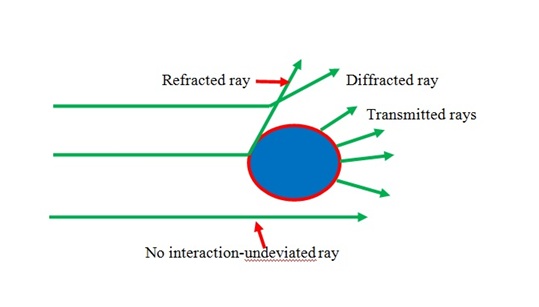
Uno de los métodos más utilizados para caracterizar el peso molecular es el método de dispersión de luz. Cuando se colocan partículas polarizables en el campo eléctrico oscilante de un haz de luz, se produce la dispersión de la luz. El método de dispersión de la luz depende de la luz, cuando la luz está pasando a través de la solución polimérica, se mide por pérdida de energía debido a la absorción, conversión a calor y dispersión. La intensidad de la luz dispersa se basa en la concentración, tamaño y polarizabilidad que es constante de proporcionalidad que depende del peso molecular. La figura\(\PageIndex{13}\) muestra la dispersión de luz de una partícula en solución.
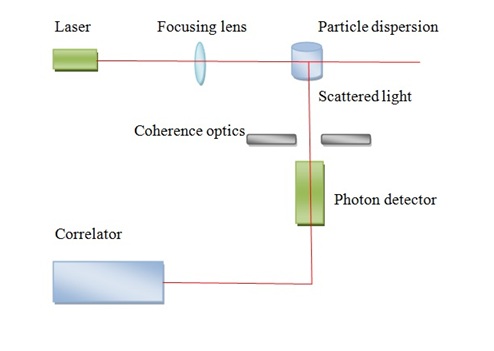
En la Figura se muestra una dispersión de luz láser esquemática\(\PageIndex{14}\). Un problema importante de la dispersión de la luz es preparar soluciones perfectamente claras. Este problema generalmente se logra mediante ultracrifugación. Una solución debe ser lo más clara posible y libre de polvo para determinar el peso molecular absoluto del polímero. Las ventajas de este método, no necesita calibración para obtener peso molecular absoluto y puede dar información sobre la forma y la información de M w. Además, se puede realizar rápidamente con menor cantidad de muestra y se pueden medir determinaciones absolutas del peso molecular. Las debilidades del método es alto precio y la mayoría de las veces requiere difícil aclaración de las soluciones.
El valor del peso molecular promedio en peso de los polímeros dispersantes en solución se relaciona con sus propiedades de dispersión de luz que definen por\ ref {12}, donde K es el vector de onda, el definido por\ ref {13}. C es la concentración de solución, R (θ) es la relación Rayleigh reducida, P (θ) la función de dispersión de partículas, θ es el ángulo de dispersión, A es los coeficientes viriales osmóticos, donde n 0 índice de refracción de disolvente, λ la longitud de onda de la luz y N a número de Avagadro. La función de dispersión de partículas viene dada por\ ref {14}, donde Rz es el radio de giro.
\[ KC / R( \theta )\ = \ 1/M_{W} ( P( \theta) \ +\ 2A_{2}C\ +\ 3A_{3}C_{2}\ +\ ...) \label{12} \]
\[ K\ =\ 2 \pi ^{2}n_{0}^{2}(dn/dC)^{2}/N_{a} \lambda ^{2} \label{13} \]
\[ 1/(P(\theta )) \ =\ 1+16 \pi ^{2} n_{0} ^{2} ( R _{z} ^{2} )sin ^{2} ( \theta /2) 3 \lambda ^{2} \label{14} \]
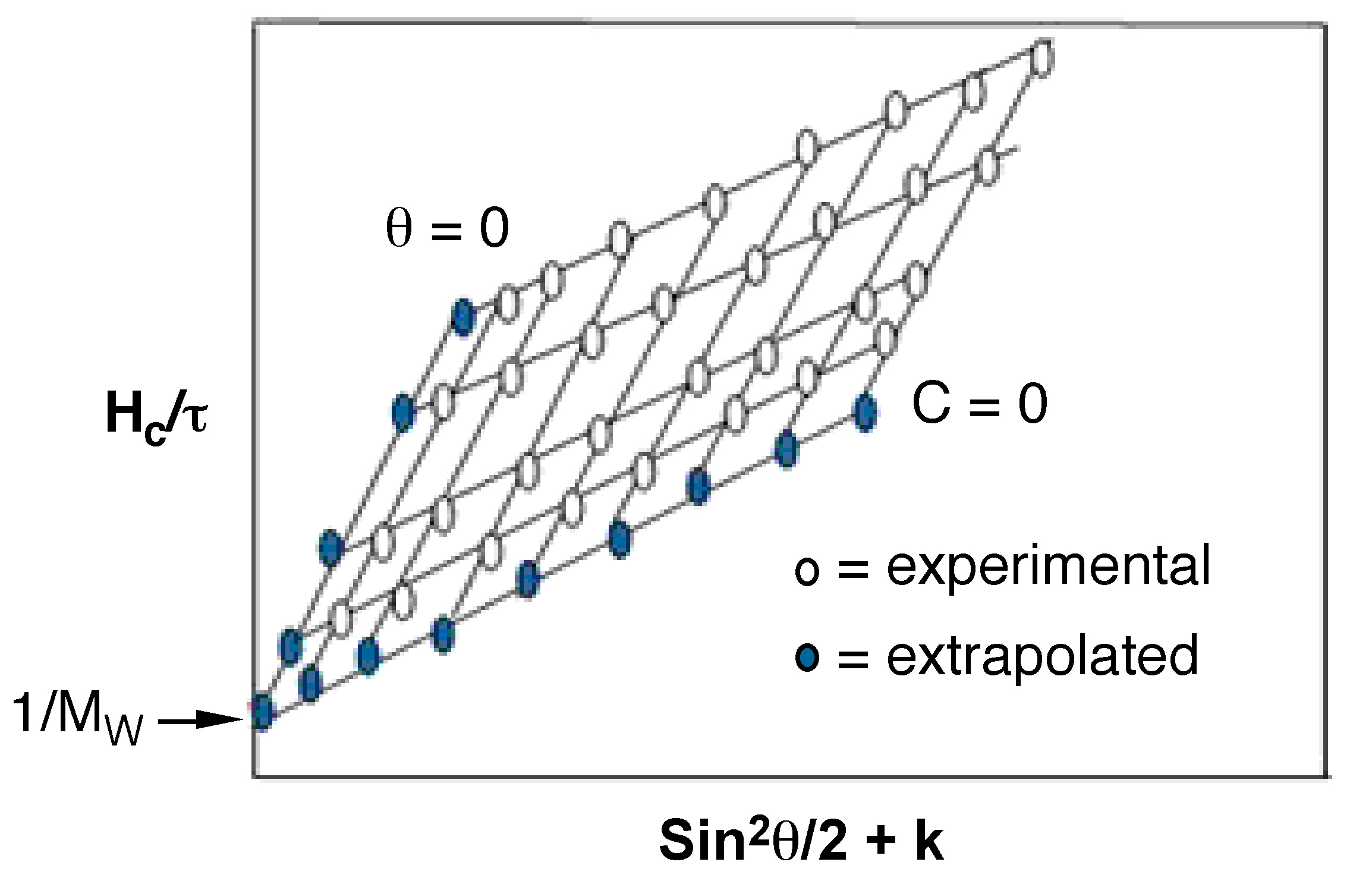
El peso molecular promedio en peso de un polímero se encuentra a partir de la extrapolación de datos en forma de una gráfica Zimm (Figura\(\PageIndex{15}\)). Los experimentos se realizan en varios ángulos y al menos a 4 concentraciones diferentes. Las extrapolaciones en línea recta proporcionan M w.
Dispersión de rayos X
Los rayos X son una forma de onda electromagnética con longitudes de onda entre 0.001 nm y 0.2 nm. La dispersión de rayos X se usa particularmente para polímeros semicristalinos que incluyen termoplásticos, elastómeros termoplásticos y polímeros cristalinos líquidos. Se utilizan dos tipos de dispersión de rayos X para estudios de polímeros:
- Dispersión de rayos X de gran angular (WAXS) que se utiliza para estudiar la orientación de los cristales y el empaquetamiento de las cadenas.
- Dispersión de rayos X de ángulo pequeño (SAXS) que se utiliza para estudiar las fluctuaciones de densidad electrónica que ocurren en distancias mayores como resultado de inhomogeneidades estructurales.
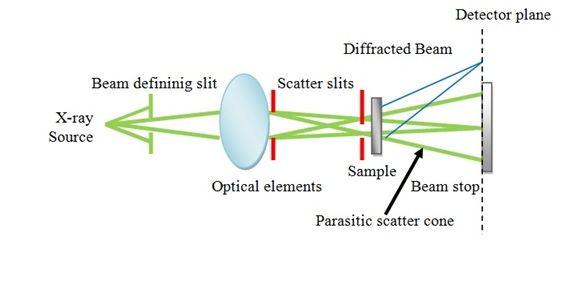
La representación esquemática de la dispersión de rayos X se muestra en la Figura\(\PageIndex{16}\).
Se requieren al menos dos curvas SAXS para determinar el peso molecular de un polímero. El procedimiento SAXS para determinar el peso molecular de la muestra de polímero en solución en estado monomérico o multimérico requiere las siguientes condiciones.
a. El sistema debe estar monodisperso.
b. La solución debe diluirse lo suficiente para evitar efectos de correlación espacial.
c. La solución debe ser isotrópica.
d. El polímero debe ser homogéneo.
Osómetro
La osmometría se aplica para determinar el promedio numérico del peso molecular (M n). Hay dos tipos de osmómetros:
- Osmometría de presión de vapor (VPO).
- Osmometría de membrana.
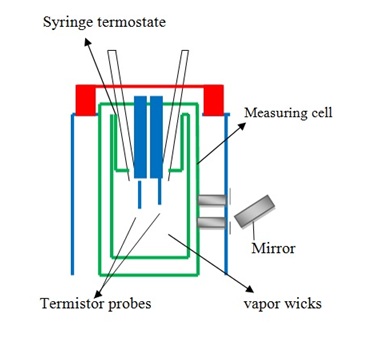
La osmometría de presión de vapor mide la presión de vapor indirectamente al medir el cambio en la temperatura de una solución de polímero al diluir por vapor de disolvente y generalmente es útil para polímeros con M n por debajo de 10,000—40,000 g/mol. Cuando el peso molecular es superior a ese límite, la cantidad que se mide se vuelve muy pequeña de detectar. Una osmometría de vapor típica se muestra en la Figura\(\PageIndex{17}\). La presión de vapor es muy sensible por esta razón se mide indirectamente mediante el uso de termistores para medir los cambios de voltaje causados por los cambios de temperatura.
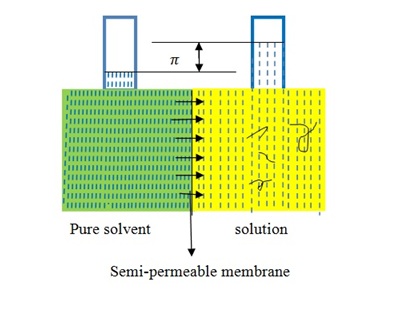
La osmometría de membrana es una técnica absoluta para determinar M n (Figura\(\PageIndex{18}\)). El disolvente se separa de la solución polimérica con una membrana semipermeable que se mantiene fuertemente entre las dos cámaras. Una cámara está sellada por una válvula con un transductor unido a un delgado diafragma de acero inoxidable que permite la medición de la presión en la cámara continuamente. La osmometría de membrana es útil para determinar M n aproximadamente 20,000-30,000 g/mol y menos de 500,000 g/mol. Cuando M n de polímero muestra más de 500,000 g/mol, la presión osmótica de la solución de polímero se vuelve muy pequeña para medir el promedio numérico absoluto del peso molecular. En esta técnica, existen problemas con fugas de membrana y simetría. Las ventajas de esta técnica es que no requiere calibración y da un valor absoluto de M n para muestras de polímero.
Resumen
Las propiedades de los polímeros dependen de su peso molecular. Hay diferentes tipos de peso molecular y cada uno se puede medir por diferentes técnicas. El resumen de estas técnicas y peso molecular se muestra en la Tabla\(\PageIndex{4}\).
| Método | Tipo de Peso Molecular | Rango de aplicación |
| Dispersión de luz | M W | ∞ |
| Osmometría de Membrana | Mn | 10 4 -10 6 |
| Osmometría en Fase Vapor | M n | 40,000 |
| Dispersión de rayos X | M w, n, z | 10 2 |
La cromatografía de exclusión por tamaño y su aplicación en la ciencia de polímeros
La cromatografía de exclusión por tamaño (SEC) es una técnica útil que es específicamente aplicable a especies de alto peso molecular, como el polímero. Es un método para clasificar moléculas de acuerdo a sus tamaños en solución. La solución de muestra se inyecta en la columna, la cual se llena con materiales rígidos, porosos, y es transportada por el disolvente a través de la columna empaquetada. Los tamaños de las moléculas están determinados por el tamaño de poro de la partícula de empaquetamiento en la columna dentro de la cual se produce la separación.
Para los materiales poliméricos, el peso molecular (M w) o el tamaño molecular juega un papel clave en la determinación de las propiedades mecánicas, volumétricas y de solución de los materiales. Se sabe que los tamaños de las moléculas poliméricas dependen de sus pesos moleculares, configuraciones de cadenas laterales, interacción molecular, etc. Por ejemplo, el volumen de exclusión de polímeros con grupo lateral rígido es mayor que aquellos con cadenas laterales largas blandas. Por lo tanto, para determinar el peso molecular y la distribución del peso molecular de un polímero, uno de los métodos más ampliamente aplicados es la cromatografía de permeación en gel.
La cromatografía de permeación en gel (GPC) es un término utilizado para cuando se aplica la técnica de separación por cromatografía de exclusión por tamaño (SEC) a polímeros.
El propósito principal y el uso de la técnica SEC es proporcionar información sobre la distribución del peso molecular sobre un material polimérico en particular. Típicamente, en aproximadamente 30 minutos usando SEC estándar, se puede determinar la distribución completa del peso molecular de un polímero así como toda la información estadística de la distribución. Así, la SEC ha sido considerada como una técnica que suplanta esencialmente a las técnicas clásicas de peso molecular. Para aplicar esta poderosa técnica, hay algún trabajo básico que hay que hacer antes de su uso. La selección de un disolvente apropiado y la columna, así como las condiciones experimentales, son importantes para la separación adecuada de una muestra. Además, es necesario contar con curvas de calibración para determinar el peso molecular relativo a partir de un volumen/tiempo de retención dado.
Es bien sabido que tanto la mayoría de los polímeros naturales como los sintéticos están polidispersos con respecto a la masa molar. Para los polímeros sintéticos, cuanto más monodisperso se pueda hacer un polímero, mejor se obtendrá la comprensión de sus propiedades inherentes.
Propiedades del Polímero
Un polímero es una molécula grande (macromolécula) compuesta por unidades estructurales repetitivas típicamente conectadas por enlaces químicos covalentes. Los polímeros son materiales comunes que son ampliamente utilizados en nuestras vidas. Una de las características más importantes que distingue a la mayoría de los polímeros sintéticos de los compuestos moleculares simples es la incapacidad de asignar una masa molar exacta a un polímero. Esto es consecuencia de que durante la reacción de polimerización la longitud de la cadena formada está determinada por varios eventos diferentes, cada uno de los cuales tiene diferentes velocidades de reacción. De ahí que el producto sea una mezcla de cadenas de diferente longitud debido a la naturaleza aleatoria del crecimiento. Además, algunos polímeros también son ramificados (en lugar de lineales) como consecuencia de etapas de reacción alternativas. El peso molecular (M w) y la distribución del peso molecular influyen en muchas de las propiedades de los polímeros:
- Procesabilidad - la idoneidad del polímero para el procesamiento físico.
- Temperatura de transición vítrea - se refiere a la transformación de un líquido formador de vidrio en un vidrio.
- Viscosidad de la solución - medida de la resistencia de un fluido que está siendo deformado por esfuerzo cortante o esfuerzo de tracción.
- Dureza - una medida de cuán resistente es un polímero a varios tipos de cambio de forma permanente cuando se aplica una fuerza.
- Viscosidad de fusión - la velocidad de extrusión de termoplásticos a través de un orificio a una temperatura y carga prescritas.
- Resistencia al desgarro - una medida de la resistencia de los polímeros al desgarro.
- Resistencia a la tracción - como lo indican los máximos de una curva de tensión-deformación y, en general, es el punto en el que se produce el estrechamiento al estirar una muestra.
- Resistencia al agrietamiento por tensión - la formación de grietas en un polímero causada por un esfuerzo de tracción relativamente bajo y condiciones ambientales.
- Fragilidad - la responsabilidad de un polímero a fracturarse cuando se somete a tensión.
- Resistencia al impacto - la susceptibilidad relativa de los polímeros a la fractura bajo tensiones aplicadas a altas velocidades.
- Vida de flexión: el número de ciclos requeridos para producir una falla especificada en una muestra flexionada de una manera prescrita.
- Relajación del estrés - describe cómo los polímeros alivian el estrés bajo tensión constante.
- Dureza - la resistencia a la fractura de un polímero cuando está estresado.
- Tensión de fluencia - la tendencia de un polímero a moverse lentamente o deformarse permanentemente bajo la influencia de tensiones.
- Estirabilidad - La capacidad de los polímeros formadores de fibras para sufrir varios cientos por ciento de deformación permanente, bajo carga, a temperaturas ambiente o elevadas.
- Compresión - el resultado de la sujeción de un polímero a tensión compresiva.
- Fatiga - el fracaso por estrés repetido.
- Pegajosidad - la propiedad de que un polímero sea adhesivo o gomoso al tacto.
- Desgaste - la erosión del material del polímero por la acción de otra superficie.
- Permeabilidad a los gases - la permeabilidad del gas a través del polímero.
En consecuencia, es importante entender cómo determinar el peso molecular y la distribución del peso molecular.
Peso molecular
Los compuestos puros más simples contienen la misma composición molecular para la misma especie. Por ejemplo, el peso molecular de cualquier muestra de estireno será el mismo (104.16 g/mol). En contraste, la mayoría de los polímeros no están compuestos por moléculas idénticas. El peso molecular de un polímero está determinado por la estructura química de las unidades monoméricas, las longitudes de las cadenas y el grado en que las cadenas están interconectadas para formar moléculas ramificadas. Debido a que prácticamente todos los polímeros son mezclas de muchas moléculas grandes, tenemos que recurrir a promedios para describir el peso molecular del polímero.
Los polímeros producidos en las reacciones de polimerización tienen longitudes que se distribuyen de acuerdo con una función de probabilidad que se rige por la reacción de polimerización. Para definir un promedio en peso de polímero particular, el peso molecular promedio M avg se define por\ ref {15} Donde N i es el número de moléculas con peso molecular M i.
\[ M_{avg} \ =\ \frac{\Sigma N_{i} M_{i}^{a}}{\Sigma N_{i} M_{i} ^{a-1}} \label{15} \]
Existen varias formas posibles de reportar el peso molecular del polímero. Tres descripciones de peso molecular comúnmente utilizadas son: el promedio en número (M n), el promedio en peso (M w) y el peso molecular promedio z (M z). Los tres son aplicables a diferentes constantes a en\ ref {16} y se muestran en la Figura\(\PageIndex{19}\).
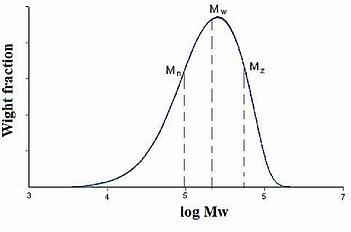
Cuando a = 1, el peso molecular promedio en número,\ ref {16}.
\[ M_{n,\ avg} \ =\ \frac{\Sigma N_{i}M_{i}}{\Sigma N_{i}}\ =\ \frac{w}{N} \label{16} \]
Cuando a = 2, el peso molecular promedio en número,\ ref {17}.
\[ M_{n,\ avg} \ =\ \frac{\Sigma N_{i}M_{i}^{2}}{\Sigma N_{i}M_{i}}\ =\ \frac{\Sigma N_{i}M_{i}}{w} \label{17} \]
Cuando a = 2, el peso molecular promedio en número,\ ref {18}.
\[ M_{n,\ avg} \ =\ \frac{\Sigma N_{i}M_{i}^{3}}{\Sigma N_{i}M_{i}^{2}}\ =\ \frac{\Sigma N_{i}M_{i}^{2}}{\Sigma N_{i}M_{i}} \label{18} \]
Propiedades a granel peso molecular promedio, M w es la más útil, ya que da cuenta de manera justa las contribuciones de cadenas de diferentes tamaños al comportamiento general del polímero, y se correlaciona mejor con la mayoría de las propiedades físicas de interés.
Existen diversos métodos publicados para detectar estos tres pesos moleculares promedio primarios diferentes, respectivamente. Por ejemplo, un método coligativo, como la presión osmótica, calcula efectivamente el número de moléculas presentes y proporciona un peso molecular promedio numérico independientemente de su forma o tamaño de polímeros. La ecuación clásica de van't Hoff para la presión osmótica de una solución diluida ideal se muestra en\ ref {19}.
\[ \frac{\pi }{c}\ =\ \frac{RT}{M_{n}} \label{19} \]
El peso molecular promedio en peso de un polímero en solución puede determinarse ya sea midiendo la intensidad de la luz dispersada por la solución o estudiando la sedimentación del soluto en una ultracentrífuga. A partir del método de dispersión de luz que depende del tamaño más que del número de moléculas, se obtiene el peso molecular promedio en peso. Este trabajo requiere fluctuaciones de concentración que son la fuente principal de la luz dispersada por una solución polimérica. La intensidad de la dispersión de luz de la solución polimérica se expresa a menudo por su turbidez τ que se da en la ley de Rayleigh en\ ref {20}. Donde i θ es la intensidad dispersada en un solo ángulo θ, r es la distancia desde la partícula de dispersión hasta el punto de detección, y I 0 es la intensidad incidente.
\[ \tau\ =\ \frac{16\pi i_{\Theta} r^{2}}{3I_{0}(1+cos^{2}\Theta )} \label{20} \]
La intensidad dispersada por moléculas (N i) de peso molecular (M i) es proporcional a N i M i 2. Así, la luz total dispersada por todas las moléculas se describe en\ ref {21}, donde c es el peso total de la muestra N i M i.
\[ \frac{\pi}{c} ~ \frac{\Sigma N_{i}M_{i}^{2}}{\Sigma N_{i}M_{i}}\ =\ M_{W,\ avg} \label{21} \]
Índice polidisperso (PDI)
El índice de polidispersidad (PDI), es una medida de la distribución de la masa molecular en una muestra de polímero dada. Como se muestra en la Figura\(\PageIndex{19}\), es el resultado de las definiciones que M w ≥ M n. La igualdad de M w y M n correspondería con una muestra perfectamente uniforme (monodispersa). La relación de estos pesos moleculares promedio se usa a menudo como guía para la dispersidad de las longitudes de cadena en una muestra de polímero. Cuanto mayor es M w/M n, mayor es la dispersidad.
Las propiedades de una muestra de polímero dependen fuertemente de la forma en que los pesos de las moléculas individuales se distribuyen alrededor del promedio. La relación M w /M n da información suficiente para caracterizar la distribución cuando se conoce la forma matemática de la curva de distribución.
Generalmente, los materiales de distribución estrecha del peso molecular son los modelos para gran parte del trabajo dirigido a comprender los comportamientos de los materiales. Por ejemplo, el poliestireno y su copolímero de bloques poliestireno-b-poliisopreno tienen una distribución bastante estrecha. Como resultado, los materiales de distribución de peso molecular estrecha son un requisito necesario cuando las personas estudian su comportamiento, como el comportamiento de autoensamblaje para copolímeros de bloques. Sin embargo, todavía hay muchas preguntas para que los científicos exploren la influencia de la polidispersidad. Por ejemplo, la investigación sobre el autoensamblaje, que es uno de los campos interesantes en la ciencia de los polímeros, muestra que no podemos desechar la polidispersidad.
Configuración de equipos SEC
En SEC, los componentes de la muestra migran a través de la columna a diferentes velocidades y eluyen por separado de la columna en diferentes momentos. En cromatografía líquida y cromatografía de gases, a medida que un soluto se mueve junto con el fluido portador, a veces es retenido ya sea por la superficie del relleno de la columna, por fase estacionaria, o por ambos. A diferencia de la cromatografía de gases (GC) y la cromatografía líquida (LC), el tamaño molecular, o más precisamente, el volumen hidrodinámico molecular gobierna el proceso de separación de la SEC, no variado según el tipo de fase móvil. Las moléculas más pequeñas son capaces de penetrar profundamente en los poros, mientras que las moléculas más grandes están excluidas por los tamaños de poro más pequeños. La figura\(\PageIndex{20}\) muestra la configuración instrumental regular de la SEC.

Las propiedades de la fase móvil siguen siendo importantes ya que se supone que es una fuerte afinidad a la fase estacionaria y una buena solubilidad a las muestras. El propósito del bien soluble de la muestra es hacer que el polímero sea perfecto suspendiendo en la bobina en solución. Así, como mezcla de solutos de diferente tamaño pasa a través de una columna empaquetada con partículas porosas. Como se muestra en la Figura\(\PageIndex{21}\), representa claramente la idea general de separación por tamaño por SEC. la configuración principal de SEC enfatiza tres conceptos: fase estacionaria (columna), fase móvil (solvente) y preparación de muestras.
Selección de Solvente
La selección de solventes para SEC implica un número si consideraciones, tales como conveniencia, tipo de muestra, empaque de columna, variables de operación, seguridad y pureza.
Para la preocupación de las muestras, los disolventes utilizados para la fase móvil de SEC se limitan a los siguientes criterios:
- El disolvente debe disolver la muestra por completo.
- El solvente tiene diferentes propiedades con soluto en el eluyente: típicamente con índice de refracción del solvente (RI) diferente de la muestra RI en ± 0.05 unidad de más, o más de 10% de energía incidente para detector UV.
- El disolvente no debe degradar la muestra durante el uso. De lo contrario, la viscosidad del eluyente aumentará gradualmente con el paso del tiempo.
- El solvente no es corrosivo para ningún componente del equipo.
Por lo tanto, varios disolventes están calificados para ser disolventes como THF, hidrocarburos clorados (cloroformo, cloruro de metileno, dicloroetano, etc), hidrocarburos aromáticos (benceno, tolueno, triclorobenceno, etc.).
Normalmente, se recomienda alta pureza de solvente (grado HPLC). Las razones son evitar partículas suspendidas que puedan erosionar el sistema de bombeo de solvente o causar taponamiento de columnas de partículas pequeñas, para evitar impurezas que puedan generar ruido de base, y evitar impurezas que se concentran debido a la evaporación del solvente.
Selección de Columna
La selección en columna de SEC depende principalmente del rango de peso molecular deseado de separación y la naturaleza de los solventes y muestras. Las moléculas de soluto deben separarse únicamente por el tamaño de los geles sin interacción de los materiales de empaque. Se pueden obtener mejores eficiencias de columna y separaciones con empaquetamiento de partículas pequeñas en columnas y altas velocidades de difusión para solutos de muestra. Además, el rendimiento óptimo de un material de empaque SEC implica alta resolución y baja contrapresión de columna. Se debe elegir disolvente y columna compatibles porque, por ejemplo, se usa disolvente orgánico para hinchar el relleno orgánico de la columna y se usa para disolver y separar las muestras.
Es conveniente que ahora las columnas estén generalmente disponibles de los fabricantes con respecto a los diversos tipos de muestras. Proporcionan la información como caudales máximos tolerantes, tolerancias de contrapresión, concentración de muestra recomendada y volúmenes de inyección, etc. Sin embargo, los usuarios deben notar algunas cosas al usar columnas:
- Deben evitarse las vibraciones y las temperaturas extremas, ya que éstas producirán daños irreversibles en las columnas.
- Para la fase móvil acuosa, es imprudente permitir que las soluciones de pH extremo permanezcan en las columnas durante un largo periodo de tiempo.
- Las columnas deben almacenarse con alguna fase móvil orgánica pura, o fase móvil acuosa con rango de pH 2 - 8 para evitar la degradación del empaque cuando no esté en uso.
Preparación de muestras
Se supone que las soluciones de muestra se preparan en concentración diluida (menos de 2 mg/mL) para varias preocupaciones. Para las muestras de polímeros, las muestras deben disolverse en el disolvente mismo que se usa para la fase móvil excepto algunos casos especiales. Un buen disolvente puede disolver una muestra en cualquier proporción en un rango de temperaturas. Es un proceso lento de disolución debido a que la etapa de determinación de la velocidad es la difusión del disolvente en polímeros para producir geles hinchados. Luego, la desintegración gradual de los geles hace que la mezcla muestra-disolvente se convierta realmente en solución. La agitación y calentamiento de las mezclas son métodos útiles para acelerar la preparación de la muestra.
Se recomienda filtrar las soluciones de muestra antes de inyectarlas en columnas o guardarlas en viales de muestra para eliminar las obstrucciones y los problemas de presión excesivamente alta. Si desafortunadamente la presión excesivamente alta o la obstrucción ocurren debido a una mayor concentración de solución de muestra, elevar la temperatura de la columna reducirá la viscosidad de la fase móvil, y puede ser útil para redisolver los solutos precipitados o adsorbidos en la columna. El lavado posterior de las columnas solo debe usarse como último recurso.
Análisis de datos SEC
El mecanismo de separación por exclusión por tamaño se basa en el volumen hidrodinámico efectivo de la molécula, no en el peso molecular, por lo que el sistema debe calibrarse utilizando estándares de peso molecular conocido y composición química homogénea. Luego, se utiliza la curva de muestra para comparar con la curva de calibración y obtener información relativa a los estándares. La etapa adicional se requiere para encubrir el peso molecular relativo en el peso molecular absoluto de un polímero.
Calibración
El propósito de la calibración en SEC es definir la relación entre el peso molecular y el volumen/tiempo de retención en el rango de permeación elegido del conjunto de columnas y calcular el peso molecular relativo a las moléculas estándar. Hay varios métodos de calibración que se emplean comúnmente en la SEC moderna: calibración estándar directa, calibración estándar poli-dispersa, calibración universal.
El método de calibración más utilizado es la calibración estándar directa. En el método de calibración estándar directa, se utilizan estándares de distribución estrecha del mismo polímero que se analiza. Normalmente, los estándares de peso molecular estrecho disponibles comercialmente son poliestireno (PS). El peso molecular de los patrones se mide originalmente por osmometría de membrana para el peso molecular promedio en número, y por dispersión de luz para el peso molecular promedio en peso como se describió anteriormente. El volumen de retención en el pico máximo de cada patrón se equipara con su peso molecular establecido.
Mw relativo frente a M w absoluto
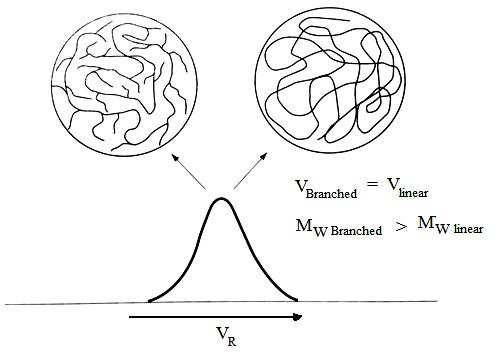
El peso molecular y la distribución del peso molecular se pueden determinar a partir de las curvas de calibración como se describió anteriormente. Pero como la relación entre el peso molecular y el tamaño depende del tipo de polímero, la curva de calibración depende del polímero utilizado, con el resultado de que el peso molecular verdadero solo se puede obtener cuando la muestra es del mismo tipo que los estándares de calibración. Como\(\PageIndex{23}\) se representa en la Figura, grandes desviaciones del peso molecular verdadero ocurren en el caso de muestras ramificadas debido a que la densidad molecular de estas es mayor que en las cadenas lineales.
El detector de dispersión de luz se usa ahora a menudo para superar las limitaciones de la SEC convencional. Estas señales dependen únicamente de la concentración, no del peso molecular ni del tamaño del polímero. Por ejemplo, para el detector LS, se aplica\ ref {22}:
\[LS\ Signal\ =\ K_{LS} \cdot (dn/dc)^{2}\cdot M_{W} \cdot c \label{22} \]
Donde K LS es una constante de sensibilidad específica del aparato, dn/dc es el incremento del índice de refracción y c es la concentración. Por lo tanto, se puede determinar el peso molecular preciso mientras se conoce la concentración de la muestra sin curva de calibración.
Un ejemplo práctico
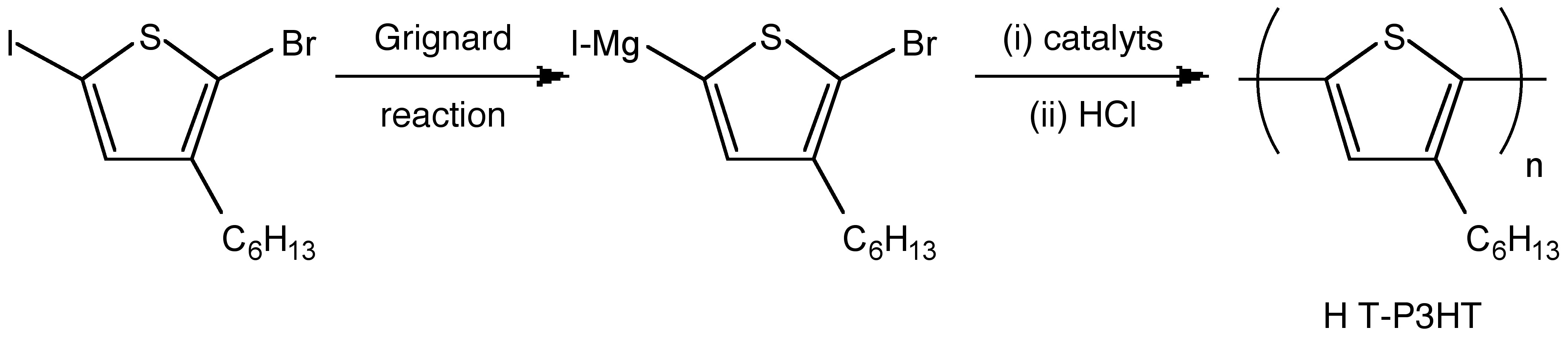
Las síntesis de poli (3-hexiltiofeno) están bien desarrolladas durante la última década. Es un polímero atractivo debido a su potencial como materiales electrónicos. Debido a sus excelentes rendimientos de transporte de carga y alta solubilidad, varios estudios discuten su mejora adicional, como hacer que el copolímero de bloque sea incluso copolímero tribloque. Los detalles no se discuten aquí. Sin embargo, la importancia del peso molecular y la distribución del peso molecular sigue siendo crítica.
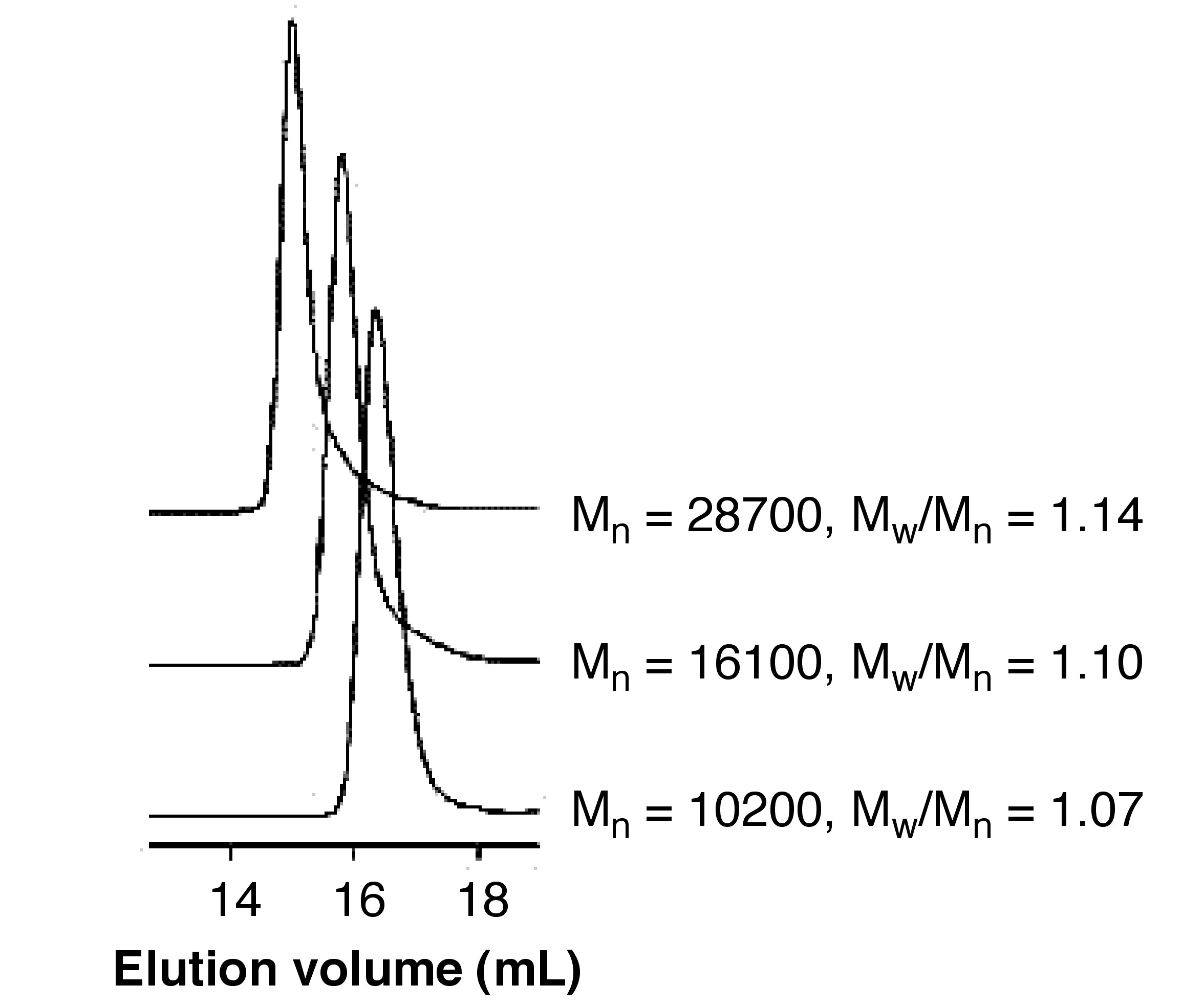
Como se muestra en la Figura\(\PageIndex{24}\), estudiaron el mecanismo de polimerización de crecimiento en cadena y produjeron exitosamente P3HT de baja polidispersidad. La figura también demuestra que la molécula con mayor tamaño/peso molecular eluye de la columna antes que aquellas que tienen menor peso molecular.
El peso molecular real de P3HT es menor que el peso molecular relativo al poliestireno. En este caso, la cadena principal de P3HT es más dura en comparación con la cadena principal de los poliestirenos debido a la posición de los grupos aromáticos. Se traduce en una menor flexibilidad. Podemos juzgar brevemente el peso molecular auténtico del polímero sintético de acuerdo con su estructura molecular.