3.2: Cromatografía líquida de alto rendimiento
- Page ID
- 71207
La cromatografía líquida de alta resolución (HPLC) es una técnica en química analítica utilizada para separar los componentes en una mezcla, e identificar y cuantificar cada componente. Inicialmente se descubrió como una técnica analítica a principios del siglo XX y se utilizó por primera vez para separar compuestos coloreados. La palabra cromatografía significa escritura en color. Fue el botánico M. S. Tswett (Figura\(\PageIndex{1}\)) quien inventó este método alrededor de 1900 para estudiar los pigmentos foliares (principalmente clorofila). Separó los pigmentos en función de su interacción con una fase estacionaria. En 1906 Tswett publicó dos artículos fundamentales que describen en detalle los diversos aspectos de la cromatografía de adsorción de líquidos. También señaló que a pesar de su nombre, otras sustancias también podrían separarse por cromatografía. La moderna cromatografía líquida de alto rendimiento se ha desarrollado a partir de esta separación; la eficiencia de separación, versatilidad y velocidad se han mejorado significativamente.

Las especies moleculares sometidas a separación existen en una muestra que está hecha de analitos y matriz. Los analitos son las especies moleculares de interés, y la matriz es el resto de los componentes de la muestra. Para la separación cromatográfica, la muestra se introduce en una fase móvil fluida que pasa por una fase estacionaria. La fase móvil es un líquido móvil, y se caracteriza por su composición, solubilidad, transparencia UV, viscosidad y miscibilidad con otros solventes. La fase estacionaria es un medio estacionario, que puede ser un líquido a granel estancado, una capa líquida sobre la fase sólida o una capa interfacial entre líquido y sólido. En HPLC, la fase estacionaria está típicamente en forma de una columna empaquetada con partículas porosas muy pequeñas y la fase móvil líquida se mueve a través de la columna mediante una bomba. El desarrollo de HPLC es principalmente el desarrollo de las nuevas columnas, lo que requiere nuevas partículas, nuevas fases estacionarias (recubrimientos de partículas) y procedimientos mejorados para empaquetar la columna. Una imagen de la HPLC moderna se muestra en la Figura\(\PageIndex{2}\).

Instrumentación
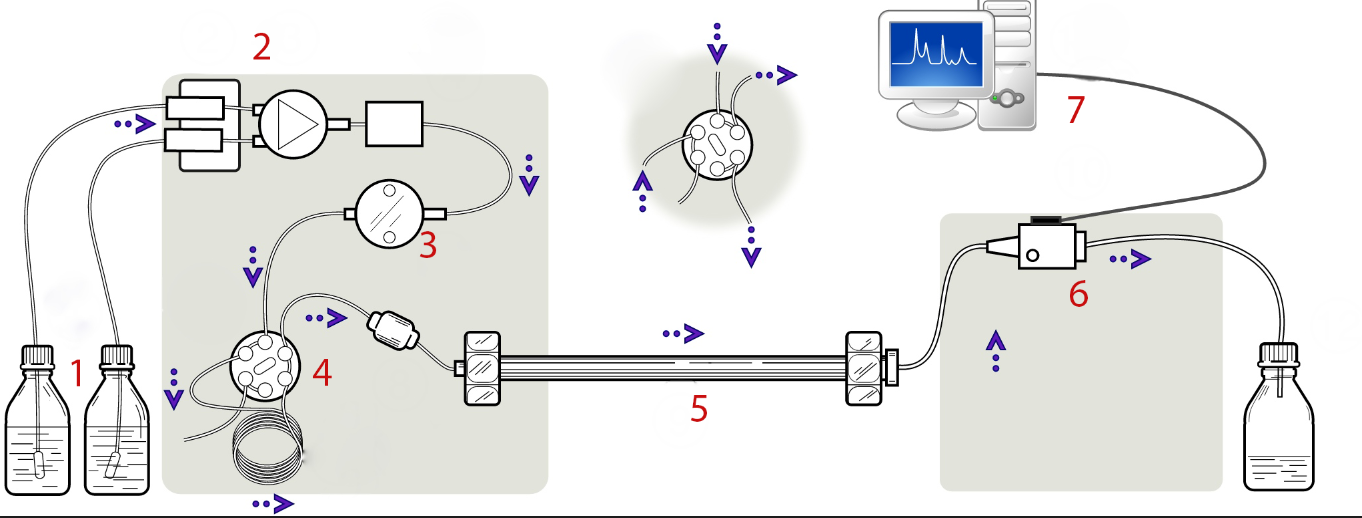
Los componentes principales de una HPLC se muestran en la Figura\(\PageIndex{3}\). El papel de una bomba es forzar un líquido (fase móvil) a un caudal específico (mililitros por minuto). El inyector sirve para introducir la muestra líquida en la corriente de flujo de la fase móvil. La columna es el componente más central e importante de la HPLC, y la fase estacionaria de la columna separa los componentes de la muestra de interés usando varios parámetros físicos y químicos. El detector es para detectar las moléculas individuales que eluyen de la columna. La computadora generalmente funciona como el sistema de datos, y la computadora no solo controla todos los módulos del instrumento HPLC sino que toma la señal del detector y la usa para determinar el tiempo de retención, los componentes de la muestra y el análisis cuantitativo.
Columnas
Se utilizaron diferentes mecanismos de separación basados en diferentes propiedades de la fase estacionaria de la columna. Los principales tipos incluyen cromatografía de fase normal, cromatografía de fase inversa, intercambio iónico, cromatografía de exclusión por tamaño y cromatografía de afinidad.
Cromatografía de fase normal
En este método las columnas se empaquetan con partículas polares, inorgánicas y se utiliza una fase móvil no polar para pasar por la fase estacionaria (Tabla\(\PageIndex{1}\)). La cromatografía de fase normal se utiliza principalmente para la purificación de muestras brutas, separación de muestras muy polares o separaciones analíticas por cromatografía en capa fina. Un problema al usar este método es que, el agua es un disolvente fuerte para la cromatografía de fase normal, las trazas de agua en la fase móvil pueden afectar notablemente la retención de la muestra, y después de cambiar la fase móvil, el equilibrio de la columna es muy lento.
| Fase Estacionaria | Fase Móvil | |
|---|---|---|
| Fase Normal | Polar | No polar |
| Fase Reversa | No polar | Polar |
Cromatografía de fase inversa
En la cromatografía de fase inversa (RP) la fase estacionaria tiene un carácter hidrófobo, mientras que la fase móvil tiene un carácter polar. Esta es la inversa de la cromatografía de fase normal (Tabla\(\PageIndex{2}\)). Las interacciones en RP-HPLC se consideran las fuerzas hidrofóbicas, y estas fuerzas son causadas por las energías resultantes de la alteración de la estructura dipolar del disolvente. La separación se basa típicamente en la partición del analito entre la fase estacionaria y la fase móvil. Las moléculas de soluto están en equilibrio entre la fase estacionaria hidrófoba y la fase móvil parcialmente polar. La molécula más hidrófoba tiene un tiempo de retención más largo, mientras que los compuestos orgánicos ionizados, los iones inorgánicos y las moléculas metálicas polares muestran poco o ningún tiempo de retención.
Cromatografía de intercambio iónico
El mecanismo de intercambio iónico se basa en interacciones electrostáticas entre iones hidratados de una muestra y grupos funcionales con carga opuesta en la fase estacionaria. Se utilizan dos tipos de mecanismos para la separación: en un mecanismo, la elución utiliza una fase móvil que contiene iones competidores que reemplazarían a los iones analito y los empujarían fuera de la columna; otro mecanismo es agregar un reactivo complejante en la fase móvil y cambiar las especies de muestra de su forma inicial. Esta modificación en las moléculas las conducirá a la elución. Además del intercambio de iones, las fases estacionarias de intercambio iónico son capaces de retener moléculas neutras específicas. Este proceso está relacionado con la retención basada en la formación de complejos, y iones específicos como los metales de transición pueden retenerse en una resina de intercambio catiónico y aún pueden aceptar electrones de pares solidos de ligandos donantes. Por lo tanto, las moléculas de ligando neutro pueden retenerse en resinas tratadas con los iones metálicos de transición.
El intercambio iónico moderno es capaz de aplicaciones cuantitativas a concentraciones de soluto bastante bajas, y puede ser utilizado en el análisis de muestras acuosas para aniones inorgánicos comunes (rango de 10 μg/L a 10 mg/L). Los cationes metálicos y aniones inorgánicos están todos separados predominantemente por interacciones iónicas con la resina de intercambio iónico. Uno de los mayores usuarios industriales de intercambio iónico es el sector de alimentos y bebidas para determinar las especies que contienen nitrógeno, azufre y fósforo, así como los iones haluro. También, el intercambio iónico puede ser utilizado para determinar los iones inorgánicos y orgánicos disueltos en aguas naturales y tratadas.
Cromatografía de Exclusión
Se trata de un método cromatográfico que separa las moléculas en las soluciones en función del tamaño (volumen hidrodinámico). Esta columna se utiliza a menudo para la separación de macromoléculas y de macromoléculas de moléculas pequeñas. Después de inyectar el analito en la columna, moléculas menores que el tamaño de poro de la fase estacionaria ingresan a las partículas porosas durante la separación y fluyen a través de los intrincados canales de la fase estacionaria. Así, los componentes más pequeños tienen una trayectoria más larga para atravesar y eluir de la columna más tarde que los más grandes. Dado que el volumen molecular está relacionado con el peso molecular, se espera que el volumen de retención dependa en cierta medida del peso molecular de los materiales poliméricos. La relación entre el tiempo de retención y el peso molecular se muestra en la Figura\(\PageIndex{4}\).
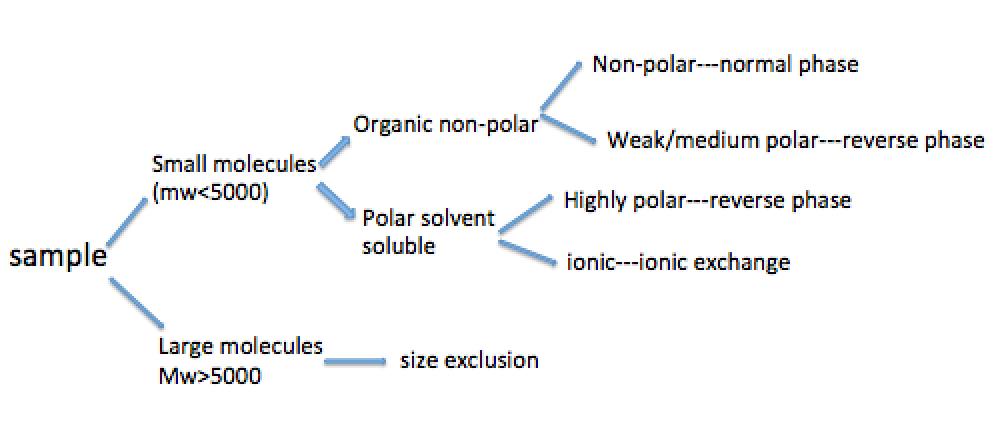
Por lo general, el tipo de método de separación por HPLC a utilizar depende de la naturaleza química y los parámetros fisicoquímicos de las muestras. La figura\(\PageIndex{5}\) muestra un diagrama de flujo de selección preliminar para el método de separación según las propiedades del analito.
Detectores
Los detectores que se usan comúnmente para la cromatografía líquida incluyen detectores de absorbancia ultravioleta-visible, detectores de índice de refracción, detectores de fluorescencia y espectrometría de masas. Independientemente de la clase, un detector LC idealmente debería tener las características de aproximadamente 10 -12 -10 -11 g/mL, y un rango dinámico lineal de cinco o seis órdenes. Las principales características de los detectores a evaluar incluyen rango dinámico, índice de respuesta o linealidad, rango dinámico lineal, respuesta del detector, sensibilidad del detector, etc.
Entre estos detectores, los métodos más económicos y populares son los detectores UV e índice de refracción (RI). Tienen límites de detección razonables de selectividad bastante amplios la mayor parte del tiempo. El detector RI fue el primer detector disponible para uso comercial. Este método es particularmente útil en la separación por HPLC según el tamaño, y la medición es directamente proporcional a la concentración de polímero y prácticamente independiente del peso molecular. La sensibilidad de RI es de 10 -6 g/mL, el rango dinámico lineal es de 10 -6 a 10 -4 g/mL, y el índice de respuesta está entre 0.97 y 1.03.
Los detectores UV responden solo a aquellas sustancias que absorben la luz UV a la longitud de onda de la luz de origen. Muchos compuestos absorben luz en el rango UV (180-350 nm) incluyendo sustancias que tienen uno o más dobles enlaces y sustancias que tienen electrones no compartidos. y la relación entre la intensidad de la luz UV transmitida a través de la célula y la concentración de soluto viene dada por la ley de Beer,\ ref {1} y\ ref {2}.
\[ I_{T} \ =\ I_{0} e^{kcl} \label{1} \]
\[ ln(I_{T})\ =\ ln(I_{0}) (-kcl) \label{2} \]
Donde I 0 es la intensidad de la luz que ingresa a la célula, e I T es la luz transmitida a través de la célula, l es la longitud de trayectoria de la célula, c es la concentración del soluto, y k es el coeficiente de absorción molar del soluto. Los detectores UV incluyen detector UV de longitud de onda fija y detector UV de longitud de onda múltiple El detector UV de longitud de onda fija tiene una sensibilidad de 5*10 -8 g/mL, tiene un rango dinámico lineal entre 5*10 -8 y 5* 10-4 g/mL, y el índice de respuesta está entre 0.98 y 1.02. El detector UV multi-longitud de onda tiene una sensibilidad de 10 -7 g/mL, el rango dinámico lineal está entre 5*10 -7 y 5*10 -4 g/mL, y el índice de respuesta es de 0.97 a 1.03. Los detectores UV podrían usarse eficazmente para las separaciones de fase inversa y la cromatografía de intercambio iónico. Los detectores UV tienen alta sensibilidad, son económicamente asequibles y fáciles de operar. Por lo tanto, el detector UV es la elección más común de detector para HPLC.
Otro método, la espectrometría de masas, tiene ciertas ventajas sobre otras técnicas. Los espectros de masas podrían obtenerse rápidamente; solo se requiere una pequeña cantidad (sub-μg) de muestra para el análisis, y los datos proporcionados por los espectros son muy informativos de la estructura molecular. La espectrometría de masas también tiene fuertes ventajas de especificidad y sensibilidad en comparación con otros detectores. La combinación de HPLC-MS se orienta hacia la detección específica y la identificación potencial de sustancias químicas en presencia de otros químicos. Sin embargo, es difícil interconectar la cromatografía líquida con un espectrómetro de masas, ya que todos los solventes necesitan ser eliminados primero. La interfaz de uso común incluye la ionización por electropulverización, la fotoionización a presión atmosférica y la ionización por termopulverización.
Parámetros relacionados con la separación por HPLC
Caudal
El caudal muestra qué tan rápido viaja la fase móvil a través de la columna, y a menudo se usa para calcular el consumo de la fase móvil en un intervalo de tiempo dado. Hay caudal volumétrico U y caudal lineal u. Estos dos caudales están relacionados por\ ref {3}, donde A es el área del canal para el flujo,\ ref {4}.
\[ U = Au \label{3} \]
\[ A\ =\ (1/4) \pi \varepsilon d^{2} \label{4} \]
Tiempo de Retención
El tiempo de retención (t R) puede definirse como el tiempo desde la inyección de la muestra hasta el tiempo de elución del compuesto, y se toma en el ápice del pico que pertenece a la especie molecular específica. El tiempo de retención se decide por varios factores incluyendo la estructura de la molécula específica, el caudal de la fase móvil, la dimensión de la columna. Y el tiempo muerto t 0 se define como el tiempo para que una especie molecular no retenida eluya de la columna.
Volumen de Retención
El volumen de retención (V R) se define como el volumen de la fase móvil que fluye desde el tiempo de inyección hasta el tiempo de retención correspondiente de una especie molecular, y están relacionados por\ ref {5}. El volumen de retención relacionado con el tiempo muerto se conoce como volumen muerto V 0.
\[ V_{R} \ =\ U_{tR} \label{5} \]
Tasa de migración
La tasa de migración se puede definir como la velocidad a la que la especie se mueve a través de la columna. Y la tasa de migración (U R) es inversamente proporcional a los tiempos de retención. Si sólo se están moviendo una fracción de las moléculas que están presentes en la fase móvil. El valor de la tasa de migración viene dado entonces por\ ref {6}.
\[ u_{R} \ =\ u*V_{mo}/(V_{mo}+V_{st}) \label{6} \]
Factor de Capacidad
El factor de capacidad (k) es la relación entre el tiempo de retención reducido y el tiempo muerto,\ ref {7}.
\[ K \ =\ (t_{R} - t_{0})/t_{0} \ =\ (v_{R} - v_{0})/v_{0} \label{7} \]
Constante de Equilibrio y Relación de Fase
En la separación, las moléculas que corren a través de la columna también pueden considerarse como que están en un equilibrio continuo entre la fase móvil y la fase estacionaria. Este equilibrio podría regirse por una constante de equilibrio K, definida como\ ref {8}, en la que C mo es la concentración molar de las moléculas en la fase móvil, y C st es la concentración molar de las moléculas en la fase estacionaria. La constante de equilibrio K también se puede escribir como\ ref {9}.
\[ K\ =\ C_{st}/C_{mo} \label{8} \]
\[ K\ =\ k(V_{0}/V_{st}) \label{9} \]
Ventaja de HPLC
El aspecto más importante de la HPLC es la alta capacidad de separación que permite el análisis por lotes de múltiples componentes. Incluso si la muestra consiste en una mezcla, la HPLC permitirá que los componentes objetivo se separen, detecten y cuantifiquen. También, bajo condiciones apropiadas, es posible alcanzar un alto nivel de reproducibilidad con un coeficiente de variación no superior al 1%. Además, tiene una alta sensibilidad mientras que un bajo consumo de muestra. La HPLC tiene una ventaja sobre la columna GC de que el análisis es posible para que cualquier muestra pueda disolverse de manera estable en el eluyente y no necesita ser vaporizada.Con esta razón, la HPLC se usa con mucha más frecuencia en el campo de la bioquímica y farmacéutica que en la columna GC.


