3.4: Cromatografía de Fluidos Supercríticos
- Page ID
- 71192
Una herramienta popular y poderosa en el mundo químico, la cromatografía separa mezclas basadas en propiedades químicas, incluso algunas de las que antes se consideraban inseparables. Combina multitud de piezas, conceptos y productos químicos para formar un instrumento adecuado para la separación específica. Una forma de cromatografía que a menudo se pasa por alto es la de la cromatografía de fluidos supercríticos.
Historia
La cromatografía de fluidos supercríticos (SFC) inicia su historia en 1962 bajo el nombre de “cromatografía de gases de alta presión”. Comenzó lento y rápidamente se vio eclipsado por el desarrollo de la cromatografía líquida de alta resolución (HPLC) y la cromatografía de gases ya desarrollada. El SFC no fue un método popular de cromatografía hasta finales de la década de 1980, cuando más publicaciones comenzaron a ejemplificar sus usos y técnicas.
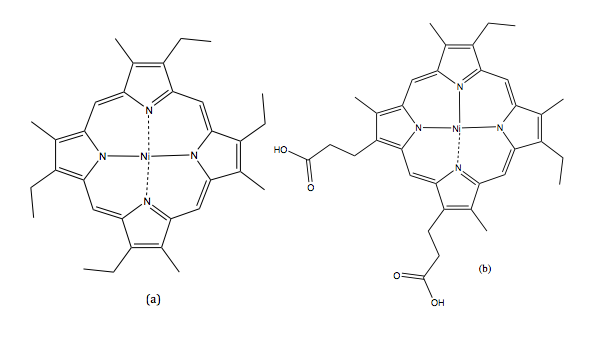
El SFC fue reportado por primera vez por Klesper et al. Lograron separar mezclas de porfirina térmicamente lábiles en fase estacionaria de polietilenglicol con dos unidades de fase móvil: diclorodifluorometano (CCl 2 F 2) y monoclorodifluorometano (CHCl 2 F), como se muestra en la Figura\(\PageIndex{1}\). Sus resultados demostraron que la baja viscosidad pero la alta difusividad de los fluidos supercríticos funcionan bien como una fase móvil.
Después del trabajo de Klesper detallando su procedimiento de separación, los científicos posteriores buscaron encontrar la fase móvil perfecta y los posibles usos para SFC. Utilizando gases como He, N 2, CO 2 y NH 3, examinaron purinas, nucleótidos, esteroides, azúcares, terpenos, aminoácidos, proteínas y muchas más sustancias para determinar su comportamiento de retención. Descubrieron que el CO 2 era un fluido supercrítico ideal debido a su baja temperatura crítica de 31 °C y una presión crítica relativamente baja de 72.8 atm. Ventajas adicionales del CO 2 incluyen que es barato, no inflamable y no tóxico. El CO 2 es ahora la fase móvil estándar para SFC.
En el desarrollo de SFC a lo largo de los años, la técnica se sometió a múltiples fases de prueba y error. La columna capilar tubular abierta SFC tuvo la ventaja de cambiar de manera independiente y cooperativa los tres parámetros (presión, temperatura y contenido de modificador) hasta cierto punto. Como cualquier método de cromatografía, sin embargo, tenía sus inconvenientes. Cambiar la presión, el parámetro más importante, a menudo requería cambiar la velocidad de flujo debido al diámetro constante de los capilares. Adicionalmente, el CO 2, la fase móvil ideal, es no polar, y su polaridad no se puede alterar fácilmente o con un gradiente.
A lo largo de los años, se descubrieron muchos usos para SFC. Se identificó como una herramienta útil en la separación de compuestos quirales, fármacos, productos naturales y organometálicos (ver más abajo para más detalles). La mayoría de los SFC actualmente están involucrados en una columna empaquetada de sílice (o sílice+ modificador) con una fase móvil de CO 2 (o modificador de CO 2 +). La espectrometría de masas es la herramienta más común utilizada para analizar las muestras separadas.
Fluidos Supercríticos
¿Qué es un Fluido Supercrítico?
Como se mencionó anteriormente, la ventaja para los fluidos supercríticos es la combinación de las propiedades útiles de dos fases: líquidos y gases. Los fluidos supercríticos son similares al gas en la forma de expandirse para llenar un volumen dado, y los movimientos de las partículas son cercanos al de un gas. Por el lado de las propiedades líquidas, los fluidos supercríticos tienen densidades cercanas a la de los líquidos y así se disuelven e interactúan con otras partículas, como cabría esperar de un líquido. Para visualizar los cambios de fase en relación con la presión y la temperatura, se utilizan diagramas de fase como se muestra en la Figura\(\PageIndex{2}\)
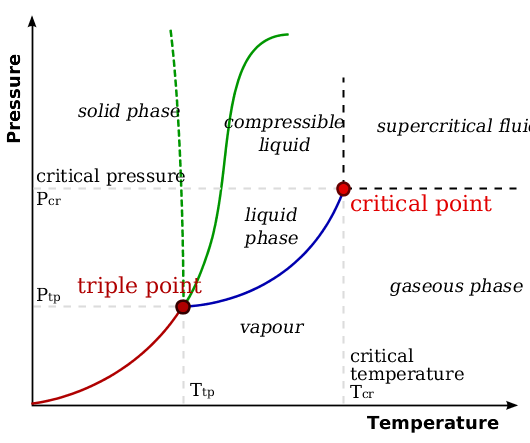
La figura\(\PageIndex{2}\) muestra las marcadas diferencias entre dos fases en relación con las condiciones circundantes. Existen dos regiones ambiguas. Una de ellas es el punto en el que se cruzan las tres líneas: el punto triple. Esta es la temperatura y presión a la que los tres estados pueden existir en un equilibrio dinámico. El segundo punto ambiguo llega al final de la línea líquido/gas, donde apenas termina. A esta temperatura y presión, la sustancia pura ha llegado a un punto en el que ya no existirá como una sola fase u otra: existe como una fase híbrida —un equilibrio dinámico líquido y gaseoso.
Propiedades únicas de los fluidos supercríticos
Como resultado del equilibrio dinámico líquido-gas, los fluidos supercríticos poseen tres cualidades únicas: mayor densidad (en la escala de un líquido), mayor difusividad (similar a la de un gas) y viscosidad reducida (en la escala de un gas). El cuadro\(\PageIndex{1}\) muestra las similitudes en cada una de estas propiedades. Recuerde, cada uno de estos explica una parte de por qué el SFC es un método ventajoso de separación química.
| Densidad (g/mL) | Difusividad (cm2/s) | Viscosidad Dinámica (g/cm s) | |
|---|---|---|---|
| Gas | 1 x 10 -3 | 1 x 10 -1 | 1 x 10 -2 |
| Líquido | 1.0 | 5 x 10 -6 | 1 x 10 -4 |
| Fluido Supercrítico | 3 x 10 -1 | 1 x 10 -3 | 1 x 10 -2 |
Aplicación de las propiedades de los fluidos supercríticos a la cromatografía
¿Cómo son útiles estas propiedades? Una fase móvil y disolvente ideales harán tres cosas bien: interactuar con otras partículas, llevar la muestra a través de la columna y eluirla rápidamente (pero con precisión).
La densidad, como concepto, es simple: cuanto más denso es algo, más probable es que interactúe con las partículas por las que se mueve. Afectada por un aumento en la presión (dada temperatura constante), la densidad se ve afectada en gran medida por una sustancia que ingresa a la zona de fluido supercrítico. Los fluidos supercríticos se caracterizan con densidades comparables a las de los líquidos, lo que significa que tienen un mejor efecto de disolución y actúan como un mejor gas portador. Las altas densidades entre los fluidos supercríticos son imperativas tanto por su efecto como disolventes como por su efecto como gases portadores.
La difusividad se refiere a la rapidez con la que la sustancia puede propagarse entre un volumen. Con el aumento de la presión viene disminuida la difusividad (una relación inversa) pero con el aumento de la temperatura viene el aumento de la difusividad (una relación directa relacionada con su energía cinética). Debido a que los fluidos supercríticos tienen valores de difusividad entre un gas y un líquido, llevan la ventaja de la densidad de un líquido, pero la difusividad más cercana a la de un gas. Debido a esto, pueden transportar y eluir rápidamente una muestra, lo que lo convierte en una fase móvil eficiente.
Finalmente, la viscosidad dinámica puede verse como la resistencia a otros componentes que fluyen a través o se intercalan en el fluido supercrítico. La viscosidad dinámica apenas se ve afectada por la temperatura o la presión de los líquidos, mientras que puede verse muy afectada para los fluidos supercríticos. Con la capacidad de alterar la viscosidad dinámica a través de la temperatura y la presión, el operador puede determinar qué tan resistente debe ser su fluido supercrítico.
Propiedades Supercríticas del CO 2
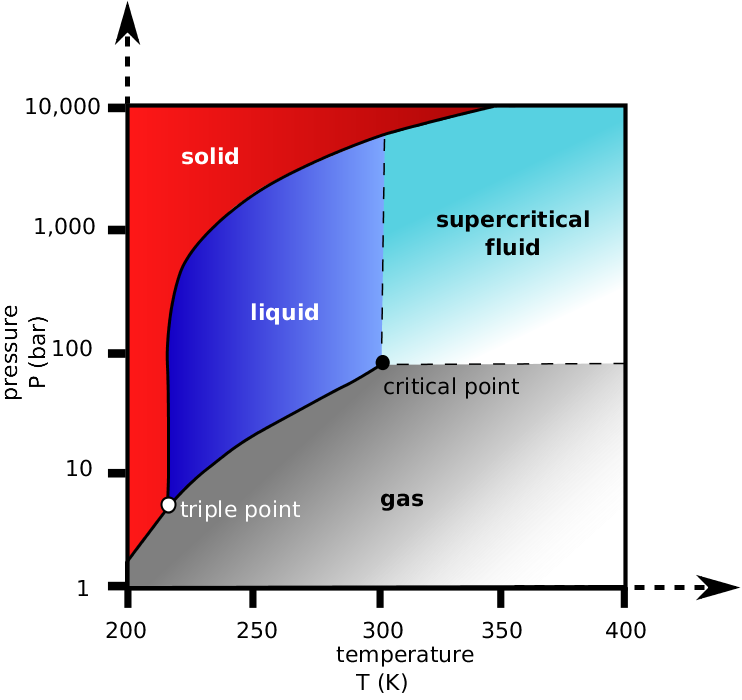
Debido a su uso generalizado en SFC, es importante discutir qué hace que el CO 2 sea un fluido supercrítico ideal. Una de las mayores limitaciones para la mayoría de las fases móviles en SFC es lograr que lleguen al punto crítico. Esto significa temperaturas y presiones extremadamente altas, lo que no es fácilmente alcanzable. Los mejores gases para esto son aquellos que pueden alcanzar un punto crítico a temperaturas y presiones relativamente bajas.
Como se ve en la Figura\(\PageIndex{3}\), el CO 2 tiene una temperatura crítica de aproximadamente 31 °C y una presión crítica de alrededor de 73 atm. Ambos son números relativamente bajos y, por lo tanto, son ideales para SFC. Por supuesto, con cada alza existe una desventaja. En este caso, el CO 2 carece de polaridad, lo que dificulta el uso de sus propiedades de fase móvil para eluir muestras polares. Esto se fija fácilmente con un modificador, que se discutirá más adelante.
El Instrumento
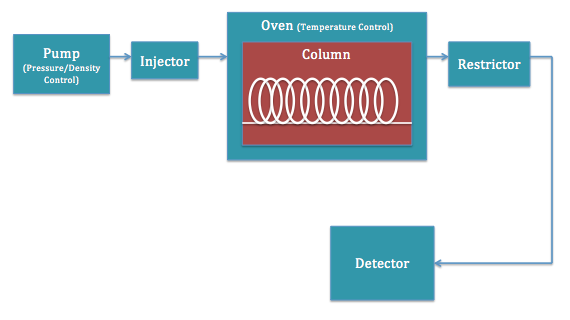
SFC tiene una configuración de instrumentos similar a la mayoría de las otras máquinas de cromatografía, notablemente HPLC. Las funciones de las partes son muy similares, pero es importante entenderlas a los efectos de entender la técnica. La figura\(\PageIndex{4}\) muestra una representación esquemática de un aparato típico.
Columnas
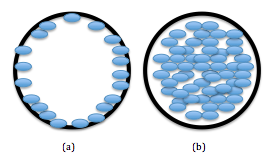
Hay dos tipos principales de columnas utilizadas con SFC: tubular abierta y empaquetada, como se ve a continuación. Las columnas en sí son casi idénticas a las columnas de HPLC en términos de material y recubrimientos. Las columnas tubulares abiertas son las más utilizadas y están recubiertas con un material de sílice reticulado (cuarzo en polvo, SiO 2) para una fase estacionaria. Las longitudes de las columnas varían, pero generalmente caen entre 10 y 20 metros y están recubiertas con menos de 1 µm de fase estacionaria de sílice. La figura\(\PageIndex{5}\) demuestra las diferencias en el empaque de las dos columnas.
Inyector
Los inyectores actúan como el sitio principal para la inserción de muestras. Hay muchos tipos diferentes de inyectores que dependen de una multitud de factores. Para las columnas empaquetadas, la muestra debe ser pequeña y la cantidad exacta depende del diámetro de la columna. Para columnas tubulares abiertas, se pueden utilizar volúmenes más grandes. En ambos casos, existen inyectores específicos que se utilizan dependiendo de cómo se deba colocar la muestra en el instrumento. Un inyector de bucle se utiliza principalmente para pruebas preliminares. La muestra se introduce en una cámara que luego se purga con el fluido supercrítico y se empuja hacia abajo por la columna. Utiliza una bomba de baja presión antes de proceder con la elución completa a presiones más altas. Un inyector en línea permite un fácil control del volumen de la muestra. Una bomba de alta presión fuerza la muestra (medida específicamente) a una corriente de eluyente, que procede a llevar la muestra a través de la columna. Este método permite diluciones específicas y mayor flexibilidad. Para muestras que no requieren dilución o interacción inmediata con el eluyente, es útil un inyector en columna. Esto permite que la muestra se transfiera directamente a la columna empaquetada y la fase móvil para luego pasar a través de la columna.
Bomba
La existencia de un fluido supercrítico, como se discutió anteriormente, depende de altas temperaturas y altas presiones. La bomba se encarga de entregar las altas presiones. Al presurizar el gas (o líquido), puede hacer que la sustancia se vuelva lo suficientemente densa como para exhibir signos del fluido supercrítico deseado. Debido a que la presión se acopla con el calor para crear el fluido supercrítico, los dos suelen estar muy juntos en el instrumento.
Horno
El horno, como se mencionó anteriormente, existe para calentar la fase móvil a su temperatura deseada. En el caso de SFC, la temperatura deseada es siempre la temperatura crítica del fluido supercrítico. Estos hornos están controlados con precisión y son estándar en SFC, HPLC y GC.
Detector
Hasta el momento, ha habido un componente en gran parte pasado por alto de la máquina SFC: el detector. Técnicamente no forma parte del proceso de separación cromatográfica, el detector sigue desempeñando un papel importante: identificar los componentes de la solución. Si bien el SFC tiene como objetivo separar componentes con buena resolución (alta pureza, sin otros componentes mezclados), el detector tiene como objetivo definir de qué está hecho cada uno de estos componentes.
Los dos detectores que se encuentran con mayor frecuencia en los instrumentos SFC son los detectores de ionización de llama (FID) o los espectrómetros de masas (MS):
- Los FID operan ionizando la muestra en una llama alimentada por hidrógeno. Al hacerlo, producen partículas cargadas, que chocan con los electrodos, y las partículas son posteriormente cuantificadas e identificadas.
- MS opera mediante la creación de una pulverización ionizada de la muestra, y luego la separación de los iones en función de una relación masa/carga. La relación masa/carga se grafica frente a la abundancia de iones y crea una “huella” para el químico identificado. Esta huella química se compara luego con una base de datos para aislar qué compuesto era. Esto se puede hacer para cada elución única, haciendo que el SFC sea aún más útil que si estuviera solo.
Muestra
En términos generales, las muestras necesitan poca preparación. El único requisito importante es que se disuelva en un disolvente menos polar que el metanol: debe tener una constante dieléctrica inferior a 33, ya que el CO 2 tiene una polaridad baja y no puede eluir fácilmente las muestras polares. Para combatir esto, se agregan modificadores a la fase móvil.
Fase Estacionaria
La fase estacionaria es un compuesto neutro que actúa como fuente de “fricción” para ciertas moléculas en la muestra a medida que se deslizan a través de la columna. El sílice atrae a las moléculas polares y por lo tanto las moléculas se unen fuertemente, manteniéndose hasta que haya pasado suficiente de la fase móvil para atraerlas. La combinación de las propiedades en la fase estacionaria y la fase móvil ayudan a determinar la resolución y velocidad del experimento.
Fase Móvil
La fase móvil (el fluido supercrítico) empuja la muestra a través de la columna y eluye muestras separadas, puras. Aquí es donde entran en juego las propiedades del fluido supercrítico de alta densidad, alta difusividad y baja viscosidad. Con estas tres propiedades, la fase móvil es capaz de interactuar adecuadamente con la muestra, empujar rápidamente a través de ella y arar fuertemente a través de la muestra para separarla. La fase móvil también determina en parte cómo se separa: primero llevará a cabo moléculas similares, aquellas con polaridades similares, y seguirá gradualmente con moléculas con mayores polaridades.
Modificadores
Se agregan modificadores a la fase móvil para jugar con sus propiedades. Como se mencionó algunas veces anteriormente, el fluido supercrítico CO 2 carece de polaridad. Para agregar polaridad al fluido (sin causar reactividad), a menudo se agregará un modificador polar. Los modificadores suelen elevar un poco la presión crítica y la temperatura de la fase móvil, pero a cambio agregan polaridad a la fase y dan como resultado una muestra completamente resuelta. Desafortunadamente, con demasiado modificador, se necesitan temperaturas y presiones más altas y la reactividad aumenta (lo cual es peligroso y malo para el operador). Los modificadores, como el etanol o el metanol, se utilizan en pequeñas cantidades según sea necesario para la fase móvil con el fin de crear un fluido más polar.
Ventajas de la cromatografía de fluidos supercríticos
Claramente, SFC posee un potencial extraordinario en lo que respecta a las técnicas de cromatografía. Tiene algunas capacidades increíbles que permiten una resolución eficiente y precisa de mezclas. A continuación se muestra un resumen de sus ventajas y desventajas apiladas frente a otros métodos de cromatografía convencionales (competidores).
Ventajas sobre HPLC
- Debido a que los fluidos supercríticos tienen viscosidades bajas, el análisis es más rápido, hay una caída de presión mucho menor a través de la columna y se pueden usar columnas tubulares abiertas.
- Se necesitan longitudes de columna más cortas (10-20 m para SFC versus 15-60 m para HPLC) debido a la alta difusividad del fluido supercrítico. Más interacciones pueden ocurrir en un lapso más corto de tiempo/distancia.
- El poder de resolución es mucho mayor (5x) que la HPLC debido a la alta difusividad del fluido supercrítico. Más interacciones resultan en una mejor separación de los componentes en un menor tiempo.
Ventajas sobre GC
- Capaz de analizar muchos solutos sin derivatización ya que no hay necesidad de convertir la mayoría de los grupos polares en no polares.
- Puede analizar compuestos térmicamente lábiles más fácilmente con alta resolución ya que puede proporcionar un análisis más rápido a temperaturas más bajas.
- Puede analizar solutos con alto peso molecular debido a su mayor poder solubilizante.
Desventajas generales
- No se pueden analizar solutos extremadamente polares debido a la fase móvil relativamente no polar, CO 2.
Aplicaciones
Si bien el uso de SFC ha sido principalmente de orientación orgánica, todavía hay algunas formas en que las mezclas de compuestos inorgánicos se separan usando el método. Los dos principales, la separación de compuestos quirales (principalmente complejos metal-ligando) y organometálicos se discuten aquí.
Compuestos quirales
Para las moléculas quirales, los procedimientos y elección de columna en SFC son muy similares a los utilizados en HPLC. Empacada con fase estacionaria quiral tipo celulosa (o alguna otra fase estacionaria quiral), la muestra fluye a través del compuesto quiral y solo las moléculas con una quiralidad coincidente se pegarán a la columna. Al ejecutar una fase móvil de fluido supercrítico de CO 2 puro, el enantiómero no adherido eluirá primero, seguido eventualmente (pero lentamente) con el otro.
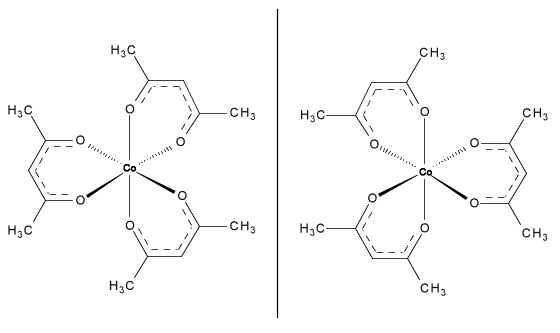
En el campo de la química inorgánica, una mezcla racémica de Co (acac) 3, ambos isómeros mostrados en la Figura, se\(\PageIndex{6}\) ha resuelto utilizando una fase estacionaria quiral basada en celulosa. El método SFC fue uno de los mejores y más eficientes instrumentos en el análisis del compuesto quiral. Si bien el SFC separa fácilmente los compuestos covalentes coordinados, no es necesario utilizar un instrumento tan extenso para separar mezclas del mismo ya que existen muchas técnicas más simples.
Organometálicos
Muchos organometálicos de bloque d son altamente reactivos y se descomponen fácilmente en el aire. SFC ofrece una manera de cromatógrafo mezclas de compuestos organometálicos grandes e inusuales. Se han separado grandes mezclas de compuestos organometálicos a base de cobalto y rodio usando SFC (Figura\(\PageIndex{7}\)) sin exponer los compuestos al aire.
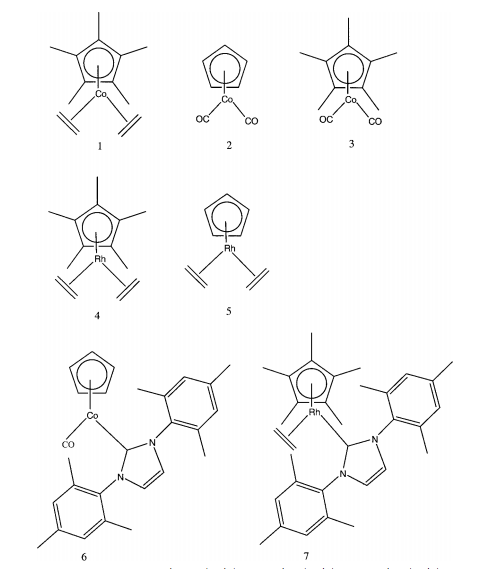
Mediante el uso de una fase estacionaria de siloxanos, partículas de silicio ligadas a oxígeno con diferentes sustituyentes unidos, los organometálicos se resolvieron en función del tamaño y la carga. Gracias a las propiedades no polares, altamente difusivas y de alta viscosidad de un fluido supercrítico 100% CO 2, la mezcla se resolvió y analizó con un detector de ionización de llama. Se determinó que el método fue lo suficientemente sensible como para detectar impurezas de 1%. Debido a que la eficiencia del SFC es tan impresionante, el potencial para ello en el campo organometálico es enorme. La identificación de impurezas por debajo de 1% es prometedora no solo para los datos preliminares en experimentos, sino también para el control de calidad.
Conclusión
Si bien puede tener sus inconvenientes, SFC sigue siendo un recurso sin explotar en las formas de cromatografía. Las ventajas de usar fluidos supercríticos como fases móviles demuestran cómo se puede aumentar la resolución sin sacrificar el tiempo o aumentar la longitud de la columna. Sin embargo, sigue siendo un recurso bien utilizado en las industrias orgánica, biomédica y farmacéutica. SFC se muestra prometedor como una forma confiable de separar y analizar mezclas.


