3.5: Cromatografía iónica
- Page ID
- 71222
La Cromatografía Iónica es un método de separación de iones basado en sus distintas tasas de retención en un material de relleno de fase sólida dado. Dadas las diferentes tasas de retención para dos aniones o dos cationes, el tiempo de elución de cada ion diferirá, permitiendo la detección y separación de un ion antes que el otro. Los métodos de detección se separan entre los métodos electroquímicos y los métodos espectroscópicos. Esta guía cubrirá los principios de las tasas de retención para aniones y cationes, además de describir los diversos tipos de materiales de empaque en estado sólido y eluyentes que se pueden usar.
Principios de Cromatografía Iónica
Modelos de retención en cromatografía aniónica
El modelo de retención para cromatografía aniónica se puede dividir en dos modelos distintos, uno para describir eluyentes con un solo anión y el otro para describir eluyentes con agentes complejantes presentes. Dado un anión eluyente o un anión analito, se observan dos fases, la fase estacionaria (denotada por S) y la fase móvil (denotada por M). Como tal, existe un equilibrio entre las dos fases tanto para los aniones eluyentes como para los aniones analito que puede describirse mediante la Ecuación\ ref {1}.
\[ y*[A^{x-}_{M}]\ +\ x*[E^{y-}_{S}]\ \Leftrightarrow \ y*[A^{x-}_{S}]\ +\ x*[E^{y-}_{M}] \label{1} \]
Esto produce una constante de equilibrio como se da en la Ecuación\ ref {2}.
\[ K_{A,E} = \frac{ [A^{x-}_{S}]^{y} [E^{y-}_{M}]^{x} \gamma ^{y} _{A^{x-}_{S} } \gamma ^{x} _{E^{y-}_{S}} }{ [A^{x-}_{M}] ^{y} [E^{y-}_{S}]^{x} \gamma ^{y} _{A^{x-}_{M}} \gamma ^{x} _{E^{y-}_{S}}} \label{2} \]
Dado que la actividad de los dos iones no se puede encontrar en las fases estacionaria o móvil, los coeficientes de actividad se establecen en 1. Luego se introducen dos nuevas cantidades. El primero es el coeficiente de distribución, D A, que es la relación de concentraciones de analito en la fase estacionaria a la fase móvil, Ecuación\ ref {3}. El segundo es el factor de retención, k 1 A, que es el coeficiente de distribución multiplicado por la relación de volumen entre las dos fases, Ecuación\ ref {4}.
\[ D_{A} \ =\ \frac{[A_{S}]}{[A_{M}]} \label{3} \]
\[k_{A}^{1} \ = \ D_{A} * \frac{V_{S}}{V_{M}} \label{4} \]
Sustituyendo las dos cantidades de la Ecuación\ ref {3} y la Ecuación\ ref {4} en la Ecuación\ ref {2}, la constante de equilibrio puede escribirse como Ecuación\ ref {5}
\[ K_{A,E} \ = (k_{A}^{1} \frac{V_{M}}{V_{S}})^{y} * (\frac{[E_{M}^{y-} ]}{[E^{y-}_{S}]})^{x} \label{5} \]
Dado que generalmente existe una gran diferencia de concentraciones entre el eluyente y el analito (con magnitudes de 10 eluyentes mayores), la ecuación 4 puede ser reescrita bajo el supuesto de que todos los grupos funcionales del material de empaquetamiento en fase sólida son absorbidos por E y-. Como tal, el estacionario E y- puede sustituirse con la capacidad de intercambio dividida por la carga de E y-. Esto produce Ecuación\ ref {6}
\[ K_{A,E} \ = (k_{A}^{1} \frac{V_{M}}{V_{S}})^{y} * (\frac{Q}{\gamma })^{-x} [E_{M}^{y-}] \label{6} \]
Se desarrolla la resolución para el factor de retención Ecuación\ ref {7}.
\[ z*[A^{x-}_{M}] \ +\ x*[B^{z-}_{S}] \Leftrightarrow z* [A^{x-}_{S}] \ +\ x*[B^{z-}_{M}] \label{7} \]
La ecuación\ ref {8} muestra la relación entre el factor de retención y parámetros como la concentración de eluyente y la capacidad de intercambio, lo que permite manipular parámetros de la cromatografía iónica y determinar los factores de retención. La ecuación\ ref {9} solo funciona para un solo analito presente, pero se puede determinar fácilmente una relación para la selectividad entre dos analitos [A] y [B].
Primero se determina el equilibrio entre los dos analitos como Ecuación\ ref {8}
\[ K_{A,B} \ = \frac{[A^{x-}_{S}]^{z} [B^{z-}_{M}]^{x}}{[A^{x-}_{M}]^{z} [B^{z-}_{S}]^{x}} \label{8} \]
La constante de equilibrio se puede escribir como Ecuación\ ref {9} (ignorando la actividad):
\[ \alpha _{A,B} \ = \frac{[A^{x-}_{S}][B^{z-}_{M}]}{[A^{x-}_{M}][B^{z-}_{S}]} \label{9} \]
Entonces se puede determinar que la selectividad es la Ecuación\ ref {10}
\[ \alpha _{A,B} \ = \frac{[A^{x-}_{S}][B^{z-}_{M}]}{[A^{x-}_{M}][B^{z-}_{S}]} \label{10} \]
La ecuación\ ref {10} puede entonces simplificarse en una forma logarítmica como las siguientes dos ecuaciones:
\[ \log \alpha _{A,B} = \frac{1}{z} log K_{A,B} \ + \frac{x-z}{z} log \frac{ k_{A}^{1} V_{M}}{V_{S}} \label{11} \]
\[ \log \alpha _{A,B} = \frac{1}{x} log K_{A,B} \ + \frac{x-z}{z} log \frac{ k_{A}^{1} V_{M}}{V_{S}} \label{12} \]
Cuando las dos cargas son iguales, se puede observar que la selectividad es sólo un factor de los coeficientes de selectividad y de las cargas. Cuando los dos cargos son diferentes, se puede ver que los dos factores de retención dependen uno del otro.
En situaciones con un eluyente poliatómico, se utilizan tres modelos para dar cuenta de los múltiples aniones en el eluyente. El primero es el modelo de equilibrio dominante, en el que un anión es tan dominante en concentración; los otros aniones eluyentes son ignorados. El modelo de equilibrio dominante funciona mejor para analitos multivalentes. El segundo es el modelo de carga efectiva, donde se encuentra una carga efectiva de los aniones eluyentes, y se encuentra una relación similar a la EQ con la carga efectiva. Los modelos de carga efectiva funcionan mejor con analitos monovalentes. El tercero es el modelo de especies de eluyentes múltiples, donde la Ecuación\ ref {13} describe el factor de retención:
\[ \log K_{A}^{1} \ =\ C_{3} - (\frac{X_{1}}{a} + \frac{X_{2}}{b} + \frac{X_{3}}{c}) -\ log C_{P} \label{13} \]
C 3 es una constante que incluye la relación de volumen de fase entre estacionario, constante de equilibrio y móvil y la capacidad de intercambio. C p es la concentración total de la especie eluyente. X 1, X 2, X 3, corresponden a las acciones de un anión eluyente particular en la retención del analito.
Modelos de retención de cromatografía catiónica
Para eluyentes con un solo catión y analitos que son metales alcalinotérreos, metales pesados o metales de transición, se utiliza un agente complejante para unirse con el metal durante la cromatografía. Esto introduce la cantidad A (m) en los cálculos de la tasa de retención, donde A (m) es la relación entre el ión metálico libre y la concentración total de metal. Siguiendo una derivación similar al caso de anión único, se encuentra la Ecuación\ ref {14}.
\[ K_{A,E} = \ (\frac{ k_{A}^{1}}{ \alpha _{M} \phi } )^{y} * (\frac{Q}{\gamma })^{-x} [E ^{y+} _{M} ]^{x} \label{14} \]
Resolviendo para el coeficiente de retención, se encuentra la Ecuación\ ref {15}.
\[ k_{A}^{1} = \alpha _{M} \phi * K_{A,E} ^{\frac{1}{\gamma } } (\frac{Q}{\gamma })^{\frac{x}{y} } ([E_{M}^{y+}]^{- \frac{x}{y} } \label{15} \]
A partir de esta expresión, la tasa de retención del catión se puede determinar a partir de la concentración de eluyente y la relación de iones metálicos libres a la concentración total del metal, que a su vez depende del equilibrio del ión metálico con el agente complejante.
Materiales de embalaje en fase sólida
El material de empaquetamiento en fase sólida utilizado en la columna de cromatografía es importante para la capacidad de intercambio del anión o catión. Hay muchos tipos de material de empaque, pero todos comparten un grupo funcional que puede unir el anión o el complejo catiónico. El grupo funcional se monta sobre una superficie o esfera de polímero, lo que permite una gran superficie para la interacción.
Material de Embalaje para Cromatografía Aniónica
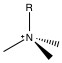
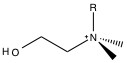
El grupo funcional primario utilizado para la cromatografía aniónica es el grupo amonio. Los grupos amina se montan en la superficie del polímero, y el pH se baja para producir grupos amonio. Como tal, la capacidad de intercambio depende del pH del eluyente. Para reducir la dependencia del pH, los protones sobre el amonio se reemplazan sucesivamente por grupos alquilo hasta que se reemplazan todos los protones y el grupo funcional sigue cargado positivamente, pero es independiente del pH. Los dos materiales de empaque utilizados en casi toda la cromatografía aniónica son trimetilamina (NMe 3, Figura\(\PageIndex{1}\)) y dimetilanolamina (Figura\(\PageIndex{2}\)).
Material de embalaje para cromatografía catiónica
La cromatografía catiónica permite el uso de material de empaque a base de polímero orgánico y gel de sílice. En el material de empaque a base de gel de sílice, el material de empaque más común es un gel de sílice recubierto de polímero. El silicato se recubre en polímero, el cual se mantiene unido por reticulación del polímero. Luego se usa ácido polibutadieno maleico (Figura\(\PageIndex{3}\)) para crear un material débilmente ácido, permitiendo que el analito se difunda a través del polímero y se intercambie. El material de relleno basado en gel de sílice está limitado por la solubilidad dependiente del pH del gel de sílice y la unión dependiente del pH del gel de sílice y el polímero funcionalizado. Sin embargo, el material de empaque basado en gel de sílice es adecuado para la separación de metales alcalinos y metales alcalinotérreos.
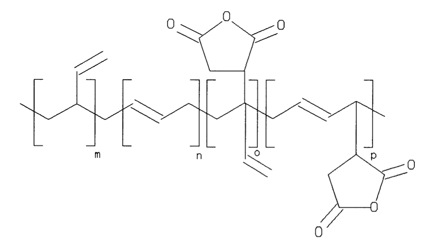
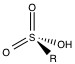
El material de empaque a base de polímero orgánico no está limitado por el pH como lo están los materiales de gel de sílice, pero no son adecuados para la separación de metales alcalinos y metales alcalinotérreos. El grupo funcional más común es el grupo ácido sulfónico (Figura\(\PageIndex{4}\)) unido con un espaciador entre el polímero y el grupo ácido sulfónico.
Métodos de detección
Métodos de detección espectroscópica
La detección fotométrica en la región UV del espectro es un método común de detección en cromatografía iónica. Los métodos fotométricos limitan las posibilidades de eluyente, ya que el analito debe tener una longitud de onda de absorbancia única para ser detectable. Los cationes que no tienen una longitud de onda de absorbancia única, es decir, el eluyente y otros contaminantes tienen espectros UV visibles similares pueden complejarse para compuestos UV visibles. Esto permite la detección del catión sin interferencia de los eluyentes.
El acoplamiento de la cromatografía con diversos tipos de espectroscopía como la espectroscopia de masas o la espectroscopia IR puede ser un método útil de detección. La espectroscopia de emisión atómica de plasma acoplado inductivamente es un método comúnmente utilizado.
Métodos de Conductividad Directa
Los métodos de conductividad directa aprovechan el cambio en la conductividad que produce un analito en el eluyente, el cual puede modelarse mediante la Ecuación\ ref {16} donde la conductividad equivalente se define como Ecuación\ ref {17}.
\[ \Delta K \ =\frac{(\Lambda _{A} \ -\ \Lambda _{g} ) * C_{s}}{1000} \label{16} \]
\[ \Lambda \ =\frac{L}{A*R} * \frac{1}{C} \label{17} \]
Siendo L la distancia entre dos electrodos del área A y R siendo la resistencia que crea el ion. C es la concentración del ion. La conductividad se puede trazar a lo largo del tiempo, y los picos que aparecen representan diferentes iones que vienen a través de la columna como se describe en la Ecuación\ ref {18}
\[ K_{peak} \ =\ (\Lambda _{A} \ -\ \Lambda _{g})*C_{A} \label{18} \]
Los valores de Conductividad Equivalente del analito y del eluyente iones comunes se pueden encontrar en la Tabla\(\PageIndex{1}\)
| Cations | \(\Lambda ^{+} (S\ cm^{2} eq^{-1} ) \) | Aniones | \(\Lambda ^{-} (S\ cm^{2} eq^{-1} ) \) |
|---|---|---|---|
| \( H^{+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">350 | \( OH^{-} \) | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">198 |
| \( Li ^{+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">39 | \( F^{-} \) | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">54 |
| \( Na^{+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">50 | \( Cl^{-} \) | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">76 |
| \( K^{+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">74 | \( Br^{-} \) | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">78 |
| \( NH^{4+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">73 | \( I^{-} \) | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">77 |
| \( 1/2 Mg^{2+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">53 | \( NO^{-}_{2} \) | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">72 |
| \( 1/2 Ca^{2+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">60 | \( NO^{-}_{3} \) | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">71 |
| \( 1/2Sr^{2+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">59 | \( HCO_{3}^{-} \) | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">45 |
| \( 1/2 Ba^{2+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">64 | \( 1/2 CO_{3}^{2-} \) | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">72 |
| \( 1/2 Zn^{2+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">52 | \( H_{2}PO_{4}^{-} \) | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">33 |
| \( 1/2 Hg^{2+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">53 | \( 1/2 HPO_{4}^{-} \) | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">57 |
| \( 1/2 Cu^{2+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">55 | \( 1/3 PO_{4}^{-} \) | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">69 |
| \( 1/2 Pb ^{2+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">71 | \( 1/2 SO_{4}^{2-} \) | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">80 |
| \( 1/2 Co ^{2+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">53 | \( CN^{-} \) | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">82 |
| \( 1/3 Fe^{3+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">70 | \( SCN^{-} \) | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">66 |
| \( N(Et)^{4+} \) | \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) ">33 | Acetato | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">41 |
| \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) "> | 1/2 ftalato | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">38 | |
| \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) "> | Propionato | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">36 | |
| \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) "> | Benzoato | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">32 | |
| \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) "> | Salicilato | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">30 | |
| \ (\ Lambda ^ {+} (S\ cm^ {2} eq^ {-1})\) "> | 1/2 Oxalato | \ (\ Lambda ^ {-} (S\ cm^ {2} eq^ {-1})\) ">74 |
Eluyentes
La elección del eluyente depende de muchos factores, a saber, el pH, la capacidad de tampón, la concentración del eluyente y la naturaleza de la reacción del eluyente con la columna y el material de empaque.
Eluyentes en Cromatografía Aniónica
En la cromatografía aniónica no suprimida, donde el eluyente y el analito no se alteran entre la columna y el detector, existe una amplia gama de eluyentes a utilizar. En el caso no suprimido, el único problema que podría surgir es si el eluyente alteró la capacidad de detección (absorbiendo en un lugar similar en un espectro UV como el analito por ejemplo). Como tal, hay una serie de eluyentes de uso común. Los ácidos carboxílicos aromáticos se utilizan en la detección de conductividad debido a su baja autoconductividad. Los ácidos carboxílicos alifáticos se utilizan para la detección UV/visible porque son transparentes a los rayos UV. Los ácidos inorgánicos solo pueden ser utilizados en la detección fotométrica.
En la cromatografía aniónica suprimida, donde el eluyente y el analito se tratan entre la columna y la detección, se pueden usar menos eluyentes. El supresor modifica el eluyente y el analito, reduciendo la autoconductividad del eluyente y posiblemente aumentando la autoconductividad del analito. Solo se pueden usar hidróxidos y carbonatos alcalinos, boratos, hidrogenocarbonatos y aminoácidos como eluyentes.
Eluyentes en cromatografía catiónica
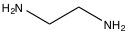
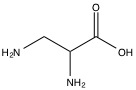
Los eluyentes primarios utilizados en la cromatografía catiónica de metales alcalinos y amonios son ácidos minerales como el HNO 3. Cuando el catión es multivalente, las bases orgánicas como la etilendiamina (Figura\(\PageIndex{5}\)) sirven como eluyentes principales. Si están presentes tanto metales alcalinos como metales alcalinotérreos, se utiliza ácido clorhídrico o ácido 2,3-diaminopropiónico (Figura\(\PageIndex{6}\)) en combinación con una variación de pH. Si no se suprime la cromatografía, la medición de conductividad directa del analito se mostrará como un pico negativo debido a la alta conductividad del H + en el eluyente, pero se puede utilizar una inversión simple de los datos para rectificar esta discrepancia.
Si los analitos en cuestión son metales de transición o H +, se utilizan ácidos carboxílicos complejantes para suprimir la carga del analito y crear complejos fotométricamente detectables, renunciando a la necesidad de conductividad directa como método de detección.


